Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
- Пример разбора простых реакций
- Пример разбора сложной реакции
- Видео
- Коэффициенты и как правильно их расставлять в химической формуле
- Содержание:
- Алгоритм расстановки коэффициентов
- Примеры расстановки коэффициентов в уравнениях
- Как расставить коэффициенты в окислительно-восстановительных реакциях (ОВР)
- Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
- Урок по химии на тему расстановка коэффициентов в уравнениях химических реакций» (8 кл.)
- Краткое описание документа:
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Видео
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
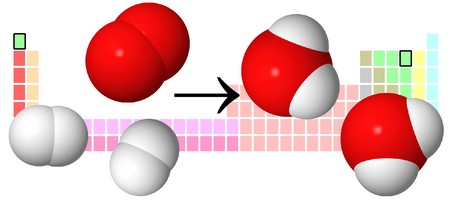
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Видео:8 класс - Химия - Химические уравнения. Правила подбора коэффициентовСкачать

Коэффициенты и как правильно их расставлять в химической формуле
Содержание:
Химическое уравнение – отражение взаимодействия соединений формулами. Согласно закону сохранения массы в обеих сторонах уравнения должно быть равное количество атомов. Этот закон соблюдается с помощью расстановки коэффициентов.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Алгоритм расстановки коэффициентов
- Подсчет количества атомов в обеих частях уравнения.
- Нахождение наименьшего общего кратного у элементов, количество которых в обеих частях уравнения отличается.
- Разделение наименьшего общего кратного на индексы атомов.
- Расстановка полученных коэффициентов.
- Пересчет количества атомов.
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Примеры расстановки коэффициентов в уравнениях
В реакции участвуют углерод С, водород Н и кислород О. При подсчете атомов можно получить следующие результаты:
- один атом углерода слева и один справа;
- четыре водорода слева и два справа;
- два кислорода слева и три справа.
Количество атомов углерода совпадает, поэтому соединения углерода не нуждаются в коэффициентах.
Чтобы поставить коэффициент перед водородом, необходимо найти наименьшее общее кратное – 2. Поэтому вода Н2О нуждается в коэффициенте 2.
Стоит обратить внимание на то, что из-за постановки коэффициента перед водой количество кислорода увеличивается. В данном варианте уравнения слева находится два кислорода, а справа – четыре. Перед кислородом нужен коэффициент 2.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как расставить коэффициенты в окислительно-восстановительных реакциях (ОВР)
1. В уравнении нужно найти восстановитель и окислитель. Для этого следует расставить степени окисления у каждого атома.
H + Cl — +K + Mn +7 O -2 4=Mn +2 Cl — 2+K + Cl — +Cl 0 2+H + 2O -2
Теперь можно определить восстановитель и окислитель.
Mn +7 +5ē→Mn +2 (окислитель)
2Cl — -2ē→Cl 0 2 (восстановитель)
2. Затем необходимо найти наименьшее общее кратное принятых и отданных электронов. В данной реакции оно равно 10. Таким образом, у соединений марганца должен стоять коэффициент 2, а коэффициент 5 должен стоять только у газа хлора в правой части уравнения. Перед соляной кислотой в левой части уравнения коэффициент ставить рано, т. к. водород не изменил степень окисления.
3. Необходимо уравнять металлы. Слева два атома калия, а справа один, поэтому перед хлоридом калия необходимо поставить коэффициент 2.
4. Нужно уравнять количество хлора. Справа 16 атомов хлора, а слева только один. Перед соляной кислотой ставят коэффициент 16.
5. Затем необходимо посчитать количество водорода. Слева 16 атомов водорода, а справа 2, поэтому перед водой нужен коэффициент 8.
6. В обеих частях уравнения по 8 атомов кислорода.
Видео:Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Чтобы расставить степени окисления в органическом соединении, необходимо расписать полную формулу вещества.
Каждый атом углерода связан с тремя атомами водорода и одним углерода. Водород в данном соединении играет роль восстановителя, поэтому отдает электроны. Таким образом, атом углерода получает три электрона и принимает степень окисления -3.
С -3 -7ē→С +4 (восстановитель, окисление)
2О 0 +4ē→О -2 2 (окислитель, восстановление)
Исходя из метода электронного баланса, в уравнении стоят следующие коэффициенты.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Урок по химии на тему расстановка коэффициентов в уравнениях химических реакций» (8 кл.)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Расстановка коэффициентов в уравнениях химических реакций
Учитель химии МБОУ ОСОШ №2
Володченко Светлана Николаевна
РАССТАНОВКА КОЭФФИЦИЭНТОВ В УРАВНЕНИЯХ ХИМИЧЕСКИХ РЕАКЦИЙ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а ) водорода : 8NH3, NaOH, 6NaOH, 2NaOH, НзРО 4, 2H2SO4, 3H2S04, 8H2SO4;
6) кислорода : C02, 3C02, 2C02, 6CO,, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 -1 атом А1 — 4
. Первичная проверка усвоения знаний(8-10 мин .).
. В левой части схемы два атома кислорода, а в правой — один. Число атомов нужно выровнять с помощью коэффициентов.
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2 ↑
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1.Что такое уравнение химической реакции?
2.Что записывают в правой части уравнения? А в левой?
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Краткое описание документа:
Расстановка коэффициентов в уравнениях химических реакций
Учитель химии МБОУ ОСОШ №2
Володченко Светлана Николаевна
РАССТАНОВКА КОЭФФИЦИЭНТОВ В УРАВНЕНИЯХ ХИМИЧЕСКИХ РЕАКЦИЙ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а ) водорода : 8NH3, NaOH, 6NaOH, 2NaOH, НзРО 4, 2H2SO4, 3H2S04, 8H2SO4;
6) кислорода : C02, 3C02, 2C02, 6CO,, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 -1 атом А1 — 4
. Первичная проверка усвоения знаний(8-10 мин .).
. В левой части схемы два атома кислорода, а в правой — один. Число атомов нужно выровнять с помощью коэффициентов.
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2 ↑
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1.Что такое уравнение химической реакции?
2.Что записывают в правой части уравнения? А в левой?
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 862 человека из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 48 человек из 20 регионов
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 375 человек из 64 регионов
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Видео:Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 842 557 материалов в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 18.04.2016
- 3965
- 13
- 18.04.2016
- 1231
- 10
- 18.04.2016
- 1482
- 5
- 18.04.2016
- 5669
- 28
- 18.04.2016
- 653
- 0
- 18.04.2016
- 1382
- 7
- 18.04.2016
- 1037
- 0
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 18.04.2016 3489
- DOCX 24.3 кбайт
- 75 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Володченко Светлана Николаевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет
- Подписчики: 0
- Всего просмотров: 18176
- Всего материалов: 7
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Химические уравнения 8 класс - как расставить коэффициенты ?Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Минобрнауки отменило плановые и внеплановые проверки вузов в 2022 году
Время чтения: 1 минута
Эвакуированные в Россию из ДНР и ЛНР дети смогут поступить в вузы по квоте
Время чтения: 1 минута
Минпросвещения проведет Всероссийский конкурс для органов опеки и попечительства
Время чтения: 1 минута
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
💡 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Как уравнивать коэффициенты (химия)Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Коэффициенты в уравнениях химических реакцийСкачать

Как определить тип химической реакцииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать