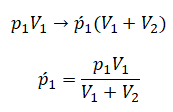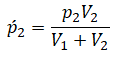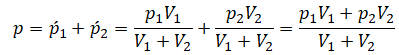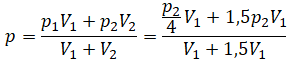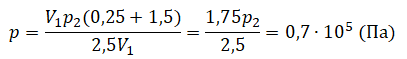В природе и в технике мы очень часто имеем дело не только с одним чистым газом, но со смесью нескольких газов. Например воздух, это смесь азота, кислорода, аргона, углекислого газа и других газов. От чего зависит давление смеси газов?
В 1801 г. Джон Дальтон установил, что давление смеси нескольких газов равно сумме парциальных давлений всех газов, составляющих смесь.
Этот закон получил название закона парциальных давлений газов
Закон Дальтона Парциальное давление каждого газа, входящего в состав смеси, это давление, которое создавалось бы той же массой данного газа, если он будет занимать весь объем смеси при той же температуре.
Закон Дальтона устанавливает, что давление смеси (идеальных) газов составляет сумму парциальных давлений компонент смеси (парциальное давление компоненты – это давление, которое компонента оказала бы, если бы она одна занимала все пространство, занятое смесью). Этот закон указывает, что на каждую компоненту не воздействует присутствие других компонент и свойства компоненты в смеси не меняются.
Два закона Дальтона
Закон 1 Давление смеси газов равно сумме их парциальных давлений. Из этого следует, что парциальное давление компонента газовой смеси равно произведению давления смеси на молярную долю этого компонента.
Закон 2 Растворимость компонента газовой смеси в данной жидкости при постоянной температуре пропорциональна парциальному давлению этого компонента и не зависит от давления смеси и природы других компонентов.
Законы сформулированы Дж. Дальтоном соотв. в 1801 и 1803.
Уравнение закона Дальтона
Как уже отмечалось, отдельные компоненты смеси газов считаются независимыми. Поэтому каждая компонента создает давление:
[ p = p_i k T quad left(1right), ]
а полное давление равно сумме давлений компонент:
[ p = p_ k T + p_ k T + cdots + p_ k T = p_ + p_ + cdots + p_ quad left(2right),]
где ( p_i ) — парциальное давление i газовой компоненты. Это уравнение — закон Дальтона.
При больших концентрациях, больших давлениях закон Дальтона не выполняется в точности. Так как проявляется взаимодействие между компонентами смеси. Компоненты перестают быть независимыми. Дальтон объяснил свой закон с помощью атомистической гипотезы.
Пусть имеется i компонент в смеси газов, тогда уравнение Менделеева — Клайперона будет иметь вид:
где ( m_i ) — массы компонент смеси газа, ( _i ) — молярные массы компонент смеси газа.
Если ввести ( leftlangle mu rightrangle ) такую, что:
то уравнение (3) запишем в виде:
Закон Дальтона можно записать в виде:
Следствием закона Дальтона можно считать следующее выражение:
[ p_i=x_ip quad left(7right), ]
где ( x_i-молярная концентрация i-го ) газа в смеси, при этом:
где ( _i ) — количество молей ( i-го ) газа в смеси.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Закон Дальтона
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Давление смеси газов равно сумме их парциальных давлений.
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Парциальное давление — давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Применение закона Дальтона при решении задач
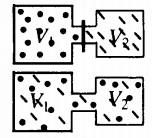
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля — Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Алгоритм решения
Решение
Запишем исходные данные:
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
p 23 = p 2 . . + 3 p 2 . . = 2 p
Потом кран 2–3 закрыли, но открыли кран 1–2. Применим закон Дальтона, получим:
p 12 = 2 p 2 . . + p 2 . . = 3 p 2 . .
Теперь применим закон Менделеева — Клапейрона:
Для начального состояния газа в 1 сосуде:
Для конечного состояния газа в 1 сосуде:
3 p 2 . . V = ν 2 R T
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
pазбирался: Алиса Никитина | обсудить разбор | оценить

Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
Решение
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Атомная теория Дальтона
Новая эпоха начинается в химии с атомистики (следовательно, не Лавуазье, а Дальтон —отец современной химии)…
Ученые XVIII в. не смогли связать атомистические представления с учением о химических элементах. Все Они ошибочно полагали, что элементы состоят из одинаковых, но различным образом расположенных атомов.
Такой подход, во-первых, никак не объяснял качественного многообразия окружающего мира, а во-вторых, не мог дать химикам правильного ответа на интересующие их вопросы. Поэтому к концу XVIII в. исследователи, занимающиеся поиском химических элементов и изучением их свойств, почти полностью отошли от атомистических представлений.
Выход из создавшегося положения нашел Д. Дальтон, который предположил, что атомы различных элементов имеют различную массу. При химических реакциях атомы сближаются и образуют молекулы химического соединения. Масса любой молекулы равна сумме масс составляющих ее атомов. Теория Дальтона отражала наиболее важную для того времени сторону химических превращений — соотношение масс реагирующих веществ.
Для объяснения имеющихся экспериментальных данных Д. Дальтон наделил атомы тремя свойствами: атомы неизменны и неделимы (обоснование закона сохранения массы веществ при химических реакциях); все атомы одного и того же элемента тождественны (обоснование закона постоянства состава); атомы способны соединяться между собой в различных отношениях (обоснование закона кратных отно шений).
Поскольку абсолютные массы атомов невозможно было определить непосредственным взвешиванием, Д. Дальтон предложил рассчитывать относительные томные массы, приняв массу атома водорода за еди ницу.
На основании данных химического анализа различных соединений он к 1810 г. вычислил относительные атомные массы девятнадцати элементов. Однако при своих расчетах Д. Дальтон руководствовался неправильным представлением об атомном составе молекул.
Он совершенно произвольно считал, что элементы соединяются друг с другом в соответствии с принципом наибольшей простоты, и записывал формулу аммиака как NH, поды — НО, этилена — СН, а метана — СН2. Соответственно ошибочными получались и значения атомных масс.
В 1818 г. известный шведский химик Иене Якоб Берцелиус предложил выражать относительные атомные массы в кислородных единицах, принимая массу атома кислорода за 100. Но от перехода к другой системе отсчета численные значения атомных масс правильнее не стали.
Убедившись, что с помощью только закона кратных отношений и теории Дальтона невозможно определить истинные значения атомных масс, английский химик Уильям Волластон начал использовать в повседневных расчетах величины химических эквивалентов элементов.
Химическим эквивалентом элемента называется такое его количество, которое соединяется с одной частью водорода или с восемью частями кислорода или замещает их в других соединениях. Оказалось, что
элементы соединяются друг с другом в количествах, пропорциональных их эквивалентам (закон эквивалентов.
Развитие атомистической теории совпало по времени с широким изучением электрических явлений. Это нашло свое отражение во взглядах ученых на природу атомов. В начале XIX в. общераспространенным было мнение, что между атомами и электричеством существует тесная связь и что в основе соединения атомов друг с другом лежат электрические процессы.
Например, профессор Московского универ ситета М Г. Павлов еще а 1819 г. развивал в своих лекциях представление об атоме, как о сложной планетарной системе, построенной из положительного и отрицательного электричества. Известный английский химик Гэмфри Дэви писал: «Химическое сродство немыслимо без одновременной отдачи электричества одним веществом и прием» другим».
В 1818 г. Я. Берцелиус разработал общую теорию строения химических соединений, положив в ее основу следующие положения:
1. Все атомы состоят из положительно и отрицательно заряженных частиц и соединяются между собой при помощи кулоновских сил.
2. Атомы металлов имеют избыток положительного электричества, а атомы неметаллов — избыток отрицательного электричества.
Теория Берцелиуса объяснила относительную легкость взаимодействия металлов с неметаллами и различие их физических и химических свойств. Однако она не смогла объяснить причин, вызывающих соединение неметаллов друг с другом, и была постепенно оставлена.
Выдающийся английский физик Майкл Фарадей писал по этому поводу: «…понадобится более точное и широкое познание природы электричества и того, каким образом оно связано с атомами материи, прежде чем мы сможем правильно понять действие силы, которая вызывает соединение атомов».
Статья на тему Атомная теория Дальтона
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
📸 Видео
Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Уравнивание реакций горения углеводородовСкачать

ХИМИЯ — ТОП 5 Ошибок в Решении Задач по Химии / Как составлять Уравнение Реакции и Решать ПропорцииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Физика. МКТ: Смеси газов. Закон Дальтона. Центр онлайн-обучения «Фоксфорд»Скачать

🔴 ЕГЭ-2023 по физике. Уравнение Менделеева-Клапейрона. Закон ДальтонаСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Изопроцессы. Графики изопроцессов. Закон Дальтона. 1 часть. 10 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать