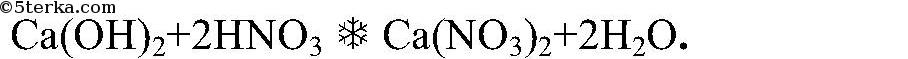Ответ: (в вопросе очевидно ошибка — таблица № 11)
1) Щелочи реагируют с кислотами:
2) Щелочи реагируют с растворами солей (с образованием нерастворимого основания)
3) Щелочи реагируют с кислотными оксидами

задача №4
к главе «Глава V. Обобщение сведений о важнейших классах неорганических соединений. Задачи к § 31 (стр. 86)».
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Пользуясь таблицей 11 составьте по три уравнения соответствующих реакций в которых участвуют щелочи
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1 С помощью уравнений реакций проиллюстрируйте химические свойства едкого кали KOH, известковой воды, баритовой воды – Ba(OH)2.
1. Реагируют с кислотными оксидами:
2KOH + CO2 = K2CO3 + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
Ba(OH)2 + CO2 = BaCO3 + H2O
2. Реагируют с кислотами:
KOH + HCl = KCl + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
3. Реагируют с растворимыми солями:
2KOH + CuCl2 = 2KCl + Cu(OH)2↓
Ca(OH)2 + FeCl2 = CaCl2 + Fe(OH)2↓
Ba(OH)2 + FeCl2 = BaCl2 + Fe(OH)2↓
Задание 2 Подумайте, какие правила предосторожности следует соблюдать при приготовлении растворов щелочей.
1. Кристалические щёлочи брать только шпателем (или пинцетом).
2. Кристалические щёлочи брать небольшими порциями и добавлять их в воду, а не наоборот.
3. Работать в спецодежде (халате, защитных очках, перчатках) во избежание попадания щелочи на кожу и в глаза.
4. При попадании щелочи на кожу необходимо смыть большим количеством воды, а затем нейтрализовать раствором борной, уксусной или лимонной кислотой.
Задание 3 Из варианта I малого химического тренажёра (см. табл. 20, с. 144) выберите вещества, способные вступать во взаимодействие с соляной кислотой. Составьте уравнения соответствующих реакций.
CaO + 2HCl = CaCl2 + H2O
AgNO3 + HCl = HNO3 + AgCl↓
Mg + 2HCl = MgCl2 + H2↑
Задание 4 Как вы думаете, целесообразно ли в промышленности получать щёлочи способами, рассмотренными в данном параграфе? Ответ обоснуйте.
Получать щелочи промышленным способом из соответствующих металлов или их оксидов нецелесообразно, т.к. в природе щелочные металлы в свободном виде и в виде оксидов не встречаются.
В промышленности щелочи получают электролизом водных растворов их солей.
Задание 5 В трёх пробирках находятся образцы твёрдых веществ: гидроксида натрия, гидроксида кальция и оксида цинка. Как различить эти вещества? По растворению в воде. Оксид кальция не растворится в воде, гидроксид натрия растворится в воде полностью, а малорастворимый гидроксид кальция ― частично.
Задание 6 В трёх пробирках находятся растворы соляной кислоты, едкого натра и известковой воды. Предложите самый короткий способ их определения. Во все пробирки добавить раствор фенолфталеина. В пробирке с соляной кислотой цвет раствора не изменится, а в пробирках с едким натром и известковой водой раствор окрасится в малиновый цвет. Пропустить выдыхаемый воздух через окрашенные растворы. В пробирке, содержащей мутный раствор ― известковая вода, а в другой ― едкий натр.
Задание 8 Вычислите объём (л) оксида углерода (IV) (н.у.), который можно получить из 500 г карбоната кальция.
Дано:m(CaCO3)=500 г
Найти: V(CO2)—?
Решение
1 способ
1. Количество вещества рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(CaCO3)=100 г/моль
n( CaCO3 )=m( CaCO3 )/M( CaCO3 )=500 г : 100 г/моль=5 моль
2. Составим химическое уравнение:
CaCO3 = CaO + CO2↑
По уравнению реакции n(CaCO3):n(CO2)=1:1 , количество вещества одинаковое, поэтому
n(CO2)=n(CaCO3)=5 моль
3. Рассчитываем объем оксида углерода (IV) количеством вещества 5 моль по формуле: V=n•VM, где VM― молярный объем.
V(CO2)=n(CO2)•VM=5 моль • 22,4 л/моль=112 л
2 способ
Составим химическое уравнение:
500 г х л
CaCO3 = CaO + CO2↑
100 г 22,4 л
Над формулами соединений CaCO3 и CO2 записываем заданную в условии задачи массу карбоната кальция и неизвестный объем оксида углерода (IV) (500 г и х л соответственно), а под формулами соединений ― массу и объем соответствующего количества вещества согласно коэффициентам в химическом уравнении. Для этого вычисляем молярную массу карбоната кальция и, соответственно, массу 1 моль, т.к. прореагировало 1 моль CaCO3 с образованием 1 моль CO2 (1 моль любого газа при н.у. занимает объем 22,4 л)
M(CaCO3)=100 г/моль, масса 1 моль=100 г
х=V(CO2)=22,4 л • 500 г : 100 г=112 л
Ответ: 112 л CO 2
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Вопрос № 4 Пользуясь таблицей 13 (пп. 1,4 и 5 учебника), составьте по три уравнения соответствующих реакций, в которых участвуют щелочи
 Решебник по химии за 8 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №4 к главе «Глава V. Обобщение сведений о важнейших классах неорганических соединений. Задачи к § 31 (стр. 86)». Решебник по химии за 8 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №4 к главе «Глава V. Обобщение сведений о важнейших классах неорганических соединений. Задачи к § 31 (стр. 86)». |
Условие задачи: Вопрос № 4 Пользуясь таблицей 13 (пп. 1,4 и 5 учебника), составьте по три уравнения соответствующих реакций, в которых участвуют щелочи.
Ответ: (в вопросе очевидно ошибка — таблица № 11)
1) Щелочи реагируют с кислотами:
2) Щелочи реагируют с растворами солей (с образованием нерастворимого основания)
🔍 Видео
8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений реакций горения. 11 класс.Скачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

8 класс. Степень окисления.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать

Как решать уравнения с модулем или Математический торт с кремом (часть 1) | МатематикаСкачать

Комплексные соединения. 1 часть. 11 класс.Скачать

Рудзитис Фельдман 2016 задача 3 стр 11 9 класс решениеСкачать

Химия| Элементарные частицы. Протоны. Нейтроны. Электроны.Скачать