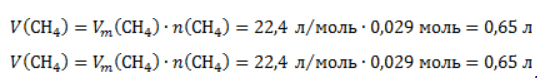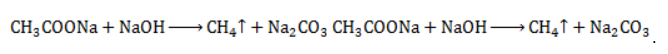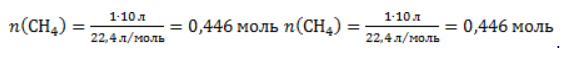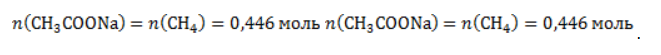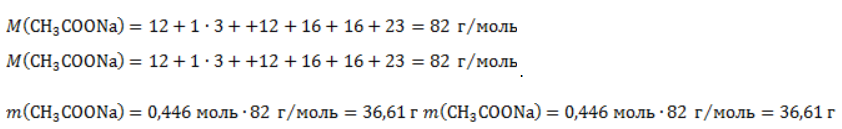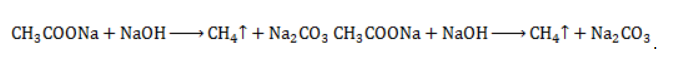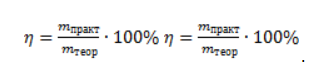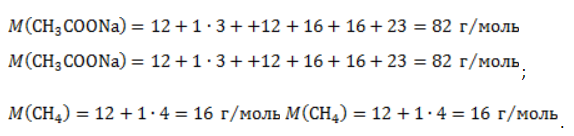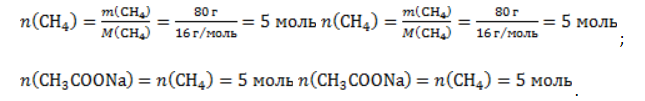Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Получение метана в лаборатории и промышленности
- Общая характеристика метана
- Физические свойства
- Получение метана
- Промышленные методы получения метана
- Очистка и переработка природного газа
- Переработка нефти и попутного газа
- Переработка каменного угля
- Лабораторный синтез метана
- Взаимодействие карбида алюминия с водой (метод Муассана)
- Взаимодействие ацетата натрия с щелочью (метод Дюма)
- Получение метана в домашних условиях
- Получение из органических отходов животноводства
- Получение из древесины
- Эффективность синтеза биометана
- Метан в органическом синтезе
- Получение ацетилена из метана
- Получение метанола из метана
- Получение анилина из метана
- Заключение
- Примеры решения задач
- Способы получения метана с уравнением
- Метан: способы получения и свойства
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Получение метана в лаборатории и промышленности
- Общая характеристика метана
- Физические свойства
- Получение метана
- Промышленные методы получения метана
- Очистка и переработка природного газа
- Переработка нефти и попутного газа
- Переработка каменного угля
- Лабораторный синтез метана
- Взаимодействие карбида алюминия с водой (метод Муассана)
- Взаимодействие ацетата натрия с щелочью (метод Дюма)
- Получение метана в домашних условиях
- Получение из органических отходов животноводства
- Получение из древесины
- Эффективность синтеза биометана
- Метан в органическом синтезе
- Получение ацетилена из метана
- Получение метанола из метана
- Получение анилина из метана
- Заключение
- Примеры решения задач
- Acetyl
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Получение метанаСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Получение и изучение свойств метана. Опыт 1Скачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Получение алканов. 10 класс.Скачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
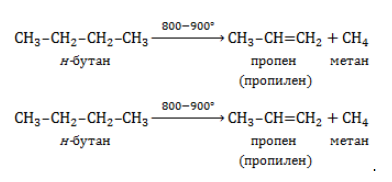
Продукт реакции – так называемый «синтез-газ». Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Получение метанаВидео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать  Получение метана в лаборатории и промышленностиПростейшее углеводородное соединение – метан – используется в промышленности, на транспорте, в быту, находя широкое применение и как сырье для органического синтеза, и в качестве конечного продукта. Потребность в метане испытывают многие отрасли хозяйства, и его производство постоянно расширяется. Видео:Проклятая химическая реакция 😜 #shortsСкачать  Общая характеристика метанаМетан представляет собой легкий бесцветный горючий газ без запаха. Распространен в природе как основной компонент природного газа и попутных нефтяных газов. Химическая формула – В атмосферу метан поступает в составе вулканических газов, а также является продуктом жизнедеятельности ряда микроорганизмов. В форме газогидратов в значительных количествах содержится на дне океанов и в многолетней мерзлоте. Является одним из важнейших парниковых газов. Как представитель ряда предельных углеводородов проявляет низкую химическую активность. Вследствие малой растворимости в воде и химической инертности метан считается малотоксичным веществом (класс опасности – IV), но при высокой концентрации в воздухе (4,4 — 17%) взрывоопасен, а дальнейшее повышение содержания метана приводит к удушью от недостатка кислорода. Физические свойстваОсновные физические характеристики метана при нормальном атмосферном давлении приведены в таблице. Видео:3.2. Алкины: Способы полученияСкачать  Получение метанаПромышленное производство и получение метана в лаборатории проводятся разными методами. Существуют также способы получения газа в домашних условиях, например, в частном хозяйстве для удовлетворения потребности в топливе. Промышленные методы получения метанаПоскольку газ в больших количествах поступает при добыче нефтегазового сырья, способы его производства нацелены не на искусственный синтез, а на выделение в процессах переработки нефти и газа. Кроме того, метан может быть получен при технологической обработке каменноугольного сырья. Очистка и переработка природного газаМетан – главный компонент такого важного вида горючих полезных ископаемых, как природный газ. Содержание метана в газе различных месторождений составляет 70-98%. После очистки от твердых частиц и примесей (сероводород, азот, углекислый газ, гелий) и осушки (отделения водяных паров) природный газ подвергается низкотемпературному фракционированию. Более тяжелые углеводородные компоненты газа – этан, пропан и бутан – переходят в жидкую фазу при более высоких температурах, чем метан, и последовательно отделяются от него в конденсационной колонне. Переработка нефти и попутного газаВ процессах термического разложения (пиролиза) высокомолекулярных алканов, входящих в состав нефти, в числе продуктов получают метан: Метан входит в состав газа, отделяемого от сырой нефти в процессе крекинга (разложения при высоком давлении и температурах около 450 — 550 ℃ либо с использованием катализатора). Кроме того, метан составляет значительную долю попутных газов, от которых его отделяют методом сепарации. Переработка каменного угля
Лабораторный синтез метанаВ лабораторной практике используются два основных способа получения метана:
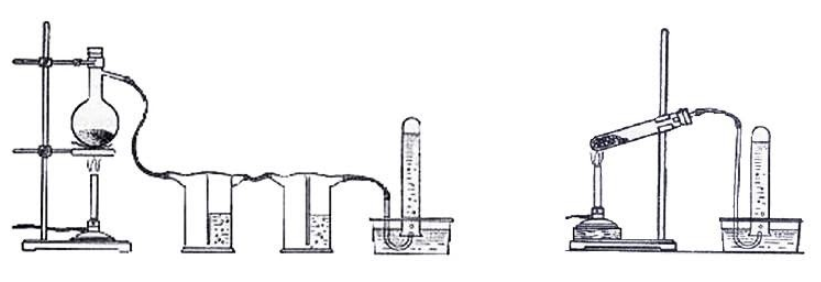
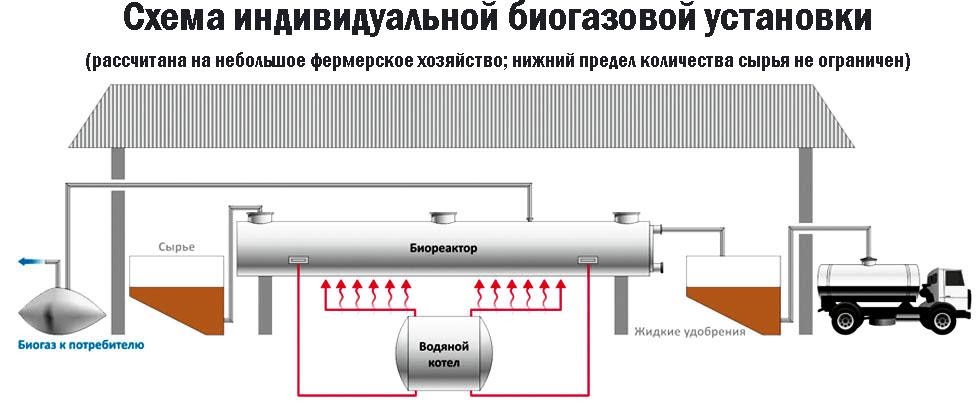
Взаимодействие карбида алюминия с водой (метод Муассана)Неорганическое бинарное соединение Реакция необратима и служит простым и удобным способом получения газа в лабораторных условиях. Взаимодействие ацетата натрия с щелочью (метод Дюма)Еще один простой лабораторный способ получения метана – прокаливание натриевой соли уксусной кислоты Подробное рассмотрение лабораторного процесса показывает, как с помощью щелочи получить метан из ацетата натрия. Присутствие воды препятствует этой реакции, поэтому уксуснокислый натрий должен быть обезвожен, а гигроскопичный гидроксид натрия – смешан с негашеной известью (оксидом кальция). Такая смесь носит название натронной извести. В реакционной смеси она должна присутствовать с избытком 1:3, чтобы обеспечить полное использование ацетата натрия. Порошки реагентов хорошо перемешиваются и помещаются в колбу с отводной трубкой или в пробирку. Выделяющийся газ собирают по методу вытеснения воды в пробирку. При нагревании колбы на пламени горелки используется асбестовая сетка. Пробирку нагревают на открытом пламени. Для улавливания примесей может использоваться промывная склянка с раствором щелочи. Для проверки результата опыта газ в пробирке поджигается. Варианты сборки прибора для получения метана в лаборатории изображены на рисунке. Получение метана в домашних условияхМетан можно получать и как продукт биологических процессов. Он выделяется в ходе обмена веществ особыми анаэробными микроорганизмами – бактериями-метаногенами. Они широко распространены в органических отходах животного и растительного происхождения. Поскольку метан может применяться в качестве горючего для водонагревательных установок, печей и кухонного оборудования, в частных хозяйствах, располагающих большим количеством отходов, становится выгодным самостоятельное получение из них метана и его использование. Получение из органических отходов животноводстваМетаногены обитают в кишечном тракте позвоночных и принимают участие в пищеварительном процессе. Поэтому в хозяйствах, занимающихся разведением крупного рогатого скота, свиней или домашней птицы, отходы жизнедеятельности животных могут быть переработаны с помощью биогазовых установок. Неразложимый остаток служит органическим удобрением. Технология получения биогенного метана состоит из нескольких этапов:
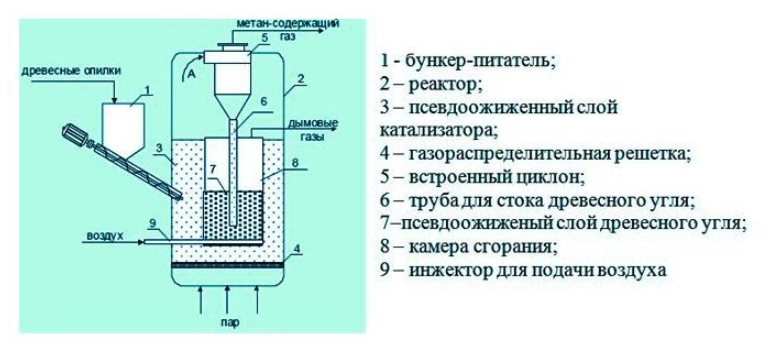
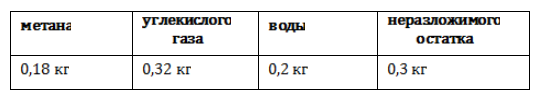
В некоторых установках предусмотрена система очистки биогаза от примесей – углекислого газа и сероводорода. Получение из древесиныВ качестве сырья для биогазовой технологии могут использоваться и растительные отходы, такие как древесная щепа. Пригодна для использования в биореакторе некондиционная древесина (например, пораженная вредителями или пострадавшая от пожаров), а также отходы лесозаготовок – ветки, кора и пр. Так как древесина содержит смолы, в установках по ее переработке нужно применять катализаторы для очистки газа. В качестве катализатора подходят шлаки металлургических производств, особенно эффективны мартеновские шлаки. Эффективность синтеза биометанаВ среднем переработка 1 кг биомассы, разложимой на 70%, дает: Эффективность выработки биогаза зависит от поддержания нужной температуры ферментации, поэтому в холодных регионах работа биогазовой установки потребует дополнительных затрат на подогрев и устройство надежной теплоизоляции. Большую роль играет биохимическое равновесие: выход газа снижается при возрастании кислотности. В этом случае требуется добавление нейтрализующего агента. Крупные фермерские хозяйства могут позволить себе привлечение специалистов, установку полностью автоматизированных биореакторов с большим выходом газа и получать дополнительный доход от его продажи. Для эффективной работы установки необходимо бесперебойное поступление сырья, поэтому хозяйствам с малым количеством животных невыгодно заниматься производством биометана. Если количество биомассы позволяет наладить синтез газа в небольшом хозяйстве, мини-установку для его производства можно сделать собственными силами. Следует помнить, что ее сооружение потребует серьезных вложений, составления технологической схемы, оформления документации, согласования с СЭС, пожарной и газовой инспекциями. Если хозяйство имеет возможность установить биогазовый реактор, оно получает существенные выгоды:
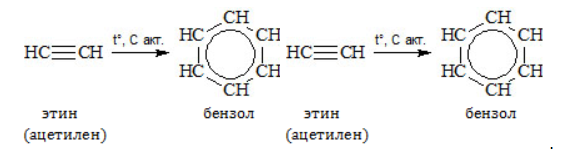
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  Метан в органическом синтезеМетан широко используется для получения многих востребованных соединений, таких как ацетилен, метанол или анилин. Получение ацетилена из метанаВ лабораторной практике проводится дегидрирование метана. Реакция требует сильного нагревания: В промышленности используются такие методы, как:
В этой реакции используется теплота частичного сгорания сырья, благодаря которой реакционная смесь разогревается до 1600 ℃ . Получение метанола из метанаМетиловый спирт может быть получен:
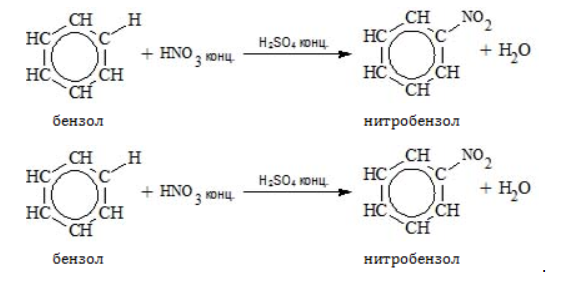
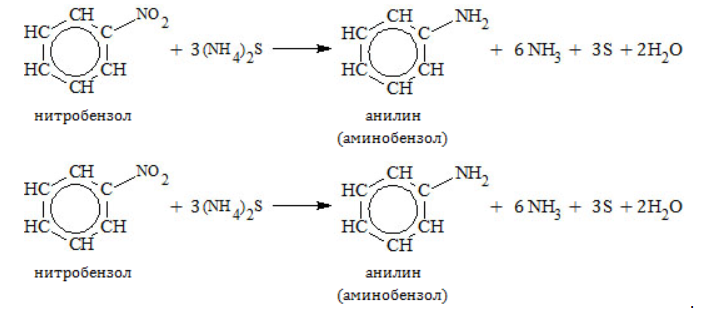
Получение анилина из метанаАроматическое соединение анилин получают в несколько стадий:
Видео:Получение алкановСкачать  ЗаключениеМетан востребован во многих областях. Росту объемов его производства для различных нужд способствует достаточно высокая распространенность в природе. Однако метан производится не только на крупных промышленных предприятиях. Простота его получения с использованием биологических отходов стимулирует производство индивидуальными хозяйствами, что идет на пользу экологической обстановке, снижая бесконтрольное гниение отходов и выброс ценного продукта в атмосферу. Видео:Химия 8 класс (Урок№13 - Водород: нахождение в природе, получение, его физ. и хим. свойства.)Скачать  Примеры решения задач1. Каков объем метана, выделяющегося при гидролизе карбида алюминия массой 12.5 г.? Запишем уравнение реакции: Найдем количество карбида алюминия, вступающего в реакцию, по формуле Из уравнения реакции видно, что Молярный объем газа Vm при нормальных условиях составляет 2. Какова масса ацетата натрия, необходимого для получения 10 л метана? Запишем уравнение реакции: Используя знание молярного объема газа, составим пропорцию: Вычислим количество получаемого метана: Из него следует, что количество ацетата натрия равно количеству метана: Рассчитаем массу ацетата натрия по формуле m=nM. 3. Сколько граммов ацетата натрия затрачено на получение 60 г метана при выходе продукта реакции 75%? Запишем уравнение реакции: Выход продукта равен отношению массы вещества, полученной на практике, к массе, рассчитанной по уравнению: Вычислим расчетную массу метана: Рассчитаем молярные массы ацетата натрия и метана: Уравнение показывает, что количества вещества ацетата натрия и метана равны. Вычислим их: Вычислим массу ацетата натрия: Видео:Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать  Способы получения метана с уравнениемМетан: способы получения и свойстваМетан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней. Гомологический ряд метанаВсе алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом. Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H. Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
Общая формула гомологического ряда алканов CnH2n+2. Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества. Строение метанаВ молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 : При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу: Это соответствует тетраэдрическому строению молекулы.
Изомерия метанаДля метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных. Химические свойства метанаМетан – предельный углеводород, поэтому он не может вступать в реакции присоединения. Для метана характерны реакции: Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов. Поэтому для метана характерны только радикальные реакции. Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой. 1. Реакции замещенияДля метана характерны реакции радикального замещение. 1.1. ГалогенированиеМетан реагирует с хлором и бромом на свету или при нагревании. При хлорировании метана сначала образуется хлорметан: Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Бромирование протекает более медленно. Реакции замещения в алканах протекают по свободнорадикальному механизму. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон. Первая стадия. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена разрывается на два радикала: Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Вторая стадия. Развитие цепи. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора: Третья стадия. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается. Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала: 1.2. Нитрование метанаМетан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
|
















 .
.

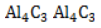 с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия:
с кристаллической структурой в реакции с водой разлагается с образованием метана и нерастворимого гидроксида алюминия: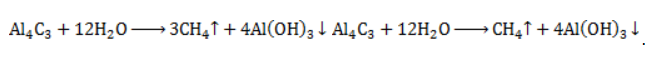
 с едким натром
с едким натром  :
: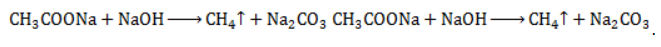
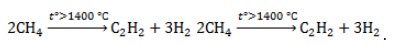


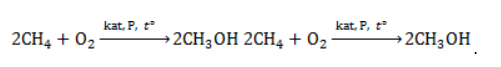
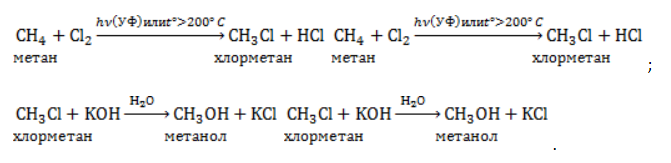
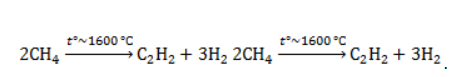

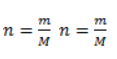 , где – n количество вещества, m– масса, M – молярная масса.
, где – n количество вещества, m– масса, M – молярная масса.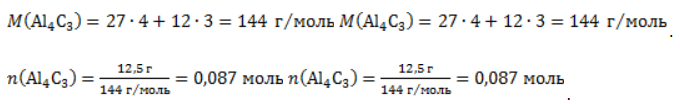
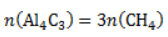 . Следовательно, количество метана равно:
. Следовательно, количество метана равно: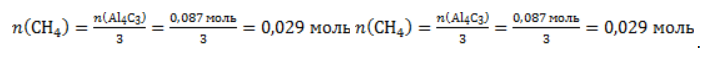
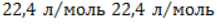 . Следовательно, объем метана будет равен:
. Следовательно, объем метана будет равен: