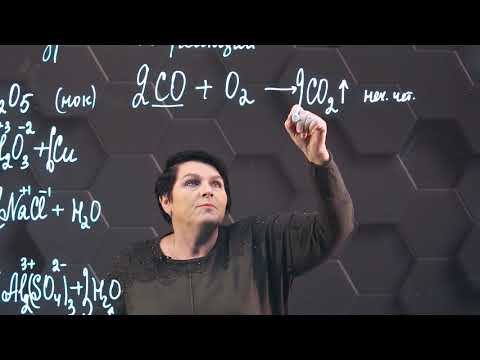Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Угарный газ в промышленности также можно получать неполным окислением метана:
Химические свойства
Оксид углерода (II) – несолеобразующий оксид . За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода . Пламя окрашено в синий цвет:
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
3. Угарный газ взаимодействует с водородом при повышенном давлении . Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например , под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например , угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов .
Например , оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например , пероксидом натрия:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение уравнения реакций co и co2
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C +2 O + O2 t ˚ C → 2C +4 O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы — 
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Способы собирания: вытеснением воздуха
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
1) С водой даёт непрочную угольную кислоту:
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 + Me = MexOy + C
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
III. Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
В природе встречаются:
CaCO3
Мел Мрамор Известняк
NaHCO3 – питьевая сода
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Специфические свойства:
1) Качественная реакция на CO 3 2- карбонат – ион «вскипание» при действии сильной кислоты:
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 + C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Please wait.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Горение угарного газа 2CO + O2 = CO2 #егэ #химия #турбоегэСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e21743daa940c29 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
🔍 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Кобальт - Co. Реакция Магния и Сульфата Кобальта(2). Реакция Mg и CoSO4.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Решение цепочек превращений по химииСкачать

8 класс. Составление уравнений химических реакций.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция на углекислый газСкачать

Уравнивание реакций горения углеводородовСкачать

ПОЛУЧЕНИЕ ЦИНКАТА КОБАЛЬТА - CoZnO2. Реакция Оксида Кобальта и Оксида Цинка.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Оксид Диалюминия - Кобальта(2) - CoAl2O4. Тенарова Синь. Реакция Co(NO3)2 и Al(NO3)3.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать