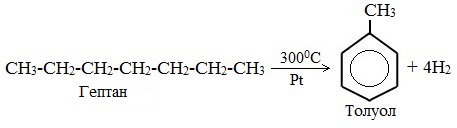Толуол (толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол был впервые получен Пельтье в 1835 при перегонке сосновой смолы.
В 1838 выделен А.Девилем из толуанского бальзама — желтовато-коричневой, приятно пахнущей смолы южно-американского дерева, привезенного из города Толу в Колумбии, в честь которого получил своё название.
- Физические свойства толуола
- Получение
- Применение толуола
- Ароматические УВ. Бензол
- Арены ряда бензола (моноциклические арены)
- Электронное строение молекулы бензола
- Физические свойства бензола
- Химические свойства бензола
- I. Реакции замещения
- II. Реакции присоединения
- III. Реакции окисления
- Получение бензола
- Изомерия и номенклатура гомологов бензола
- Физические свойства толуола
- Химические свойства толуола
- I. Реакции замещения
- II. Реакции присоединения
- III.Реакции окисления
- Получение толуола:
- Похожее
- Добавить комментарий Отменить ответ
- Толуол
- Содержание
- Общая характеристика
- Химические свойства
- Получение и очистка
- Применение
- Опасность и обращение
- Толуоловая токсикомания
- 🔥 Видео
Физические свойства толуола
Толуол – бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие, не растворимая в воде, хорошо растворяется в органических растворителях, растворяет полимеры. Температура кипения = 110,6 0 С.
Обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей. Горюч, сгорает с выделением копоти. Толуол менее токсичен, чем бензол.
Пары толуола легко образуют взрывоопасные смеси, воспламеняющиеся даже от искры статического электричества.
Получение
В промышленности
1. Переработка нефти и угля
В настоящее время, толуол получают из нефтяных фракций и каменноугольной смолы.
Каменноугольный толуол, образующийся в процессе коксования, извлекают из коксового газа в виде компонента сырого бензола, подвергают сернокислотной очистке (для удаления непредельных и серусодержащих соединений) и выделяют ректификацией.
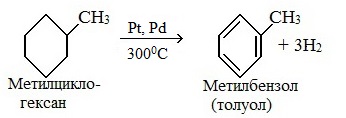
2. Дегидрирование метилциклогексана
3. Дегидроциклизация гептана
В лаборатории
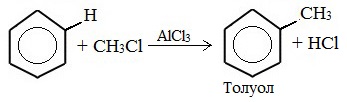
1. Алкилирование по Фриделю-Крафтсу
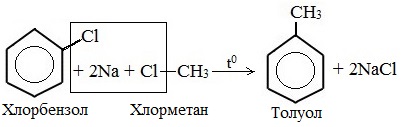
2. Реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана)
Применение толуола
Толуол – это ценное сырье для органического синтеза, для производства компонентов моторных топлив с высоким октановым числом, для получения взрывчатых веществ (тринитротолуола), фармацевтических препаратов, красителей и растворителей. Как основной компонент входит в состав растворителей.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Ароматические УВ. Бензол
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:
Арены ряда бензола (моноциклические арены)
Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Электронное строение молекулы бензола
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С—С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120 о . Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:
Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; t o пл= 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I. Реакции замещения
1.Галогенирование
2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование
4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса, образуются гомологи бензола:
Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):
II. Реакции присоединения
1.Гидрирование
2.Присоединение хлора
III. Реакции окисления
2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
1) переработка нефти и угля;
2) дегидрирование циклогексана:
3) дегидроциклизация (ароматизация) гексана:
В лаборатории:
Сплавление солей бензойной кислоты со щелочами:
Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.
Физические свойства толуола
Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I. Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:
а) галогенирование
При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:
б) нитрование
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:
II. Реакции присоединения
Гидрирование
III.Реакции окисления
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:
Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:
3) дегидроциклизация гептана:
В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Толуол
Толуол (от исп. Tolu , толуанский бальзам) — метилбензол, PhMe — бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П. Пеллетье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил своё название.
Видео:Уравнивание реакций горения углеводородовСкачать

Содержание
- 1 Общая характеристика
- 2 Химические свойства
- 3 Получение и очистка
- 4 Применение
- 5 Опасность и обращение
- 6 Толуоловая токсикомания
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты следует учитывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (практически — менее 30 °C).
Толуол также образует с водой азеотропную смесь.
Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида железа в качестве катализатора:
C6H6 + CH3Br → FeBr3 C6H5CH3 + HBr
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Видео:Получение БЕНЗОЛАСкачать

Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»).
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Толуоловая токсикомания
Толуол и содержащие его смеси, например, Р-646 являются галлюциногенными веществами. Для борьбы против токсикомании фирма Хенкель исключила толуол из клея «Момент», заменив его ацетоном.
🔥 Видео
Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение ТолуолаСкачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Нитрование бензолаСкачать

Получение алканов. Реакция Дюма (механизм + сложные случаи). ЕГЭ по химии.Скачать

Обесцвечивание ПЕРМАНГАНАТА КАЛИЯ ТОЛУОЛОМ. Реакция ТОЛУОЛА, ПЕРМАНГАНАТА КАЛИЯ и СЕРНОЙ КИСЛОТЫ.Скачать

Химия, 11-й класс, Химические свойства бензола. Толуол как гомолог бензолаСкачать

Арены (бензол, толуол): цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать