| Сульфат серебра | |
|---|---|
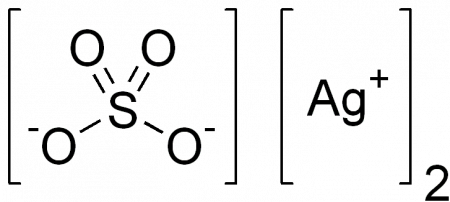 | |
| Систематическое название | Сульфат серебра I |
| Химическая формула | Ag2SO4 |
| Внешний вид | белые кристаллы |
| Молярная масса | 311,8 г/моль |
| Температура плавления | 660 °C (933,15 К) |
| Температура разложения | 750—1100 °C |
| Фазовые переходы | 427 °C (ромб. → гекс.) |
| Плотность | 5,45 г/см³ |
| Растворимость в воде | 0,79 г/100 мл |
| LD 50 | 5000 мг/кг |
| Кристаллическая решётка | Орторомбическая |
| Стандартная энтальпия образования | −715 кДж/моль |
| Энтальпия плавления | +16,74 кДж/моль |
| Стандартная молярная энтропия | +200 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −618 кДж/моль |
| Регистрационный номер CAS | 10294-26-5 |
| Регистрационный номер EC | 233-653-7 |
| R-фразы | R41 |
| S-фразы | S22 ; S26 ; S39 |
| H-фразы | H318 |
| P-фразы | P260; P280; P305 + P351 + P338; P313 |
| Пиктограммы опасности |  |
| Пиктограммы опасности СГС |  |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Сульфат серебра (сульфат серебра I) — неорганическое вещество с формулой Ag2SO4, соль серебра в степени окисления +1 и серной кислоты.
Бесцветные кристаллы со временем темнеющие от воздействия света. Плохо растворим в воде.
Применяется в качестве стандартного вещества для тепловой калибровки калориметров и иногда для бактерицидной обработки воды.
- Содержание
- Физические свойства
- Химические свойства
- Окислительно-восстановительные реакции
- Обменные реакции
- Получение
- Применение
- Калориметрия
- Физиологическое действие
- Acetyl
- Химические свойства серебра
- Соединения серебра
- Оксид серебра Ag2О
- Галогениды серебра
- Иодид AgI
- Нитрат серебра
- Сульфат серебра Ag2SO4
- Похожие страницы:
- Leave a Comment
- 🌟 Видео
Видео:Как сделать сульфат серебра.Скачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 2.1 Окислительно-восстановительные реакции
- 2.2 Обменные реакции
- 3 Получение
- 4 Применение
- 4.1 Калориметрия
- 5 Физиологическое действие
Видео:Реакции ионов серебра с 15ю анионами и растворимость осадков/ Reactions of 15 anions with silver(+)Скачать

Физические свойства
При нормальных условиях сульфат серебра — белое кристаллическое вещество, малорастворимое в воде (0,79 г/100 г H2O при 20 °C; 1,30 г/100 г H2O при 80 °C), нерастворимое в этаноле. При осаждении из водных растворов не образует кристаллогидратов.
Существует в двух кристаллических модификациях: с ромбической и гексагональной сингонией кристаллической решётки. Температура фазового перехода из ромбической формы в гексагональную — 427 °C.
При 660 °C плавится без разложения.
Видео:ХимБонус - выпуск 40 - Сульфат серебра (I) Ag₂SO₄Скачать

Химические свойства
Окислительно-восстановительные реакции
При температуре 750−1100 °C сульфат серебра разлагается с выделением металлического серебра:
Также металлическое серебро восстанавливается из сульфата при нагревании последнего в токе водорода выше 200 °C:
или при нагревании с сульфидом серебра выше 300 °C:
Обменные реакции
Сульфат серебра растворяется в концентрированном водном растворе аммиака с образованием комплекса:
При небольшом (до 50 °C) нагревании сульфат серебра растворяется в концентрированной серной кислоте с образованием гидросульфата серебра:
При взаимодействии с концентрированной соляной кислотой выпадает осадок хлорида серебра:
При взаимодействии с концентрированной щёлочью выпадает осадок оксида серебра (I):
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
Сульфат серебра может быть получен нагреванием металлического серебра с диоксидом серы и кислородом выше 450 °C:
Взаимодействием металлического серебра с горячей концентрированной серной кислотой:
Осаждением из растворов в реакциях ионного обмена, например:
Вытеснением концентрированной серной кислотой летучих соединений водорода из солей:
2 AgX + H2SO4 ⟶ Ag2SO4 ↓ + 2 HX ↑ , где X = F, Br, I, CN.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Применение
Применяется для бактерицидной обработки воды.
Калориметрия
Сульфат серебра используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Видео:Получение серебра - реакция серебряного зеркала! (химия)Скачать

Физиологическое действие
Сульфат серебра оказывает сильное раздражающее действие на глаза. При длительном контакте с кожей может вызывать аргирию.
Видео:ПОЛУЧЕНИЕ СЕРЕБРА. Выпадение Серебра С Помощью Окислительно-Восстановительной РеакцииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Химические свойства серебраВ твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла. С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов. При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами. При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных условиях и является причиной постепенного потемнения серебянных изделий. Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают, даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света. Электродный потенциал серебра в водных растворах высок : Ag → Ag⁺ + е, φ0 = + 0,799В Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной. Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl. Такие различия в поведении золота и серебра часто используют для разделения этих металлов. Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомочевины в присутствии солей железа (III). Видео:Получение СУЛЬФИДА СЕРЕБРА Ag2S. Реакция НИТРАТА СЕРЕБРА и СУЛЬФИДА НАТРИЯ. Опыты по химииСкачать  Соединения серебраВ подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют. Видео:Получение нитрата серебра (химия)Скачать  Оксид серебра Ag2ОЧерно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag⁺. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид: 2AgOH = Ag2O + Н2О. Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гидролизуются и дают нейтральную реакцию. При нагревании до 185—190°С Ag2О разлагается на элементы. Перекись водорода легко восстанавливается Ag2О уже при комнатной температуре: В водном растворе аммиака Ag2О растворяется с образованием комплексного соединения: При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро). Видео:8 класс. Составление уравнений химических реакций.Скачать  Галогениды серебраМалорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и иодид AgI выпадают в осадок при введении в раствор, содержащий ионы Ag⁺ (например, раствор AgNO3), ионов Сl⁻, Вr⁻ и I⁻. Их произведения растворимости составляют соответственно 1,8 • 10⁻¹º (AgCI), 5,3 • 10⁻¹³ (AgBr) и 8,3 •10⁻¹⁷ (AgI). В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НСl. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000 °с. Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN⁻, S2O²3⁻, SO²3⁻ Cl⁻, NH3, CS(NH2)2 и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например: AgCl + 2CN⁻ = Ag (CN)F + Сl⁻; AgCl + 2S2C²3⁻ = Ag (S2O2)³2⁻ + Сl⁻; AgCl + 2NH4OH = Ag(NH3)2+ + Сl⁻ + 2H2O. Вследствие образования комплексов с ионами Сl³⁻ хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов: AgCl + Сl⁻ = AgCl⁻ 2. Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7•10³⁻моль/л (0,72 г/л Ag) против 1,3•10⁻⁵ в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига. Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в ре-зультате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора. Электроотрицательными металлами (цинком, железом) .хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве. Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Иодид AgIНаименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN⁻ и S2O²3⁻ , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью AgI обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов AgI⁻2. Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувст-вительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид: Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — светочувствительных пленок, пластинок и бумаги. Светочувствительность галидов серебра возрастает в ряду AgI К галогенидам серебра очень близок по своим свойствам цианид AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag⁺, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3•10⁻¹⁶) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается. Видео:Особенности растворения Серебра в самодельной азотной кислоте, в электролите с аммиачной селитрой!Скачать  Нитрат серебраИз других соединений серебра большое практическое значение имеют нитрат и сульфат серебра. Нитрат серебра AgNО3 получают действием азотной кислоты на металлическое серебро: 3Ag + 4HNO3 = 3AgNО3 + NO + 2H2О. Нитрат серебpa представляет собой бесцветные негигроскопичные кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается. AgNО3 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100 °С она возрастает до 952 г на 100 г. Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNO3 используют в качестве электролита при электролитическом рафинировании серебра. Видео:Реакция аммиака с сульфатом меди. Химический опытСкачать  Сульфат серебра Ag2SO4Может быть получен растворением металлического серебра в горячей концентрированной серной кислоте: 2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2Н2O. Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660°С. При температуре выше 1000°С термически разлагается. Растворимость Ag2SO4 в воде невелика, при 25°С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHSO4. Сульфид серебра Ag2S — наиболее трудно растворимая соль этого металла (произведение растворимости 6.3• 10⁻⁵º). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии H2S на металлическое серебро в присутствии влаги и кислорода воздуха; 4Ag + 2H2S + O2 = 2Ag2S + 2Н2O Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой. В цианистых растворах Ag2S растворяется в результате образования комплексного соединения: Ag2S + 4CN⁻ ⇄ 2Ag(CN)⁻2 + S²⁻ Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN⁻ и удаление ионов S²⁻ окислением их кислородом продуваемого воздуха. С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы: Ag2S + О2 = 2Ag + SО2 Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха: 4Ag + 8CN⁻ + О2 + 2Н2О = 4Ag(CN)7 + 4ОН⁻ Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования. Статья на тему химические свойства серебра Похожие страницы:Понравилась статья поделись ей Leave a CommentДля отправки комментария вам необходимо авторизоваться. 🌟 ВидеоЧто, если колоть СТЕРОИДЫ?Скачать  Монооксид Серебра - Ag2O2. Реакция Оксида Серебра, Перманганата Калия и Гидроксида Натрия.Скачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Электролиз. 10 класс.Скачать  Химические свойства солей серебра #1 получение Ag2OСкачать  45 гр. Серебра со штекеров. Вилки 6Р-100, 6Р-150В. Меланж, хлорид через сульфат серебра.Скачать  |




