Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Видео:Карбонат натрия из пищевой содыСкачать

Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы . При этом образуются карбонат натрия и углекислый газ:
Видео:Галилео. Эксперимент. Эндотермическая реакцияСкачать

Производство кальцинированной соды.
ТЕХНОЛОГИЯ КАЛЬЦИНИРОВАННОЙ СОДЫ.
ОБЩИЕ СВЕДЕНИЯ.
К важнейшим видам продукции основной химической промышленности наряду с минеральными кислотами и удобрениями относятся содовые продукты — кальцинированная сода, каустическая сода и бикарбонат натрия.
Кальцинированная сода широко применяется во многих отраслях промышленности, а также для бытовых нужд. До 25% кальцинированной соды применяется в химической промышленности для получения бикарбоната натрия, каустической соды и других солей натрия, стекла, в анилинокрасочном и лакокрасочном производствах. Основными потребителями кальцинированной соды являются цветная и черная металлургия, нефтяная, пищевая, целлюлознобумажная, текстильная и другие отрасли промышленности.
Кальцинированная сода — Ка2С03 — представляет собой белый кристаллический порошок с температурой плавления 852 °С, плотностью 2533 кг/м 3 . Насыпная плотность кальцинированной соды составляет от 500 до 700 кг/м 3 . Выпускается также специальный сорт соды — так называемая «тяжелая» сода. Насыпная плотность «тяжелой» соды — от 800 до 1000 кг/м 3 . Кальцинированная сода — гигроскопичная соль. Она хорошо растворяется в воде с выделением тепла. При нагревании раствора выше 32,5 °С растворимость соды снижается.
Качество кальцинированной технической соды из нефелинового сырья определяется требованием ГОСТ 10680—70.
Методы получения соды. Кальцинированную соду получают тремя способами: аммиачным, из природной соды и комплексной переработкой нефелинов. В нашей стране аммиачный способ является основным. Процесс переработки нефелинов с получением глинозема, содовых продуктов (соды и поташа) и цемента на основе апатито-нефелинового месторождения Кольского полуострова, а также нефелиновых руд Сибири постепенно приобретает большое значение. В отдельных зарубежных странах кальцинированную соду получают из природной соды.
В общем объеме производства доля синтетической соды, получаемой аммиачным способом, составляет 84%. а из нефелина—16%. Мощности по выпуску аммиачной соды используются на 95—100%, а нефелиновой соды — на 85—95%.
ПРОИЗВОДСТВО СОДЫ АММИАЧНЫМ СПОСОБОМ
Сырье.
Основным сырьем для производства кальцинированной соды являются мел или известняк и раствор поваренной соли. Кроме того, применяют еще ряд вспомогательных материалов — аммиак, воду, пар и электроэнергию.
Карбонатное сырье. Для получения оксида углерода (IV) и извести на содовых заводах применяют известняк или мел, называемые, карбонатным сырьем. От качества карбонатного сырья в значительной мере зависит нормальная работа содового завода. Применение известняка более желательно, чем применение мела. При увеличении влажности мела возрастает расход топлива на его обжиг и, следовательно, расход воздуха на сжигание топлива. С увеличением расхода воздуха снижается концентрация СО2 в печном газе. Кроме того, прочность мела ниже, чем известняка. Содержание СаС03 в известняке в соответствии с ОСТ 21-27—76 в пересчете на сухой продукт должно быть не менее 92%. Расход карбонатного сырья (100% СаСО3) на 1 т соды составляет 1,1—1,25 т. Содовые заводы обычно находятся вблизи месторождений карбонатного сырья.
Поваренная соль широко распространена в природе как в твердом виде, так и в виде растворов. В производстве соды аммиачным способом применяют не твердую соль, а рассол, стоимость добычи которого путем выщелачивания соли во много раз ниже стоимости добычи твердой соли. На содовых заводах к рассолу предъявляются следующие требования: он должен быть насыщенным или близким к насыщению. Максимальная концентрация ЫаС1 в воде при 15 °С равна 317 г/л.
В содовой промышленности концентрацию растворов принято выражать в так называемых нормальных делениях (н.д.). Одно нормальное деление соответствует содержанию 1/20 экв. вещества в 1 л раствора. На практике применяют рассол, содержащий 305—310 г/л NаСl, что соответствует 104,3— 106,0 н. д. Увеличение концентрации NаСl благоприятно влияет на степень его использования, что ведет к уменьшению удельного расхода рассола, к снижению расхода аммиака, известняка, пара, воды, электроэнергии на 1 т соды.
На производство 1 т кальцинированной соды расходуется около 1,5 т поваренной соли.
Аммиак в производстве соды находится в замкнутом цикле: после регенерации в отделении дистилляции он возвращается обратно в производство. Для восполнения неизбежных потерь в цикл вводят аммиачную воду, содержащую до 25% г NH3. Аммиачная вода, поступающая с коксохимических заводов, содержит сульфид аммония, предохраняющий стальную аппаратуру и трубопроводы от коррозии. При использовании синтетической аммиачной воды в технологический процесс производства соды вместе с аммиачной водой вводят Nа2S.
Общая схема производства.
Сложный процесс производства соды можно разделить на несколько стадий (так называемые станции или отделения):
1) предварительная очистка рассола от солей кальция и магния;
2) абсорбция — насыщение рассола аммиаком и частично оксидом углерода (IV) с получением аммонизированного рассола;
3) карбонизация — насыщение аммонизированного рассола оксидом углерода (IV) с образованием бикарбоната натрия в виде суспензии;
4) фильтрование — отделение суспензии бикарбоната натрия от фильтровой жидкости;
5) дистилляция — регенерация аммиака и оксида углерода (IV) из фильтровой жидкости;
6) кальцинирование (кальцинация) — разложение бикарбоната натрия на карбонат натрия (кальцинированную соду), воду и оксид углерода (IV).
Кроме основных процессов, при производстве соды протекает ряд побочных процессов, не имеющих непосредственного отношения к получению соды. Аммиак регенерируют из хлорида аммония путем обработки раствора известковым молоком:
В отделении дистилляции образующийся аммиак отгоняют из раствора водяным паром и направляют в отделение абсорбции. Раствор хлорида кальция является отходом производства.
Для получения известкового молока необходима известь СаО, которую на содовых заводах получают путем обжига карбонатного сырья (мела или известняка) в известково-обжигательных печах при температуре 1100—1200 °С.Образующийся при обжиге оксид углерода (IV) используют в процессе карбонизации, а известь СаО гасят избытком воды с получением известкового молока:
Таким образом, получение соды аммиачным способом можно изобразить в виде схемы, показывающей взаимную связь между отдельными стадиями процесса:
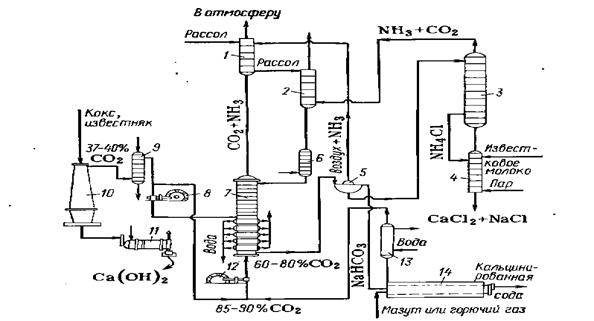
На рис. 1 показана общая технологическая схема производства кальцинированной соды по аммиачному способу.
Водный раствор поваренной соли, содержащий 305—310 г/л, предварительно очищенный от солей кальция и магния, самотеком поступает в промыватель 1,где поглощает оксид углерода (IV) из газов, выходящих из карбонизационной колонны 7, и аммиак из газов, поступающих с вакуум-фильтров 5.После поглощения С02 и NH3 отходящие газы удаляются в атмосферу.
Из промывателя газов 1рассол поступает в абсорбер 2для поглощения аммиака и оксида углерода (IV), содержащихся в газах дистилляционной колонны 3.Непоглощенные газы из абсорбера 2направляют вакуум-насосом в промыватель 1. Аммонизированный рассол, предварительно охлажденный в холодильнике 6,непрерывно поступает в карбонизационную колонну 7, заполняя ее почти доверху. Сюда же поступает газ, предварительно промытый и очищенный, из известково-обжигательных печей 10(37—40% С02) и смешанный газ (смесь газа известково-обжигательных печей и газа содовых печей). В смешанном газе содержится 60—80% С02 — при двух вводах газа в карбонизационную колонну — и около 50% С02 —при одном вводе. Газы подают в колонну7 с помощью компрессоров 8 и 12.
Рис. 1. Технологическая схема получения кальцинированной соды аммиачным способом:
1-промыватель газов; 2-абсорбер; 3-дистнлляциоиная ;4-смеситель; 5 — вакуум-фильтр; 6 — холодильник аммонизированного рассола 7 — карбонизационная колонна; 8, 12 — компрессоры; 9 — холодильник-газоочистатель; 10 -известково-обжигательная печь; 11- аппарат для гашения извести; 13 — холодильник-промыватель, 14 — содовая печь.
В карбонизационной колонне 7 протекает основная реакция образования бикарбоната натрия. Суспензию кристаллического бикарбоната натрия в растворе хлорида аммония и непрореагировавшего хлорида натрия направляют в вакуум-фильтр 5для выделения бикарбоната натрия. Маточную жидкость, содержащую углеаммонийные соли и хлорид аммония (фильтрат) подают из вакуум-фильтров в дистилляционную колонну 3,где осуществляется регенерация аммиака из раствора, содержащего хлорид и карбонат аммония. При нагревании раствора до 70— 80 °С карбонат аммония разлагается; разложение хлорида аммония проводят в дистиллере-смесителе 4,куда он поступает из колонны 3. Сюда же подают известковое молоко, полученное гашением извести в аппарате 11. Регенерированные аммиак и оксид углерода (IV) отгоняют из раствора паром, подаваемым в нижнюю часть аппарата 4,и они поступают в абсорбер 2на поглощение рассолом.
После отгонки аммиака полученный раствор содержит в основном хлорид кальция и не вступивший в реакцию хлорид натрия. Этот раствор, называемый дистиллерной жидкостью, является отходом производства.
Осадок NаНСО3 промывают на вакуум-фильтре 5и подают во вращающуюся содовую печь 14на кальцинирование, в результате чего образуется сода, пары воды и оксид углерода (IV). Кальцинированная сода из печи 14поступает на склад и далее на упаковку.
Видео:Задачи на примеси. 1 часть. 9 класс.Скачать

Карбонат натрия
| Карбонат натрия | |||
|---|---|---|---|
| |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий | ||
| Хим. формула | Na 2 CO 3 | ||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Константа диссоциации кислоты pKa | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| ГОСТ | ГОСТ 5100-85 | ||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| Кодекс Алиментариус | E500(i) | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
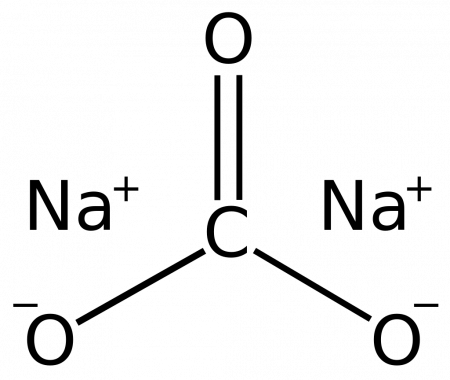
Карбонат натрия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na 2 CO 3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Содержание
- 1 Свойства
- 2 Нахождение в природе
- 3 Получение
- 3.1 Способ Леблана
- 3.2 Промышленный аммиачный способ (способ Сольве)
- 3.3 Способ Хоу
- 3.3.1 Сравнение способов
- 4 Применение
- 5 Безопасность
- 6 Тривиальные названия
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Свойства
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Первая константа диссоциации угольной кислоты равна 4,5⋅10 −7 . Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Видео:ТЕХНОЛОГИИ ПРОИЗВОДСТВА СОДЫСкачать

Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Сульфид натрия реагирует с карбонатом кальция:
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.
Видео:Солошенко К.В. Производство кальцинированной соды.Скачать

Безопасность
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м 3 . Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
💥 Видео
ПОЧЕМУ НЕЛЬЗЯ ЕСТЬ ПИЩЕВУЮ СОДУ?Скачать

25. Схема реакции и химическое уравнениеСкачать

Сода как лекарство? Сода пищевая, кальцинированная, каустическая.Скачать

Получение гидроксида натрия из мела и соды.Скачать

ПВР СОДАСкачать

СОДА И УКСУС?Скачать

Молярная масса. 8 класс.Скачать

✔ УК❌❌ИНКА : МЫ, ГИБ❌ЕМ ПАЧКАМИ ,ЗА ПРОЦВЕТАНИЕ АМ❌РИКИ!Скачать