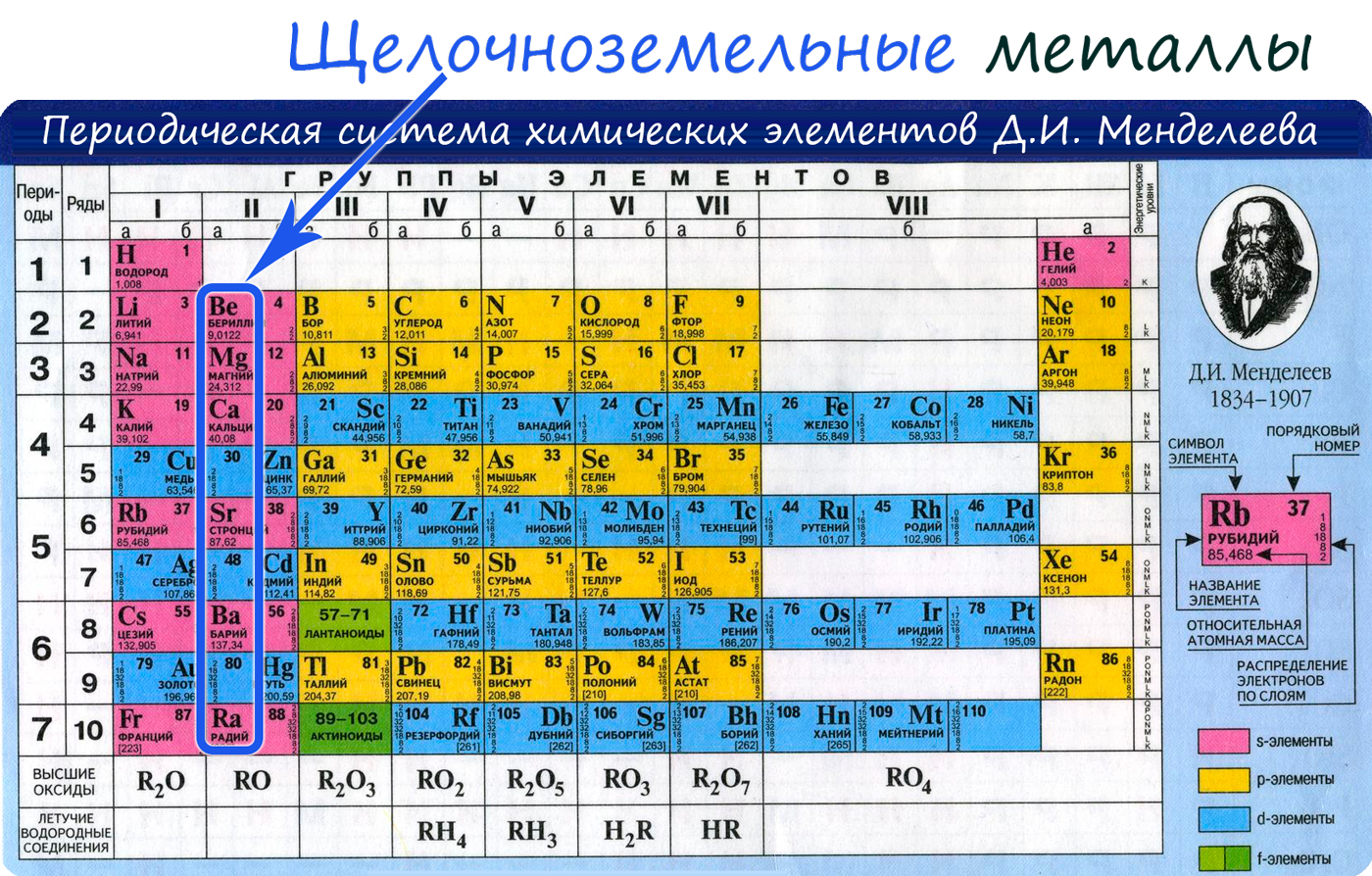
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
- Щелочноземельные металлы и их соединения
- Элементы II группы главной подгруппы
- Положение в периодической системе химических элементов
- Электронное строение и закономерности изменения свойств
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Оксиды щелочноземельных металлов
- Способы получения
- Химические свойства
- Гидроксиды щелочноземельных металлов
- Способы получения
- Химические свойства
- Соли щелочноземельных металлов
- Нитраты щелочноземельных металлов
- Карбонаты щелочноземельных металлов
- Жесткость воды
- Постоянная и временная жесткость
- Способы устранения жесткости
- II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- Общая характеристка щелочноземельных металлов
- Нахождение в природе щелочноземельных металлов
- Способы получения щелочноземельных металлов
- Химические свойства щелочноземельных металлов
- Взаимодействие с простыми веществами — неметаллами
- Взаимодействие со сложными веществами
- 🔍 Видео
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 :
- Be — 2s 2
- Mg — 3s 2
- Ca — 4s 2
- Sr — 5s 2
- Ba — 6s 2
- Ra — 7s 2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит
Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
Химические свойства
- Реакции с водой
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Реакции с неметаллами
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)
Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
Реакция с водой
В нее вступают все, кроме оксида бериллия.
Амфотерный оксид бериллия
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Щелочноземельные металлы
Видео:Щелочноземельные металлы - Все свойства!Скачать

Щелочноземельные металлы и их соединения
Элементы II группы главной подгруппы
Элементы II группы главной подгруппы
Положение в периодической системе химических элементов
Щелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Электронное строение и закономерности изменения свойств
Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов: ns 2 , на внешнем энергетическом уровне в основном состоянии находится 2 s-электрона. Следовательно, типичная степень окисления щелочноземельных металлов в соединениях +2.
Рассмотрим некоторые закономерности изменения свойств щелочноземельных металлов.
В ряду Be—Mg—Ca—Sr—Ba—Ra, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрицательность .
Физические свойства
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Кристаллическая решетка щелочноземельных металлов в твёрдом состоянии — металлическая. Следовательно, они обладают высокой тепло- и электропроводимостью. Кипят и плавятся при высоких температурах.
Нахождение в природе
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочноземельные металлы:
Доломит — CaCO3 · MgCO3 — карбонат кальция-магния.
Магнезит MgCO3 – карбонат магния.
Кальцит CaCO3 – карбонат кальция.
Гипс CaSO4 · 2H2O – дигидрат сульфата кальция.
Барит BaSO4 — сульфат бария.
Витерит BaCO3 – карбонат бария.
Способы получения
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
или восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают восстановлением оксида бария алюминием в вакууме при 1200 °C:
4BaO + 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
Качественная реакция на щелочноземельные металлы — окрашивание пламени солями щелочноземельных металлов .
Цвет пламени:
Ca — кирпично-красный
Sr — карминово-красный (алый)
Ba — яблочно-зеленый
Качественная реакция на ионы магния : взаим одействие с щелочами. Ионы магния осаждаются щелочами с образованием белого осадка гидроксида магния:
Mg 2+ + 2OH — → Mg(OH)2↓
Качественная реакция на ионы кальция, стронция, бария : взаим одействие с карбонатами. При взаимодействии солей кальция, стронция и бария с карбонатами выпадает белый осадок карбоната кальция, стронция или бария :
Ca 2+ + CO3 2- → CaCO3↓
Ba 2+ + CO3 2- → BaCO3↓
Качественная реакция на ионы стронция и бария : взаим одействие с сульфатами. При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция :
Ba 2+ + SO4 2- → BaSO4↓
Sr 2+ + SO4 2- → SrSO4↓
Также осадки белого цвета образуются при взаимодействии солей кальция, стронция и бария с сульфитами и фосфатами.
Например , при взаимодействии хлорида кальция с фосфатом натрия образуется белый осадок фосфата кальция:
Химические свойства
1. Щелочноземельные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочноземельные металлы реагируют с галогенами с образованием галогенидов при нагревании.
Например , бериллий взаимодействует с хлором с образованием хлорида бериллия:
1.2. Щелочноземельные металлы реагируют при нагревании с серой и фосфором с образованием сульфидов и фосфидов.
Например , кальций взаимодействует с серой при нагревании:
Ca + S → CaS
Кальций взаимодействует с фосфором с образованием фосфидов:
1.3. Щелочноземельные металлы реагируют с водородом при нагревании. При этом образуются бинарные соединения — гидриды. Бериллий с водородом не взаимодействует , магний реагирует лишь при повышенном давлении.
1.4. С азотом магний взаимодействует при комнатной температуре с образованием нитрида:
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
1.5. Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов.
Например , кальций взаимодействует с углеродом с образованием карбида кальция:
Ca + 2C → CaC2
Бериллий реагирует с углеродом при нагревании с образованием карбида — метанида:
2Be + C → Be2C
1.6. Бериллий сгорает на воздухе при температуре около 900°С:
2Be + O2 → 2BeO
Магний горит на воздухе при 650°С с выделением большого количества света. При этом образуются оксиды и нитриды:
2Mg + O2 → 2MgO
Щелочноземельные металлы горят на воздухе при температуре около 500°С, в результате также образуются оксиды и нитриды.
Видеоопыт : горение кальция на воздухе можно посмотреть здесь.
2. Щелочноземельные металлы взаимодействуют со сложными веществами:
2.1. Щелочноземельные металлы реагируют с водой . Взаимодействие с водой приводит к образованию щелочи и водорода. Бериллий с водой не реагирует. Магний реагирует с водой при кипячении. Кальций, стронций и барий реагируют с водой при комнатной температуре.
Например , кальций реагирует с водой с образованием гидроксида кальция и водорода:
2 Ca 0 + 2 H2 + O = 2 Ca + ( OH)2 + H2 0
2.2. Щелочноземельные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной, разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например , магний реагирует с соляной кислотой :
2Mg + 2HCl → MgCl2 + H2↑
2.3. При взаимодействии щелочноземельных металлов с концентрированной серной кислотой образуется сера.
Например , при взаимодействии кальция с концентрированной серной кислотой образуется сульфат кальция, сера и вода:
2.4. Щелочноземельные металлы реагируют с азотной кислотой . При взаимодействии кальция и магния с концентрированной или разбавленной азотной кислотой образуется оксид азота (I):
При взаимодействии щелочноземельных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочноземельные металлы могут восстанавливать некоторые неметаллы (кремний, бор, углерод) из оксидов.
Например , при взаимодействии кальция с оксидом кремния (IV) образуются кремний и оксид кальция:
2Ca + SiO2 → 2CaO + Si
Магний горит в атмосфере углекислого газа . При этом образуется сажа и оксид магния:
2Mg + CO2 → 2MgO + C
2.6. В расплаве щелочноземельные металлы могут вытеснять менее активные металлы из солей и оксидов . Обратите внимание! В растворе щелочноземельные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , кальций вытесняет медь из расплава хлорида меди (II):
Ca + CuCl2 → CaCl2 + Cu
Оксиды щелочноземельных металлов
Способы получения
1. О ксиды щелочноземельных металлов можно получить из простых веществ — окислением металлов кислородом :
2Ca + O2 → 2CaO
2. Оксиды щелочноземельных металлов можно получить термическим разложением некоторых кислородсодержащих солей — карбонатов , нитратов .
Например , нитрат кальция разлагается на оксид кальция, оксид азота (IV) и кислород:
3. Оксиды магния и бериллия можно получить термическим разложением гидроксидов :
Химические свойства
Оксиды кальция, стронция, бария и магния — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой. Оксид бериллия — амфотерный .
1. Оксиды кальция, стронция, бария и магния взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид магния взаимодействует с углекислым газом с образованием карбоната магния:
2. Оксиды щелочноземельных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид кальция взаимодействует с соляной кислотой с образованием хлорида кальция и воды:
CaO + 2HCl → CaCl2 + H2O
3. Оксиды кальция, стронция и бария активно взаимодействуют с водой с образованием щелочей.
Например , оксид кальция взаимодействует с водой с образованием гидроксида кальция:
CaO + H2O → 2Ca(OH)2
Оксид магния реагирует с водой при нагревании:
MgO + H2O → Mg(OH)2
Оксид бериллия не взаимодействует с водой.
4. Оксид бериллия взаимодействует с щелочами и основными оксидами.
При взаимодействии оксида бериллия с щелочами в расплаве или с основными оксидами образуются соли-бериллаты.
Например , оксид натрия реагирует с оксидом бериллия с образованием бериллата натрия:
Например , гидроксид натрия реагирует с оксидом бериллия в расплаве с образованием бериллата натрия:
При взаимодействии оксида бериллия с щелочами в растворе образуются комплексные соли.
Например , оксид бериллия реагирует с гидроксидом калия с растворе с образованием тетрагидроксобериллата калия:
Гидроксиды щелочноземельных металлов
Способы получения
1. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих оксидов с водой .
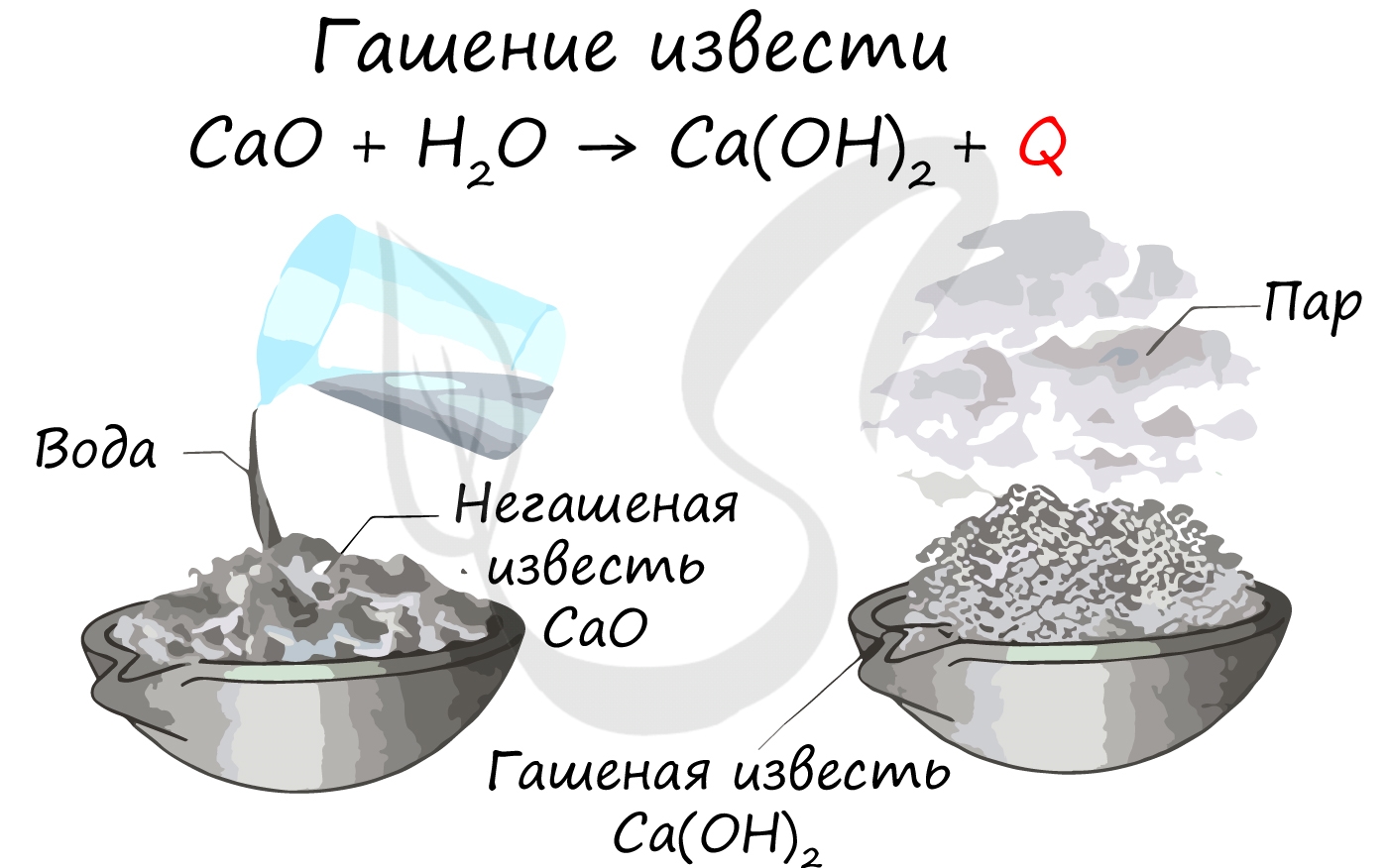
Например , оксид кальция (негашеная известь) при взаимодействии с водой образует гидроксид кальция (гашеная известь):
Оксид магния взаимодействует с водой только при нагревании:
2. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих металлов с водой.
Например , кальций реагирует с водой с образованием гидроксида кальция и водорода:
Магний взаимодействует с водой только при кипячении:
3. Гидроксиды кальция и магния можно получить при взаимодействии солей кальция и магния с щелочами .
Например , нитрат кальция с гидроксидом калия образует нитрат калия и гидроксид кальция:
Химические свойства
1. Гидроксиды кальция, стронция и бария реагируют с всеми кислотами (и сильными, и слабыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Гидроксид магния взаимодействует только с сильными кислотами.
Например , гидроксид кальция с соляной кислотой реагирует с образова-нием хлорида кальция:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид бария с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
3. Гидроксиды кальция, стронция и бария реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид бария с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. Гидроксиды кальция, стронция и бария взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид кальция реагирует с гидрокарбонатом кальция с образованием карбоната кальция:
5. Гидроксиды кальция, стронция и бария взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода). Взаимодействие щелочей с неметаллами подробно рассмотрено в статье про щелочные металлы.
6. Гидроксиды кальция, стронция и бария взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
7. Гидроксиды кальция, стронция и бария вступают в обменные реакции с растворимыми солями. Как правило, с этими гидроксидами реагируют растворимые соли тяжелых металлов (в ряду активности расположены правее алюминия), а также растворимые карбонаты, сульфиты, силикаты, и, для гидроксидов стронция и бария — растворимые сульфаты.
Например , хлорид железа (II) реагирует с гидроксидом бария с образованием хлорида бария и осадка гидроксида железа (II):
Также с гидроксидами кальция, стронция и бария взаимодействуют соли аммония.
Например , при взаимодействии бромида аммония и гидроксида кальция образуются бромид кальция, аммиак и вода:
8. Гидроксид кальция разлагается при нагревании до 580 о С, гидроксиды магния и бериллия разлагаются при нагревании:
9. Гидроксиды кальция, стронция и бария проявляют свойства сильных оснований . В воде практически полностью диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
Ba(OH)2 ↔ Ba 2+ + 2OH —
Гидроксид магния — нерастворимое основание. Гидроксид бериллия проявляет амфотерные свойства.
10. Гидроксид и бериллия взаимодействует с щелочами . В расплаве образуются соли бериллаты, а в растворе щелочей — комплексные соли.
Например , гидроксид бериллия реагирует с расплавом гидроксида натрия:
При взаимодействии гидроксида бериллия с избытком раствора щелочи образуется комплексная соль:
Соли щелочноземельных металлов
Нитраты щелочноземельных металлов
Нитраты кальция, стронция и бария при нагревании разлагаются на нитриты и кислород. Исключение — нитрат магния. Он разлагается на оксид магния, оксид азота (IV) и кислород.
Например , нитрат кальция разлагается при нагревании на нитрит кальция и молекулярный кислород:
Карбонаты щелочноземельных металлов
1. Карбонаты щелочноземельных металлов при нагревании разлагаются на оксид и углекислый газ.
Например , карбонат кальция разлагается при температуре 1200 о С на оксид кальция и углекислый газ:
2. Карбонаты щелочноземельных металлов под действием воды и углекислого газа превращаются в растворимые в воде гидрокарбонаты.
Например , карбонат кальция взаимодействует с углекислым газом и водой с образованием гидрокарбоната кальция:
3. Карбонаты щелочноземельных металлов взаимодействуют с более сильными кислотами с образованием новой соли, углекислого газа и воды.
Более сильные кислоты вытесняют менее сильные из солей.
Например , карбонат магния взаимодействует с соляной кислотой:
4. Менее летучие оксиды вытесняют углекислый газ из карбонатов при сплавлении. К менее летучим, чем углекислый газ, оксидам относятся твердые оксиды — оксид кремния (IV), оксиды амфотерных металлов.
Менее летучие оксиды вытесняют более летучие оксиды из солей при сплавлении.
Например , карбонат кальция взаимодействует с оксидом алюминия при сплавлении:
Жесткость воды
Постоянная и временная жесткость
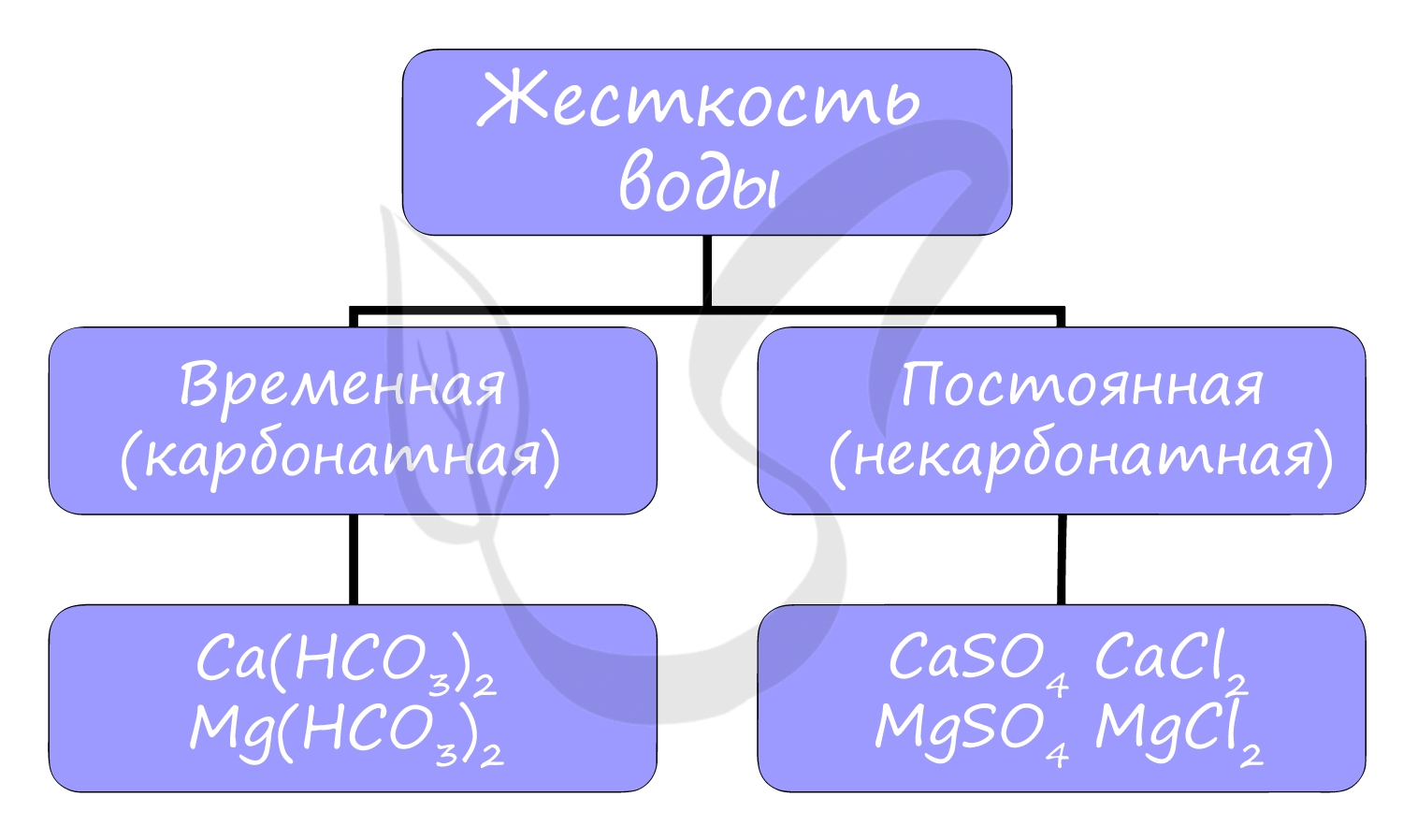
Жесткость воды — это характеристика воды, обусловленная содержанием в ней растворенных солей щелочноземельных металлов, в основном кальция и магния (солей жесткости).
Временная (карбонатная) жесткость обусловлена присутствием гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2 в воде.
Постоянная (некарбонатная) жесткость обусловлена присутствием солей, не выделяющихся при кипячении из раствора: хлоридов (CaCl2) и сульфатов (MgSO4) кальция и магния.
Способы устранения жесткости
Существуют химические и физические способы устранения жесткости. Химические способы устранения временной жесткости:
1. Кипячение. При кипячении гидрокарбонаты кальция и магния распадаются на нерастворимые карбонаты, углекислый газ и воду:
2. Добавление извести (гидроксида кальция). При добавлении щелочи растворимые гидрокарбонаты переходят в нерастворимые карбонаты:
Химические способы устранения постоянной жесткости — реакции ионного обмена, которые позволяют осадить ионы кальция и магния из раствора:
1. Добавление соды (карбоната натрия). Карбонат натрия связывает ионы кальция и магния в нерастворимые карбонаты:
CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl
2. Добавление фосфатов. Фосфаты также связывают ионы кальция и магния:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
Бериллий Be
магний Mg
кальций Ca,
стронций Sr,
барий Ba и
радий Ra.
Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Видео:Химия 9 класс (Урок№24 - Щелочноземельные металлы. Важнейшие соединения и их применение.)Скачать

Общая характеристка щелочноземельных металлов
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns 2 :
Be — 2s 2
Mg —3s 2
Ca — 4s 2
Sr — 5s 2
Ba — 6s 2
Ra — 7s 2
Видео:Химические свойства металлов. 9 класс.Скачать

Нахождение в природе щелочноземельных металлов
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Способы получения щелочноземельных металлов
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий
Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
Видео:Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Химические свойства щелочноземельных металлов
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
Sr — карминово-красный (алый)
- Взаимодействие с веществами:
Взаимодействие с простыми веществами — неметаллами
С кислородом
С кислородом взаимодействуют при нагревании с образованием оксидов
С галогенами
Щелочноземельные металлы реагируют с галогенами при нагревании с образованием галогенидов .
С водородом
Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
Бериллий с водородом не взаимодействует.
Магний реагирует только при повышенном давлении:
С серой
Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
Ca + 2C → CaC2 (карбиды)
С азотом
При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
С углеродом
Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
Бериллий при нагревании с углеродом с образует карбид — метанид:
С фосфором
Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
Взаимодействие со сложными веществами
С водой
Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
С кислотами
- С растворами HCl, H2SO4,H3PO4щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:
Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
с концентрированной серной:
с разбавленной и концентрированной азотной:
С водными растворами щелочей
В водных растворах щелочей растворяется только бериллий:
С солями
В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
С оксидами
Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
2Ca + SiO2 → 2CaO + Si
Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
🔍 Видео
Химия 9 класс (Урок№23 - Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды.)Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Соединения магния и щелочноземельных металловСкачать

Магний и щелочноземельные металлы. Видеоурок 15. Химия 9 классСкачать

Щелочные металлы. Видеоурок 14. Химия 9 классСкачать

Опыты по химии. Окраска пламени солями щелочных и щелочноземельных металловСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Щелочноземельные металлы (IIA группы) - общая характеристика и получение. Подготовка к ЕГЭ по ХимииСкачать

Щелочноземельные металлы. Важнейшие соединения щелочноземельных металлов их применение.Скачать

Щелочные металлы - САМЫЕ ОПАСНЫЕ и Активные Элементы!Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Получение металлов. 9 класс.Скачать

способы получения металловСкачать