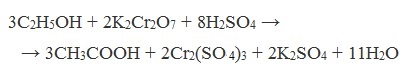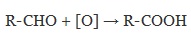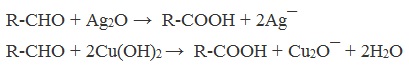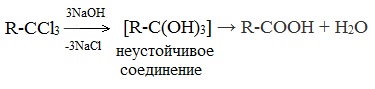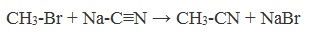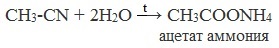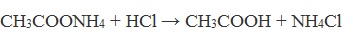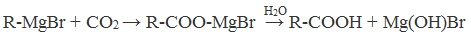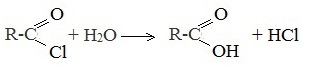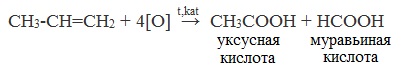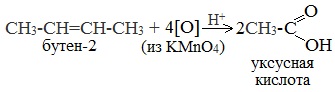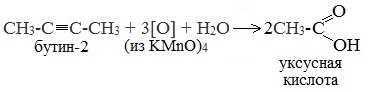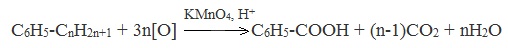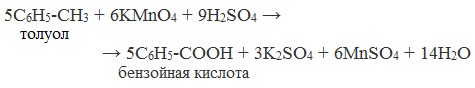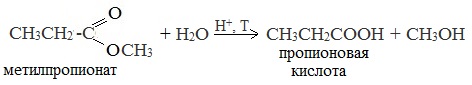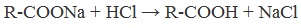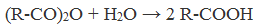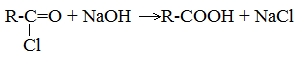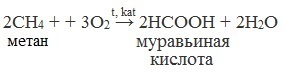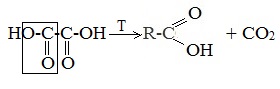Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
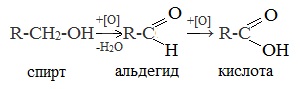
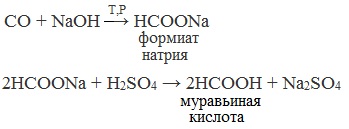
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Щавелевая Кислота - КАЧЕСТВЕННАЯ РЕАКЦИЯСкачать  Получение щавелевой кислоты из ацетилена уравнение реакцииНекоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот Общие способы получения карбоновых кислот1. Окисление первичных спиртов и альдегидов под действием различных окислителей В качестве окислителей применяют KMnO4 и K2Cr2O7. Например: Для окисления альдегидов используются те же реагенты, что и для спиртов. При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора. При окислении дихроматом калия — цвет меняется с оранжевого на зеленый. А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов: 2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты: 3. Получение карбоновых кислот из цианидов (нитрилов) Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия: Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония: При подкислении раствора выделяется кислота: 4. Использование реактива Гриньяра (по схеме) 5. Гидролиз галогенангидридов кислот С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту: В промышленности1. Выделяют из природных продуктов (жиров, восков, эфирных и растительных масел) 2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением) Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота: 3. Окисление алкенов и алкинов При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи: При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты: 4. Окисление гомологов бензола (получение бензойной кислоты) Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия: В лаборатории1. Гидролиз сложных эфиров При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации): 2. Из солей карбоновых кислот 3. Гидролиз ангидридов кислот При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты: 4. Щелочной гидролиз галоген производных карбоновых кислот Специфические способы получения важнейших кислотСпособы получения НСООН 1. Взаимодействие оксида углерода (II) с гидроксидом натрия Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой: 2. Каталитическое окисление метана 3. Декарбоксилирование щавелевой кислоты Муравьиную кислоту можно получить при нагревании щавелевой кислоты: Способы получения СН3СООН Получение уксусной кислоты для химических целей 1. Синтез из ацетилена Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана): 2. Каталитическое окисление бутана Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха: Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект. 3. Каталитическое карбонилирование метанола Получение уксусной кислоты для пищевых целей 4. Уксуснокислое брожение этанола Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво): Видео:ЩАВЕЛЕВАЯ КИСЛОТАСкачать  Щавелевая кислотаПредельная карбоновая двухосновная кислота с брутто-формулой C2H2O4 называется, по систематической номенклатуре, этандиовой кислотой. Это вещество также известно под другим, более распространенным названием — щавелевая кислота. Впервые она была получена немецким химиком Ф. Велером из дициана (динитрил щавелевой кислоты) в 1824 году. Бесцветные кристаллы кислоты растворяются в воде с образованием бесцветных растворов. Масса молярная составляет 90,04 г/моль. По внешнему виду напоминает моноклинные бесцветные кристаллы. При температуре 20 оС в 100 г воды растворяется 8 г щавелевой кислоты. Хорошо растворяется в ацетоне, этиловом спирте и серном эфире. Плотность 1,36 г/см³. Плавится при температуре 189,5 оС, возгоняется при 125 оС, разлагается при 100—130 оС. Всеми химическими свойствами, характерными для карбоновых кислот, обладает щавелевая кислота. Формула ее: НООС—СООН. Несмотря на то, что относится к карбоновым кислотам, считается сильной органической кислотой (в 3000 раз сильнее, чем уксусная кислота): C2O4H2 → C2O4H- + H+ (рК = 1,27) и далее: C2O4H- → C2O42 — + H+ (рК = 4,27). Эфиры и соли этой кислоты называют оксалатами. Оксалат-ион C2O42− является восстановителем. При взаимодействии щавелевой кислоты с раствором перманганата калия (KMnO4) последний восстанавливается и раствор обесцвечивается. Для нее характерна обратимая и медленно протекающая реакция взаимодействия со спиртами (этерификация), в результате которой образуются сложные эфиры: HOOC—COOH + 2HOR ↔ 2H2O + ROOC—COOR. В промышленности щавелевая кислота получается окислением химических соединений. Например, в присутствии ванадиевого катализатора (V2O5) смесью азотной (HNO3) и серной (H2SO4) кислот окисляют спирты, углеводы и гликоли. Также применяется способ окисления этилена и ацетилена азотной кислотой (HNO3) в присутствии палладиевых солей Pd(NO3)2 или PdCl2. Щавелевую кислоту получают из пропилена, который окисляют жидким диоксидом азота (NO2). Имеет хорошую перспективу способ получения кислоты взаимодействием гидроокиси натрия (NaOH) с угарным газом (CO) через промежуточную стадию образования формиата натрия: NaOH + CO → HCOONa. Затем образуется оксалат натрия и выделяется водород: HCOONa + NaOH → NaOOC—COONa + H2↑. Из оксалата натрия в кислой среде получается кислота щавелевая: NaOOC—COONa + 2H+ → НООС—СООН + 2Na+. Основные области применения щавелевой кислоты — это очистка или отбеливание. Щавелевая кислота способна эффективно удалять ржавчину, поэтому многие чистящие средства содержат это химическое соединение. Около четверти производимой щавелевой кислоты используется как протрава для крашения в кожевенных и текстильных производствах. Применяется также в качестве реактива (ГОСТ 22180-76) в аналитической химии. Этандиоевая кислота дигидрат (НООС—СООН •H2O) по ТУ 2431-002-77057039-2006 с массовой долей основного вещества ≥ 99,3 % используется в производственных процессах органического синтеза, для очистки от ржавчины и накипи металлов, для отбеливания срезов в микроскопии. Пчеловоды применяют раствор щавелевой кислоты с массовой долей 3,2 % в сахарном сиропе для борьбы с паразитическим клещом. При завершении мраморных структур ею обрабатывают поверхности для уплотнения и придания им блеска. Щавелевая кислота и оксалаты присутствует во многих растениях, в том числе в черном чае, встречаются в организме животных. Основной вред для человека связан с почечной недостаточностью, которая возникает из-за взаимодействия щавелевой кислоты с кальцием, в результате происходит осаждение твердого оксалата кальция (СаС2O4) — основной компонент камней в почках. Кислота провоцирует боли в суставах из-за осаждения в них подобных соединений. Щавелевая кислота может образовываться в организме в результате метаболизма этиленгликоля, поступающего из окружающей среды (например, антиобледенительное средство для обработки взлетно-посадочных полос и самолетов в аэропортах, а также из других антропогенных источников). Потенциальные проблемы с оксалатами в организме человека можно разделить на две. Первая — важный макроэлемент кальций связывается щавелевой кислотой и образуется его дефицит в клетках тканей и органов. Вторая — образование камней в почках. Самое большое количество щавелевой кислоты содержится в шпинате, листьях и стеблях ревеня, щавеле, свекле, петрушке, зеленом луке. 📹 ВидеоСинтез щавелевой кислотыСкачать  Щавелевая кислота для пчёлСкачать  ЩАВЕЛЕВАЯ КИСЛОТА, ОБРАБОТКА ПЧЕЛ ОТ КЛЕЩА ПРОЛИВОМ.Скачать  Реакция Гидрокарбоната Натрия и Щавелевой Кислоты. Реакция NaHCO3 и H2C2O4Скачать  ВЫ ПОЛУЧИТЕ ОГРОМНЫЙ УРОЖАЙ ОГУРЦОВ, когда начнете обрабатывать их щавелевой кислотой!Скачать  Как и когда применять щавелевую кислоту для борьбы с клещем Варроа? (КПБ)Скачать  Сублиматор щавелевой кислоты Щавелевая кислота и аскосферозСкачать  рецепт раствора щавелевой кислоты для полотенец от клещаСкачать  осаждение золота щавелевой кислотой.Скачать  Сублиматор щавелевой кислоты за копейки! Легко Своими руками!Скачать  Весенняя обработка пчёл ЩАВЕЛЕВОЙ КИСЛОТОЙ.Скачать  ИСПАРИТЕЛЬ ,ИНСТРУКЦИЯ , ОБРАБОТКА ЩАВЕЛЕВОЙ КИСЛОТОЙ.Скачать  Получение щавелевой кислоты из сахараСкачать  Реакция НИТРАТА СЕРЕБРА и ЩАВЕЛЕВОЙ КИСЛОТЫ.Reaction of SILVER NITRATE and OXALIC ACID.Опыты химияСкачать  Щавелевая кислота. Секреты пчеловодства от Кашковского В.Г.Скачать  Реакция ДИХРОМАТА АММОНИЯ, ЩАВЕЛЕВОЙ КИСЛОТЫ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Опыты по химии.Скачать  Получение соляной кислотыСкачать  Профессор Кашковский про обработку щавелевой кислотой на сахарном сиропеСкачать  |