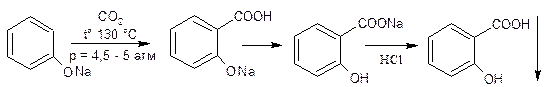Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Получение салициловой кислоты из ацетилсалициловой кислоты (аспирина)Скачать  Лекция 19. Ароматические кислоты и их производные» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»> Видео:Получение САЛИЦИЛОВОЙ КИСЛОТЫ из АСПИРИНА. Гидролиз АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ. Опыты по химииСкачать  Ароматические кислоты и их производные.Ароматические кислоты – производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода замещены карбоксильными группами. В качестве лекарственных веществ и исходных продуктов их синтеза наибольшее значение имеют бензойная кислота и кислота салициловая (фенолокислота): Наличие ароматического ядра в молекуле усиливает кислые свойства вещества. Константа диссоциации у бензойной кислоты имеет несколько меньшее значение ( К=6,3·10 -5 ), чем у уксусной (К=1,8·10 -5 ). Аналогичными химическими свойствами обладает и салициловая кислота, однако присутствие фенольного гидроксила в ее молекуле повышает константу диссоциации до 1,06·10 -3 и расширяет число аналитических реакций, которые могут быть использованы для качественного о количественного анализа. Бензойная и салициловая кислоты при взаимодействии со щелочами образуют соли. Ароматические кислоты так же, как и неорганические или алифатические, проявляют антисептическое действие. Они могут оказывать на ткани также раздражающее и прижигающее действие, связанное с образованием альбуминатов. Фармакологический эффект зависит от степени диссоциации кислоты. Натриевые соли бензойной и салициловой кислот в отличие от самих кислот легко растворимы в воде. В водных растворах они ведут себя как соли сильных оснований и слабых кислот. Фармакологическое действие солей и самих кислот одинаково, однако из-за большей растворимости раздражающее действие их ниже. Бензойная кислота-Acidum benzoicum Натрия бензоат-Natrii benzoicum Свойства. Бензойная кислота – бесцветные игольчатые кристаллы или белый мелкокристаллический порошок с т.пл. 122-124,5°C. Бензоат натрия – белый мелкокристаллический порошок без запаха или с очень слабым запахом, сладко-соленого вкуса. Температура плавления не определяется. Получение. 1. Окисление толуола перманганатом калия, двуокисью марганца, бихроматом калия. 2. Парофазный каталитический процесс окисления кислородом воздуха толуола до бензойной кислоты. 3. Декарбоксилирование фталевой кислоты до бензойной. Подлинность. Из реакций подлинности специфичной для бензойной кислоты и ее солей является реакция образования комплексной соли телесного цвета при взаимодействии ее с раствором FeCl3. Для этого бензойную кислоту нейтрализуют щелочью по индикатору и затем добавляют несколько капель раствора Fe Cl3: Необходимым условием проведения этой реакции является получение нейтральной натриевой соли бензойной кислоты, так как в кислой среде осадок комплексной соли будет растворяться, при избытке щелочи будет выпадать бурый осадок гидроокиси железа (III). При действии на бензойную кислоту перекиси водорода в присутствии катализатора сульфата железа (II) она превращается в салициловую кислоту, которая может быть обнаружена по фиолетовому окрашиванию с раствором FeCl3: В качестве одной из примесей в препарате может быть продукт неполного хлорирования исходного вещества синтеза (толуола), который обнаруживается по зеленому цвету пламени после внесения крупинки препарата на медной проволоке в бесцветное пламя горелки — реакция Белыитейна. Количественное содержание препарата определяется методом нейтрализации в спиртовой среде по индикатору фенолфталеину: Бензойная кислота применяется как слабый антисептик в мазевых основах, она действует и как отхаркивающее средство. Чаще бензойная кислота применяется в виде своей натриевой соли C6H5COONa. Введение катиона натрия уменьшает раздражающее действие бензойной кислоты и в то же время несколько уменьшает антисептическую активность препарата. Соли бензойной кислоты действуют как слабые диуретики и, подобно самой бензойной кислоте, применяются для консервации пищевых продуктов. Бензойная кислота летуча, поэтому хранить ее следует в хорошо закупоренных склянках. Бензоат натрия. Получение. Получают по реакции нейтрализации бензойной кислоты содой или щелочью: Подлинность препарата подтверждается образованием осадка телесного цвета при действии раствора FеСl3 . Сухой остаток после прокаливания бензоата натрия окрашивает пламя горелки в желтый цвет (реакция на Na + ). Если этот остаток растворить в воде, реакция среды оказывается щелочной на лакмус (реакция на Na + ). Характерной (но не официнальной) реакцией на бензоат натрия является реакция с 5% раствором сульфата меди — выпадает осадок бирюзового цвета. Этой реакцией удобно пользоваться во внутриаптечном контроле как быстро выполнимой и специфичной для данного препарата. При действии на бензоат натрия минеральной кислоты выпадает осадок бензойной кислоты, который отфильтровывается, высушивается и подтверждается определением температуры плавления (122—124,5°). Эта реакция положена в основу количественного определения препарата: бензоат натрия растворяют в воде и в присутствии эфира, извлекающего бензойную кислоту, титруют кислотой при индикаторе метиловом оранжевом. Применяется внутрь как отхаркивающее и слабо дезинфицирующее средство. Кроме того, применяется для исследования антитоксической функции печени. Находящаяся в печени аминоуксусная кислота глицин-1 вступает в реакцию с бензойной кислотой с образованием гиппуровой кислоты, которая выделяется с мочой. По количеству выделенной гиппуровой кислоты судят о состоянии печени. Из эфиров бензойной кислоты в медицинской практике находит применение в настоящее время бензилбензоат. Бензилбензоат медицинский –Benzylii benzoas medicinalis. Свойства. Бесцветная маслянистая жидкость со слегка ароматическим запахом. Острого и жгучего вкуса. Практически не растворим в воде. Смешивается в любых соотношениях со спиртом, эфиром и хлороформом. Температура кипения 316-317°C, Т.пл. 18,5-21°C. Нормативный документ ФС 42-1944-89. Получение. Взаимодействием хлористого бензоила и бензилового спирта в присутствии оснований. Подлинность.
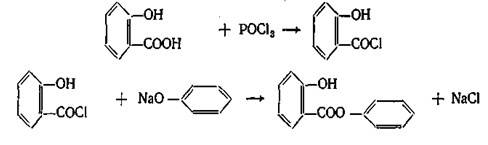
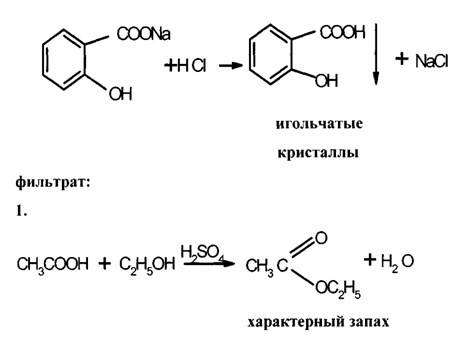
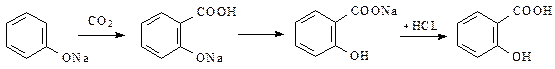
Применение. В качестве противочесоточного средства, против вшей. Применяется в ряде косметических средств. Форма выпуска: гель 20%, крем 25%, мазь 10%, эмульсия. ФЕНОЛОКИСЛОТЫ. Кислота салициловая. Acidum salicylicum. Из трех возможных изомеров фенолокислот только салициловая или о-оксибензойная кислота проявляет наибольшую физиологическую активность. Сама салициловая кислота в настоящее время малоприменима, однако ее производные являются одними из самых многотоннажных лекарственных средств. Сама салициловая кислота –игольчатые кристаллы или мелкокристаллический порошок. При нагревании способна возгоняться – этот факт используется для очистки салициловой кислоты при производстве ацетилсали-циловой кислоты. При нагревании свыше 160°C дексарбоксилируется с образованием фенола. Впервые салициловая кислота была получена окислением феноло-спирта салигенина, который был получен при гидролизе гликозида салицина, содержащегося в коре ивы. От латинского названия ивы — Salix — и произошло название «салициловая кислота»: В эфирном масле растения Gaulteria procumbens находится метиловый эфир салициловой кислоты, омылением которого может быть также получена салициловая кислота. Однако природные источники салициловой кислоты не могут удовлетворить потребности в ее препаратах и поэтому кислоту и ее производные получают исключительно синтетическим путем. Наибольший интерес и промышленное значение имеет метод получения салициловой кислоты из фенолята натрия. Этот метод впервые применил Кольбе и усовершенствовал Р. Шмидт. Сухой фенолят натрия подвергают действию двуокиси углерода под давлением 4,5—5 атм. при температуре 120—135°. В этих условиях СО2 внедряется в молекулу фенолята в о-положение по отношению к фенольному гидроксилу: Полученный фенолят салициловой кислоты тотчас же претерпевает внутримолекулярную перегруппировку, в результате получается натриевая соль салициловой кислоты, которая при подкислении выделяет салициловую кислоту: Салициловая кислота проявляет одновременно свойства фенола и кислоты. Как фенол она дает типичную для фенола реакцию с раствором хлорного железа. Салициловая кислота в отличие от фенолов может растворяться не только в щелочах, но и в растворах карбонатов. При растворении в карбонатах она дает среднюю соль – салицилат натрия – применяемую в медицине: В щелочах образуется динатриевая соль. 3.Температура плавления 158-161°C. При наличии избытка брома происходит декарбоксилирование и образование трибромфенола. Этот метод используется также для количественного определения. Количественное определение. 1. Методом нейтрализации в спиртовом растворе при индикаторе фенолфталеине ( фармакопейный метод). 2. Броматометрический метод. Избыток брома определяется йодометрически. Применение. Наружно как антисептическое и раздражающее средство. Формы выпуска. Мази 4%, салициловой кислоты, бензойной кислоты и вазелина паста, салицилово-цинковая паста, спиртовые растворы 2%. Хранение. В плотно закрытых склянках в защищенном от света месте. Натрия салицилат Подлинность препарата. Количественное определение. 1. Ацидиметрический метод прямого титрования. В качестве индикаторов используется смесь метилового оранжевого и метиленового синего. 2. Броматометрический метод. Применение. Внутрь в порошках и таблетках в качестве болеутоляющего и противовоспалительного средства при ревматизме.Таблетки 0,25 и 0,5 г, Таблетки натрия салицилата 0,3 и кофеина 0.05 г.. Эфиры салициловой кислоты. МЕТИЛСАЛИЦИЛАТ – Methylii salicilas В природе встречается в эфирном масле растения Gaulteria procumbens, но в промышленности его получают синтетическим путем при нагревании салициловой кислоты с метиловым спиртом в присутствии серной кислоты. Метилсалицилат – бесцветная жидсть с ароматным запахом. Дает характерную реакцию с хлорным железом на фенолы. Для препарата определяется в качестве характеристического показателя – показатель преломления 1,535-1,538. Недопустимые примеси влага и кислота, так в этих условиях происходит гидролиз препарата. Количественное определение. Проводят по количеству щелочи, затраченной на омыление эфира. К навеске препарата добавляют избыток титрованного раствора щелочи и нагревают, оставшуюся после омыления щелочь оттитровывают кислотой. Применяется наружно как обезболивающее и противовоспалительное средство чаще всего в виде линиментов с хлороформом и жирными маслами. Фенилсалицилат –Phenylii salicylas Фенилсалицилат (салол) является эфиром салициловой кислоты и фенола. Впервые он был получен М. В. Ненцким в 1886 г. Учитывая раздражающее действие салициловой кислоты, он стремился найти такой препарат, который бы, сохраняя антисептические свойства фенола, не обладал ядовитым свойством фенола и раздражающим действием кислоты. С этой целью он заблокировал карбоксильную группу в салициловой кислоте и получил эфир ее с фенолом. Исследования показали, что салол, проходя через желудок, не изменяется, а в щелочной среде кишечника омыляется с образованием натриевых солей салициловой кислоты и фенола, которые и оказывают лечебное действие. Так как омыление происходит медленно, продукты омыления салола поступают в организм постепенно и не накапливаются в больших количествах, что обеспечивает более длительное действие препарата. Этот принцип введения в организм сильнодействующих веществ в виде их сложных эфиров вошел в литературу как «принцип салола» М. В. Ненцкого и использовался в дальнейшем для синтеза многих лекарственных препаратов. Свойства. Мелкие бесцветные кристаллы со слабым запахом. Температура плавления 42-43°C. Получение. Фенилсалицилат получают синтетически. Наиболее распространенным и общепринятым методом является следующий: Качественные реакции. В молекуле салола сохранилась свободная фенольная группа, поэтому реакция с раствором FeCl3 дает фиолетовое окрашивание. С реактивом Марки, подобно другим фенолам, препарат дает красноватое окрашивание. Количественное определение. 1. Омылением с последующим титрованием избытка щелочи кислотой (фармакопейный метод). Форма выпуска. Таблетки 0,25 и 0,5 г., таблетки с экстрактом красавки и висмутом нитрата основным. Применение. Антисептическое действие для лечения заболеваний кишечника. Эфиры салициловой кислоты по ОН-группе. Кислота ацетилсалициловая –Acidum acetylsalicylicum. о-Ацетилсалициловая кислота является природным продуктом и содержится в цветах растений вида спиреи (spiraea ulmaria). Этот эфир был введен в медицинскую практику лечения острого суставного ревматизма еще в 1874 г., а как синтетическое лекарственное вещество стал выпускаться в промышленных масштабах в конце прошлого века под названием аспирин (приставка “а” означала, что данное лекарственное вещество не добывается из спиреи, а делается химическим путем). Аспирин называют лекарством 20-го столетия. В настоящее время его производят в мире более 100 тысяч тонн в год. Известны его противовоспалительные, жаропонижающие и болеутоляющие свойства. Обнаружено также, что он препятствует образованию тромбов, оказывает сосудорасширяющее действие и начинает применяться даже для профилактики и лечения инфарктов и инсультов. Считают, что весь потенциал лечебных свойств этого вещества еще не исчерпан. В то же время аспирин раздражает слизистую оболочку желудочно-кишечного тракта, что может вызывать кровотечения. Возможны также аллергические реакции. Аспирин в организме влияет на синтез простагландинов (контролирующих, в частности, образование тромбов) и гормона гистамина (расширяющего сосуды и вызывающего приток иммунных клеток к месту воспаления; кроме того, он может препятствовать при воспалительных процессах биосинтезу болевых веществ). Свойства. Бесцветные кристаллы или белый порошок слабокислого вкуса. Мало растворим в воде(1:500), легко растворим в спирте. Подлинность. 1. Омыление едким натром приводит к образованию салицилата натрия, который при обработке кислотой дает осадок салициловой кислоты. 2. По фиолетовому окрашиванию с хлорным железом после гидролиза и отщепления ацетильного фрагмента. 3. Салициловая кислота дает характерную реакцию образования ауринового красителя с реактивом Марки: 4.Температура плавления 133-136°C. Специфической примесью, контролируемой согласно требований Фармакопейной статьи является салициловая кислота. Содержание салициловой кислоты должно быть не более 0,05%. Метод анализа спектрофотометричексий комплекса, образующегося при взаимодействии железоаммонийных квасцов с салициловой кислотой, окрашенного в синий цвет. Количественное определение. 1. Метод нейтрализации по свободной карбоксильной группе (фармакопейный метод). Титрование проводят в спиртовой среде (во избежание гидролиза ацетильной группы), индикатор фенолфталеин. 2. Омылением с последующим титрованием избытка щелочи кислотой по метиловому оранжевому. Фактор эквивалентности равен ½. 3. Броматометрический метод. 4. ВЭЖХ в буферной среде. Форма выпуска. Таблетки от 0,1 до 0,5 г. Известны таблетки с кишечнорастворимым покрытием, шипучие таблетки. Используется в композиционных лекарственных средствах в комбинации с кофеином, кодеином и другими веществами. Применение – противовоспалительное, жаропонижающее, дезагрегант. Хранение в укупоренных банках. Ведутся работы по синтезу других производных с фрагментом салицилата. Так, получен препарат флюфенизал (11), который в четыре раза более активен, чем аспирин, по противовоспалительному действию (в ревматоидном артрите) и мягче в отношении слизистой оболочки желудка. Его получают фторсульфонированием производного дифенила (7) до соединения (8), в котором затем элиминируют SО2 в присутствии трифенилфосфинродийфторида. Образовавшийся фторид (9) гидрируют для снятия бензильной защиты, затем получают фенолят, который карбоксилируют по методу Кольбе до арилсалицилата (10). После ацилирования соединения (10) получают флюфенизал (11): АМИДЫ САЛИЦИЛОВОЙ КИСЛОТЫ САЛИЦИЛАМИД –Salicylamidum Свойства. Белый кристаллический порошок с т.пл. 140-142°C. Качественные реакции. Количественное определение проводят по выделившемуся аммиаку. Форма выпуска. Таблетки 0,25 и 0,5 г. Жаропонижающее средство. ОКСАФЕНАМИД Oxaphenamidum. Свойства. Белый или белый с лиловато-серым оттенком порошок без запаха с т.пл. 175-178°C. Получение. Сплавлением фенилсалицилата с п-аминофенолом. Фенолы отгоняют. Оставшуюся смесь обрабатывают изопропанолом с соляной кислотой. Кристаллы отфильтровывают и перекристаллизовывают из амилового спирта. Подлинность. 1. Спиртовый раствор дает с хлорным железом красно-фиолетовое окрашивание. 2. С соляной кислотой в присутствии резорцина образуется индофенол, дающий с едким натром красно-фиолетовое окрашивание: 1.Метод Кьельдаля Форма выпуска. Таблетки 0,25 и 0,5 г. Желчегонное средство (холециститы, желчекаменная болезнь). ПРОИЗВОДНЫЕ ФЕНИЛПРОПИОНОВОЙ КИСЛОТЫ ИБУПРОФЕН – Ibuprofenum Бесцветные кристаллы, белый порошок, температура плавления 75-77°C, нерастворим в воде, растворим в спирте. Нестероидное противовоспалительное средство. Препарат относительно малотоксичен, обладает выраженной противовоспалител-ной и болеутоляющей активностью, жаропонижающим действием, стимулирует образование эндогенного интерферона. Применяют для лечения ревматоидного артрита, других заболеваний суставов, для снижения температуры у больных. Ниже приведен синтез, заключающийся в ацетилировании изобутилбензола по Фриделю-Крафтсу, получении циангидрина реакцией с цианистым натрием и восстановлении этого циангидрина под действием иодистоводородной кислоты и фосфора в п-изобутил-α-метилфенилуксусную кислоту — ибупрофен. Подлинность. Количественное определение нейтрализация спиртовым раствором едкого натра с фенолфталеином в спиртовом растворе. Форма выпуска. Таблетки 0,2 г. покрытые оболочкой. Композиционные лекарственные формы с кодеином (нурофен) и др. Примененние. Нестероидное противовоспалительное средство. Обладающее обезболивающим эффектом. Среди других нестероидных противовоспалительных препаратов следует отметить следующие: ДИКЛОФЕНАК НАТРИЯ, Ортофен, Вольтарен Diclofenac sodium Свойства. Белый или сероватый порошок, растворим в воде. Препараты натрия диклофенак, мефенаминовая кислота и индометацин близки по противовоспалительному и болеутоляющему действию, последний обладает несколько более значительными эффектами в этом отношении, но первый менее токсичен и обладает лучшей переносимостью. Натрия диклофенак и мефенаминовая кислота хорошо проникает в полости суставов при ревматоидном артрите, его применяют при остром ревматизме, артрозах. Используется для купирования болей и при заболеваниях слизистой оболочки полости рта и пародонтите. Получение. Белый или сероватый порошок, растворим в воде. ПОДЛИННОСТЬ:
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: Нейтрализация НСl. ПРИМЕНЕНИЕ: Противовоспалительное, жаропонижающее, при ревматоидных артритах, 0,025, амп. 2,5% р-р, вольтарен-ретард 0,1. КИСЛОТА МЕФЕНАМИНОВАЯ Acidum mephenaminicum Кристаллический порошок серовато-белого цвета, без запаха, горького вкуса. Практически нерастворим в воде, плохо растворим в спирте. Получение. Препарат получают конденсацией о-хлорбензойной кислоты с ксилидином в присутствии в качестве катализатора порошка меди. Подлинность. Количественное определение. Форма выпуска. Таблетки 0,5 г, суспензия. Применение. Противовоспалительное, обезболивающее средство. ГАЛОПЕРИДОЛ Haloperidolum Галоперидол является производным 4-фторбутирофенона. Это одна из новейших групп нейролептиков с очень сильным действием Получение. Синтез осуществляют по двум ниткам. Сначала по Фриделю-Крафтсу ацилируют фторбензол хлорангидридом γ-хлор-масляной кислоты с образованием 4-фтор- γ-хлорбутирофенона (А). Затем по схеме (В) из 4-хлорпропен-2-илбензола получают произ-водное 1,3-оксазина, которое далее в кислой среде трансформируют в 4-п-хлорфенил-1,2,5,6-тетрагидропиридин. Последний при обра-ботке бромистым водородом в уксусной кислоте превращается в 4-гидрокси-4-п-хлорфенилпиперидин (В). И, наконец, при взаимодей-ствии полупродуктов (А) и (В), получают галоперидол. Белый или желтоватый порошок, мало растворим в воде, растворим в спирте. ПОДЛИННОСТЬ: КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: ВЭЖХ ПРИМЕНЕНИЕ: 0,0015 и 0,005 табл., 0,2% капли, 0,5% инъекционный р-р для купирования приступов шизофренических психозов, при белой горячке. Видео:Реакция САЛИЦИЛОВОЙ КИСЛОТЫ и ХЛОРИДА ЖЕЛЕЗА. Качественная реакция. Опыты по химии. ЭкспериментыСкачать  Получение. Салициловую кислоту карбоксилированием фенолята натрия по реакции Кольбе-Шмидта:Салициловую кислоту карбоксилированием фенолята натрия по реакции Кольбе-Шмидта: Механизм реакции Кольбе-Шмидта заключается в электрофильной атаке диоксидом углерода бензольного ядра. Фенольный гидроксил ориентирует заместитель в орто- и пара- положение. Но присутствие катиона натрия Na + позволяет получать преимущественно орто- оксибензойную (салициловую) кислоту, с ионом К + получается смесь о- и п- оксибензойных кислот. Внутримолекулярная перегруппировка основана на том, что СООН – вытесняет фенолы из их солей, как более сильная кислота. Образовавшийся салицилат натрия подкисляют НCl и выделившуюся салициловую кислоту перекристаллизовывают. Как побочный продукт может образовываться оксидифенил – примесь способа получения Натрия салицилат получают, нейтрализуя салициловую кислоту натрия гидрокарбонатом: 💥 ВидеоКИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Проклятая химическая реакция 😜 #shortsСкачать  Получение салициловой кислоты гидролизом ацетилсалициловой кислоты.Скачать  Выделение салициловой кислоты из аспирина (synthesis of salicylic acid from aspirin)Скачать  Реакция салициловой кислоты с гидрокарбонатом натрияСкачать  Как получить салициловую кислоту дома без дополнительных химикатов из аспирина.Скачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Качественная Реакция На Салициловую И Уксусную КислотуСкачать  Как салициловая кислота убивает клеща DemodexСкачать  Получение салициловой кислоты в домашних условияхСкачать  Аспирин для растений БЕСПОЛЕЗЕН. Салициловая кислота для обработки растений.Скачать  Салициловая кислота раствор инструкция по применению препарата: Показания, как применять, от прыщейСкачать  ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Получение угольной пены - Реакция сахара и серной кислоты!Скачать  А ты знала о таком свойстве салициловой кислоты?Скачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Определение присутствия салициловой кислоты в свежезамороженной малине и малиновом вареньеСкачать  |