Получение пластической серы
Сера – кристаллическое вещество. В кристаллах молекулы всегда расположены в строгом порядке. Сера, измельченная в порошок, сохраняет кристаллическую структуру. Нагреем порошок серы. Сера плавится при температуре 120 градусов и становится легко подвижной желтой жидкостью. При дальнейшем повышении температуры сера начинает темнеть, превращается в темно-бурую, вязкую жидкость – пластическую серу. При быстром охлаждении в воде сера сохраняет пластические свойства. Пластическая сера с течением времени кристаллизуется и твердеет.
Оборудование: пробирка, штатив для пробирок, шпатель, химический стакан, спиртовка, держатель для пробирок.
Техника безопасности . Соблюдать правила обращения с нагревательными приборами. Не допускать попадания расплавленной серы на поверхность стола. При возгорании серы тушить пламя речным песком.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Видео:Получение пластической серыСкачать

Получение пластической серы уравнение реакции
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Получение пластической серы
По своей структуре сера является кристаллическим веществом при нормальной температуре и давлении. Это обусловлено тем, что кристаллы серы имеют кристаллическую решетку, что обуславливает стабильность структуры кристаллов даже при измельчении в порошок.
Плавление серы – это получение пластической серы. Суть эксперимента в том, что порошок серы нагревается в пробирке до 120 градусов по Цельсию.
Нагретая до такой температуры сера переходит в жидкое состояние – упорядоченная кристаллическая решетка разрушается. Дальнейшее нагревание превращает серу в вязкую жидкость бурого цвета. Это пластическая сера. Если такую серу быстро охладить в воде, то она сохранит свои пластические свойства.
Видео:Получение пластической серыСкачать

Сера (S)
Соединения серы:
Точное время открытия человеком серы неизвестно — данное вещество было известно человеку еще с доисторических времен. Природная сера является светло-желтым порошкообразным веществом, массовая доля серы в земной коре составляет 0,03%.
В природе сера встречается, как в виде самородков, так и в виде разнообразных соединений: сульфидов (FeS2; FeCuS2) и сульфатов (BaSO4), входящих в состав разнообразных минералов (пирит, медный колчедан, гипс, барит). Также сера в виде соединений присутствует в природных углеводородах: нефте, газе, угле.
Сера является биогенным элементом — в организме человека массовая доля серы составляет 0,16%, сера входит в состав белков, аминокислот, гормонов.
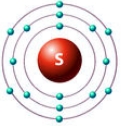
Атом серы содержит 16 электронов, при этом у серы, как и у атома кислорода, на внешнем энергетическом уровне находится 6 валентных электронов (см. Электронная структура атомов).
В отличие от кислорода, атом серы способен образовывать не только 2 (H2S) ковалентные связи, но и 4 (H2SO3) или 6 (H2SO4) (см. Ковалентная связь). Данное свойство объясняется наличием у атома серы свободного d-подуровня, на который могут переходить 1 или 2 электрона с s- или р-подуровня (см. Атомы 16(VIa) группы).
Видео:Получение пластической серыСкачать

Сера, как простое вещество
Молекула S2 имеет строение, аналогичное O2.
В отличие от кислорода, сера может образовывать зигзазообразные цепи, но наиболее устойчивыми являются циклические молекулы серы, имеющие форму короны, в которую входят 8 атомов (S8) — α-сера. «Короны» с меньшим числом атомов менее устойчивы. Кроме этого, молекулы серы могут образовывать открытые цепи (S∞).
В ромбической модификации S8 — 8 атомов серы соединены между собой одинарными ковалентными связями — это твердые кристаллы желтого цвета, нерастворимые в воде, но хорошо растворяющиеся в органических растворителях, например, в сероуглероде.
Сера при высоких температурах может существовать в газообразном состоянии:
Видео:Соединения серы. 9 класс.Скачать

Химические свойства серы
Сера является типичным активным неметаллом.
В воде сера практически не растворяется (даже не смачивается водой), а в органических растворителях сера растворяется хорошо.
При взаимодействии с другими веществами сера может выступать, как в роли окислителя, так и в роли восстановителя, в зависимости от окислительно-восстановительных свойств веществ, с которыми сера вступает в реакцию:
- окислителем сера является в реакциях с простыми веществами-восстановителями, имеющими меньшую электроотрицательность, чем сера — это водород, металлы, некоторые неметаллы:
- восстановителем сера является в реакциях с кислородом, галогенами, кислотами-окислителями
Реакции, в которых сера является окислителем:
- с металлами сера реагирует при нагревании с образованием сульфидов:
- с водородом:
- с фосфором:
- с углеродом:
Реакции, в которых сера является восстановителем:
Взаимодействие серы со сложными веществами:
- реагирует, как восстановитель с кислотами-окислителями при нагревании:
- в реакциях диспропорционирования с растворами щелочей при нагревании сера выступает и окислителем, и восстановителем:
Видео:Опыты по химии. Особенности плавления серыСкачать

Аллотропные модификации серы
α-сера
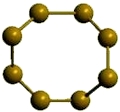
Рис. Ромбическая α-сера.
- кристаллическое вещество желтого цвета;
- устойчиво при комнатной температуре;
- состоит из циклических молекул S8.
- температура плавления = 112,8°C;
- плотность = 2,06 г/см 3 .
β-сера
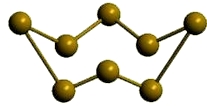
Рис. Моноклинная β-сера.
- темно-желтые кристаллы;
- устойчиво при температуре 95°C и выше;
- от альфа-серы отличается ориентацией кольцевых молекул в узлах кристаллической решетки;
- температура плавления = 119,3°C;
- плотность = 1,957 г/см 3 .
Пластическая сера
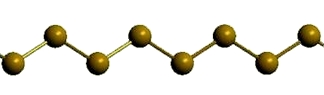
Рис. Пластическая сера.
- резиноподобное вещество темно-коричневого цвета;
- образуется при резком охлаждении расплавленной серы;
- состоит из открытых цепных полимерных молекул (S∞);
- плотность = 2,046 г/см 3 .
Видео:Сера: химические свойства, аллотропия и её соединения #сера #химшкола #неметаллы #егэхимияСкачать

Получение и применение серы
Способы получения серы:
- промышленным способом получения серы является очищение самородной серы от примесей расплавлением перегретым водяным паром;
- окислением сероводорода кислородом: 2H2S + O2 = 2S + 2H2O;
- восстановлением оксида серы (IV) углеродом: SO2 + C = S + CO2;
- разложением пирита (FeS2): FeS2 = S + FeS;
- разложением сероводорода: H2S = H2 + S.
Применение серы:
- как ингредиент для получения серной кислоты;
- в качестве инсектицида;
- для вулканизации каучука;
- в производстве пороха, спичек, лекарственных препаратов, красителей.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
🎥 Видео
Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Получение пластической серыСкачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Получение пластической серы.Скачать

получение пластической серы .aviСкачать

029. Получение пластической серы.wmvСкачать

СЕРА | Химия 9 классСкачать

Решение цепочек превращений по химииСкачать

Химия 9 класс (Урок№12 - Оксид серы (IV). Сернистая кислота и ее соли.)Скачать

Сера - Самый ВОНЮЧИЙ Элемент на ЗЕМЛЕ!Скачать

Сероводород и сульфиды. 11 класс.Скачать

Химия Просто! Что будет, если Модифицировать Картошку? Аллотропные модификации в химииСкачать

029 Получение пластической серыСкачать

Хлопушка дьявола - реакция серы и цинка!Скачать