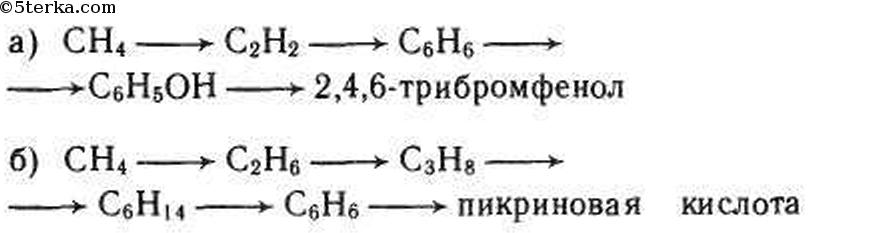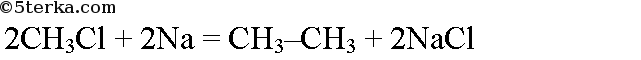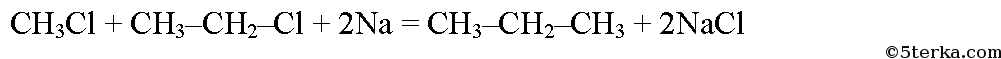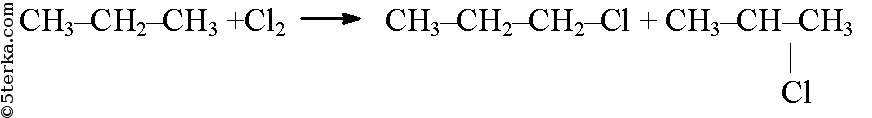а) Из метана при нагревании можно получит ацетилен:
В присутствии катализатора ацетилен превращается в бензол (реакция тримеризации):
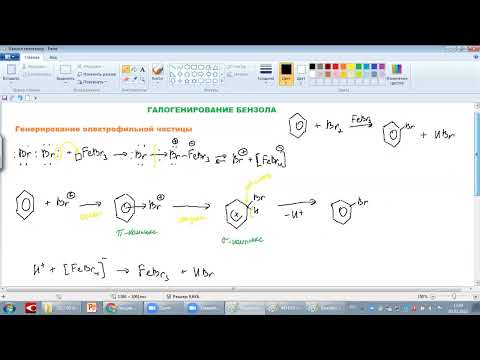
Фенол из бензола можно получить в две стадии. Бензол реагирует с хлором в присутствии хлорида железа, при этом образуется хлорбензол:
При действии на хлорбензол щелочи при высокой температуре происхо дит замещение атома хлора на гидроксильную группу и получается фенол:
При действии на фенол брома образуется 2,4,6-трибромфенол:
б) Этан из метана можно получить в две стации. При хлорировании метана образуется хлорметан. При хлорировании метана на свету образуется хлорметан:
При взаимодействии хлорметана с натрием образуется этан (реакция Вюрца):
Пропан из этана также можно получить в две стадии. При хлорировании этана образуется хлорэтан:
При реакции хлорэтана с хлорметаном в присутствии натрия образуется пропан:
Из пропана в две стадии можно получить гексан. При хлорировании пропана образуется смесь изомеров — 1-хлорпропана и 2-хлорпропана. Изомеры имеют разные температуры кипения и их можно разделить перегонкой.
При взаимодействии 1-хлорпропана с натрием образуется гексан:
При дегидрировании гексана над катализатором образуется бензол:
Из бензола можно в три стадии получить пикриновую кислоту (2,4,6-тринитрофенол). При реакции бензола с хлором в присутствии хлорида железа образуется хлорбензол:
При действии на хлорбензол щелочи при высокой температуре происхо
дит замещение атома хлора на гидроксильную группу и получается фенол:
При реакции фенола со смесью азотной и серной кислот образуется пикриновая кислота (2,4,6-тринитрофенол):

задача №7
к главе «Глава VII. Спирты и фенолы. §3 Фенолы(стр. 94) Вопросы».
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Структура, синтез, свойства и применение пикриновой кислоты
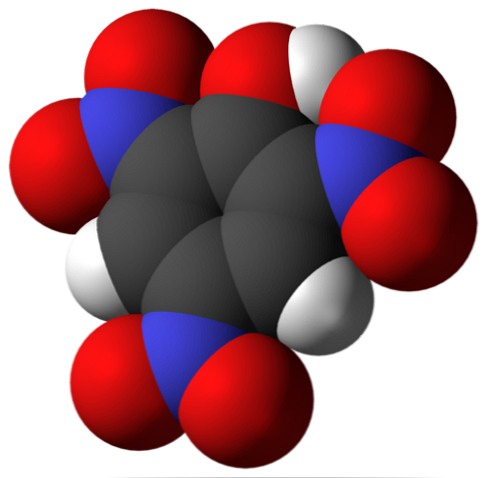
пикриновая кислота является сильно нитрированным органическим химическим соединением, название которого IUPAC — 2,4,6-тринитрофенол. Молекулярная формула C6H2(NO2)3ОН. Это очень кислый фенол, и его можно найти в виде пикрата натрия, аммония или калия; то есть в его ионной форме С6H2(NO2)3ONa.
Это твердое вещество с сильным горьким вкусом, и отсюда его название происходит от греческого слова «prikos», что означает «горький». Это найдено как влажные желтые кристаллы. Его сушка или обезвоживание опасны, так как они увеличивают нестабильные свойства, которые делают его взрывоопасным..
Выше находится молекула пикриновой кислоты. На изображении трудно распознать связи и атомы, потому что это соответствует представлению его поверхности Ван-дер-Ваальса. Молекулярная структура более подробно обсуждается в следующем разделе..
Некоторые промежуточные соединения, различные пикратные соли и комплексы пикриновой кислоты синтезируются из пикриновой кислоты..
Пикриновая кислота используется в качестве основы для синтеза перманентных красителей желтого цвета. Некоторые патологи и исследователи используют его для фиксации или окрашивания срезов тканей и других иммуногистохимических процессов..
Это очень полезно при приготовлении фармацевтических продуктов. Кроме того, он используется при изготовлении спичек или спичек и взрывчатых веществ. Он также используется для гравировки металлов, для изготовления цветного стекла и для колориметрического определения биологических параметров, таких как креатинин..
С другой стороны, пикриновая кислота раздражает, когда она вступает в контакт с кожей, слизистой дыхательных путей, глаз и пищеварительной системы. В дополнение к повреждению кожи, это может серьезно повлиять на почки, кровь и печень, среди других органов.
- 1 структура
- 1.1 Кислотный фенол
- 1.2 Кристаллическая структура
- 2 Резюме
- 2.1 Прямое нитрование фенола
- 3 Физические и химические свойства
- 3.1 Молекулярный вес
- 3.2 Внешний вид
- 3.3 Запах
- 3.4 Вкус
- 3.5 Точка плавления
- 3.6 Точка кипения
- 3.7 Плотность
- 3.8 Растворимость
- 3.9 Коррозионная активность
- 3,10 пКа
- 3.11 Нестабильность
- 4 использования
- 4.1 Исследования
- 4.2 Органическая химия
- 4.3 В промышленности
- 4.4 Военные применения
- 5 Токсичность
- 6 Ссылки
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

структура
На верхнем изображении все связи и сама структура молекулы пикриновой кислоты показаны более подробно. Состоит из фенола с тремя нитрозаместителями.
Видно, что в NO группах2 атом азота имеет положительный частичный заряд, и поэтому требуется электронная плотность его окружения. Но, ароматическое кольцо также притягивает электроны к себе, и до трех NO2 в конечном итоге он отказывается от части своей электронной плотности.
Как следствие этого, кислород группы ОН имеет тенденцию в большей степени разделять одну из своих свободных электронных пар, чтобы обеспечить дефицит электроники, испытываемый кольцом; и при этом формируется ссылка C = O + -H. Эта частичная частичная нагрузка на кислород ослабляет связь O-H и повышает кислотность; то есть он будет выделяться в виде иона водорода, H + .
Кислотный фенол
Именно по этой причине это соединение является исключительно сильной (и реакционноспособной) кислотой, даже больше, чем сама уксусная кислота. Однако соединение действительно представляет собой фенол, кислотность которого превосходит кислотность других фенолов; благодаря, как только что упомянуто, заместителям NO2.
Следовательно, поскольку это фенол, группа ОН имеет приоритет и управляет подсчетом в структуре. Три НЕТ2 они расположены в атомах углерода 2, 4 и 6 ароматического кольца относительно ОН. Отсюда номенклатура IUPAC для этого соединения: 2,4,6-тринитрофенол (TNP, для его сокращения на английском языке).
Если бы группы не были2, или если бы их было меньше в кольце, связь О-Н ослабла бы меньше, и, следовательно, соединение имело бы более низкую кислотность.
Кристаллическая структура
Молекулы пикриновой кислоты расположены таким образом, чтобы способствовать их межмолекулярным взаимодействиям; либо для образования водородных мостиков между группами ОН и NO2, диполь-дипольные силы или электростатические отталкивания между дефектными областями электронов.
Можно ожидать, что группы НЕ2 они отталкиваются друг от друга и будут ориентированы на соседние ароматические кольца. Кроме того, кольца не могли быть совмещены друг с другом из-за увеличения электростатических отталкиваний.
Продукт всех этих взаимодействий — пикриновая кислота — образует трехмерную сеть, которая определяет кристалл; элементарная ячейка которой соответствует кристаллической системе орторомбического типа.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

синтез
Первоначально он был синтезирован из природных соединений, таких как производные рога животных, природные смолы и другие. С 1841 года фенол используется в качестве предшественника пикриновой кислоты по нескольким направлениям или с помощью различных химических процедур..
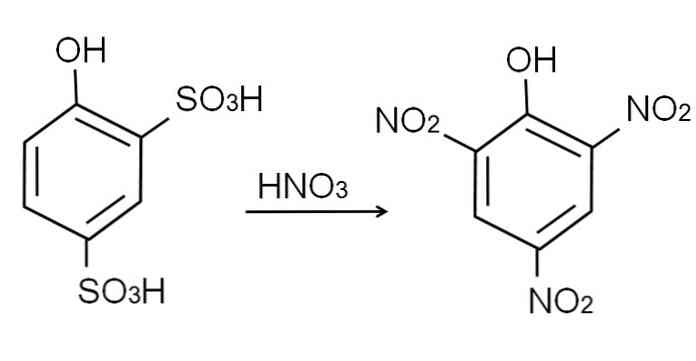
Как уже говорилось, это один из самых кислых фенолов. Для его синтеза сначала требуется, чтобы фенол прошел процесс сульфирования, а затем процедуру нитрования..
Сульфонирование безводного фенола проводят обработкой фенола дымящей серной кислотой с ароматическими электрофильными заменами H сульфонатными группами SO3H, в положении -ort и для группы OH.
Для этого продукта, 2,4-фенолдисульфоновой кислоты, проводят процесс нитрования, обрабатывая его концентрированной азотной кислотой. При этом две группы SO3H замещены нитрогруппами, NO2, и третий входит в другую нитро позицию. Следующее химическое уравнение иллюстрирует это:
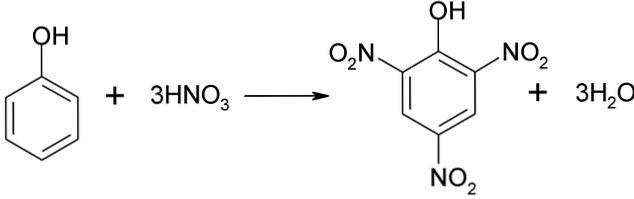
Прямое нитрование фенола
Процесс нитрования фенола не может быть осуществлен напрямую, так как образуются высокомолекулярные гудроны. Этот метод синтеза требует очень тщательного контроля температуры, поскольку он очень экзотермический:
Пикриновая кислота может быть получена путем проведения процесса прямого нитрования 2,4-динитрофенола азотной кислотой.
Другой формой синтеза является обработка бензола азотной кислотой и нитратом ртути..
Видео:Получение БЕНЗОЛА!Скачать

Физико-химические свойства
Молекулярный вес
Внешний вид
Массовая или желтая суспензия влажных кристаллов.
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Напишите уравнения реакций получения пикриновой кислоты из бензола
Напишите уравнения реакций получения пикриновой кислоты из бензола
- Ruslan Pushhenko
- Химия 2019-03-05 20:32:57 24 1
При деянии на хлорбензол щелочи при высочайшей температуре происходит замещение атома хлора на гидроксильную группу и получается оксибензол.
При реакции оксибензола со консистенцией азотной и серной кислот появляется пикриновая кислота (2,4,6-тринитрофенол).
Означает, процесс проводится в несколько стадий :
1. Хлорирование бензола до монохлорбензола:
C6H6 + Cl2 = C6H5Cl + HCl
2. Нитрования монохлорбензола до динитрохлорбензола консистенцией серной и азотной кислот:
C6H5Cl + 2HNO3 = C6H3(NO2)2Cl +2H2O
3. Обработка динитрохлорбензола каустической содой (гидроокисью натрия) с получением динитрофенолята натрия:
C6H3(NO2)2Cl + 2NaOH = C6H3(NO2)2ONa + NaCl + H2O
4. Омыление динитрофенолята натрия серной кислотой с получением динитрофенола:
2 C6H3(NO2)2ONa + H2SO4 = 2 C6H3(NO2)2OH + Na2SO4
5. Получение тринитрофенола (пикриновая кислота) обработкой смесью серной и азотной кислот:
C6H3(NO2)2OH + HNO3 = C6H3(NO2)3OH + H2O
📽️ Видео
Получение БЕНЗОЛАСкачать

6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

9.3. Фенол: Химические свойстваСкачать

Как получить ХЛОРБЕНЗОЛ, не используя БЕНЗОЛ!Скачать

Нитрование бензолаСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Реакция сульфонированияСкачать
Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Нитрование разных производных бензола. Химический опытСкачать

11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА, ФЕНОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать
Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

Бромирование БензолаСкачать