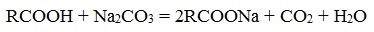С химической точки зрения мыла представляют собой соли высших жирных (C8–C18), нафтеновых или смоляных кислот.
В бытовом смысле — это технические продукты, обладающие моющим действием.
Видео:Сложные эфиры и мыла. 1 часть. 11 класс.Скачать

Классификация мыла
Существует несколько классификаций мыл.
По растворимости мыла делят на:
- Растворимые щелочные мыла — калиевые, натриевые, аммониевые соли жирных кислот. В зависимости от природы катиона мыла растворимость в воде увеличивается в ряду: Li + — Na + — K + — NH4 +
- нерастворимые металлические мыла — соли поливалентных металлов (Ca, Mg, Ni, Mn, Al, Co, Pb).
По консистенции:
- Жидкие мыла – соли калия, аммония
- Твердые мыла – соли натрия, лития, поливалентных металлов
По назначению:
По способу получения:
Видео:Галилео 🧼 Как мыло из жира смывает жир?Скачать

Химические способы получения мыла
Производство мыла (мыловарение) довольно длительный и сложный процесс, состоящий из нескольких стадий.
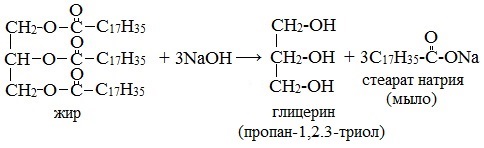
Если рассматривать только химические реакции, лежащие в основе получения мыла, то как уже было рассмотрено мыла можно получить при щелочном гидролизе жиров, при этом образуются глицерин и соли высших карбоновых кислот – мыла. Кроме этого мыла получаются при нейтрализации высших карбоновых кислот гидроксидом натрия или калия или углекислым натрием:
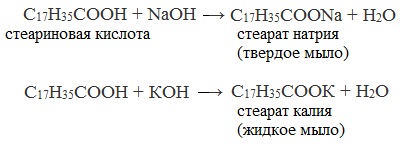
- Омыление триглицеридов гидроксидами натрия или калия
- Нейтрализация высших карбоновых кислот гидроксидом натрия (каустической содой) или гидроксидом калия
Твердые мыла получают при растворении высших карбоновых кислот в водном растворе гидроксида натрия, жидкие мыла — при растворении высших карбоновых кислот в водном растворе гидроксида калия.
- Нейтрализация высших карбоновых кислот углекислым натрием (кальцинированной содой):
Видео:Опыты по химии. Омыление жировСкачать

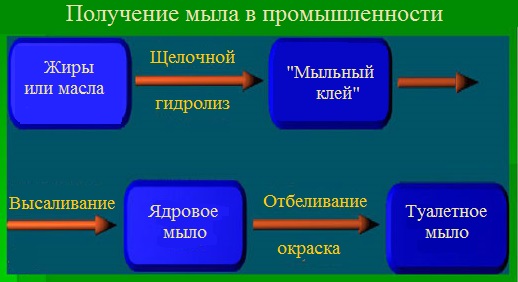
Промышленное получение мыла (варка мыла)
Для производства мыла в промышленности используют как синтетические жирные (высшие) кислоты, так и животные жиры, растительные масла, канифоль.
Для получения хозяйственных мыл применяют саломас с температурой плавления 46–60°С, для туалетного мыла — с температурой плавления 39–43°С.
Салома́с — это твёрдый жир, получаемый в промышленности путём гидрогенизации жидких жиров, в основном растительных масел.
Все жиры, используемые при варке мыла, не должны содержать воду и механические примеси.
Жидкие растительные масла применяют в мыловарении всех видов жидких хозяйственных и туалетных мыл. Наиболее ценным из является хлопковое масло, содержащее до 30 % насыщенных высших кислот, в основном пальмитиновой. Также используют и другие масла, такие как подсолнечное, соевое, кокосовое, пальмовое.
Введение небольших количеств жидких растительных масел в рецептуру хозяйственных мыл способствует снижению температуры их застывания.
Внесение 10–15 % канифоли увеличивает растворимость и пластичность мыла.
Основные стадии варки мыла
В промышленности мыла получают в две стадии – первая стадия химическая, вторая — механическая:
- Химическая стадия – варка мыла. Вначале проводят карбонатное омыление, при котором нейтрализуется около 70 % свободных жирных кислот. Затем проводят каустическое доомыление – нейтрализация оставшихся кислот гидроксидом натрия.
- Механическая стадия – охлаждение, сушка, шлифовка, отделка и упаковка готового продукта
Способы варки мыла
Варку мыла (химическая стадия) можно осуществить прямым и косвенным способом.
Для варки мыла прямым способом исходная жировая смесь должна быть хорошо очищена. Этим способом проводят нейтрализацию жировой смеси растворами содопродуктов и получают мыльный клей, содержащий 67–70 % жирных кислот. Далее его подвергают механической очистке — охлаждению, сушке, шлифовке, отделке. Прямой способ используется при варке хозяйственного мыла.
При варке мыла косвенным способом полученный прямым способом мыльный клей, подвергают дальнейшей обработке растворами электролитов, т.е. проводят высаливание. При этом происходит разделение мыльной массы на фазы: ядро и подмыльный щелок или ядро, подмыльный клей, подмыльный щелок. Полученное мыльное ядро в этом случае содержит 60–63 % жирных кислот. Далее полученное мыльное ядро обрабатывают подобно мылу, сваренному прямым способом. В качестве электролитов используют NaCl, NaOH. Косвенный способ применим для варки мыла из неочищенного жирового сырья. Варка мыла косвенным способом позволяет получить мыло высокой степени чистоты.
Жидкое мыло готовят из растительных масел, канифоли, таллового масли и др. прямым или косвенным способом. В качестве основания применяют соединения калия (KOH, K2CO3).
Если при варке мыла использовалось сырье из животных или растительных жиров, то после отделения ядра выделяют образующийся побочный продукт – глицерин. Глицерин широко применяют в различных отраслях производства.
Кратко схему производства мыла можно представить следующим образом:
Видео:Опыты по химии. Растворимость жировСкачать

Моющие свойства мыла
Итак, мыла – соли высших жирных кислот – состоят из аниона жирной кислоты и катиона металла (чаще всего натрия или калия).
В водных растворах щелочные мыла подвергаются гидролизу, т.к. образованы слабыми кислотами и сильными основаниями. Их растворы имеют щелочную реакцию (рН>7). В сильно разбавленных растворах мыла полностью диссоциируют на ионы:
Способность мыла пениться, отмывать загрязнения связана с образованием мицелл и высокой поверхностной активности. Водорастворимые щелочные мыла являются анионными поверхностно-активными веществами.
Углеводородный остаток жирной кислоты является гидрофобной частью мыла, кабоксильный ион – гидрофильной частью.
Этапы растворения грязи под действием мыла:
- При соприкосновении мыла с грязью, гидрофобная часть мыла окружает гидрофобное загрязняющее вещество и проникает внутрь, а поверхность загрязнения покрывается оболочкой гидрофильных групп.
- Гидрофильная часть мыла взаимодействуют с полярными молекулами воды.
- Ионы мыла «захватывают» загрязнение и отрываются от поверхности, переходя в воду.
- Плавающие частицы удерживаются в растворе до его смены.
В домашних условиях тоже можно приготовить мыло. Имея под рукой необходимые ингредиенты, самостоятельное производство мыла не составит большого труда.
Видео:Мыла и синтетические моющие средства. 9 класс.Скачать

Получение мыла из жиров уравнение реакции
Известно несколько способов получения мыл.
- Нейтрализация кислот углекислым натрием (кальцинированной содой)
- Нейтрализация кислот гидроксидом натрия (каустической содой)
Жидкие калиевые мыла и твердые натриевые мыла получают растворением высших алифатических кислот в водных растворах едких щелочей:
- Омыление триглицеридов гидроксидом натрия
Получение мыла основано на реакции омыления — кипячением животного сала либо растительного масла с гидроксидом натрия или калия (гидролиз сложных эфиров жирных кислот (т.е. жиров) в присутствии щелочей), в результате которого образуется трехатомный спирт глицерин и соли высших карбоновых кислот (мыло):
Прямой способ. В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щёлочью (обычно гидроксидом натрия). Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи.
В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея обычно 40—60 %. Такой продукт имеет название «клеевого мыла».
Косвенный способ заключается в дальнейшей обработке мыльного клея.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром.
Он содержит не менее 60 % жирных кислот; нижний слой — подмыльный щёлок, раствор электролита с большим содержанием глицерина. (также содержит загрязняющие компоненты, содержавшиеся в исходном сырье).
Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Для улучшения некоторых характеристик хозяйственного мыла, а также для удешевления в него вводят наполнители: некоторые натриевые соли, которые при растворении в воде приводят к подщелачиванию; клеи и крахмал – способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Сапонин применяют для дорогих сортов мыла.
При использовании в качестве щёлочи каустической соды получают твердое натриевое мыло. Мягкое или даже жидкое калиевое мыло образуется, когда применяется каустический поташ.
Главное условие красящих веществ, употребляемых для подкраски туалетного мыла, — это хорошее смешивание их с мылом и отсутствие вредного влияния на кожу.
Красный цвет для прозрачного мыла получают при помощи фуксина и эозина, для непрозрачного мыла используют киноварь и сурик. Желтый цвет мылу придает экстракт куркумы и пикриновая кислота. Для получения мыла зеленого цвета применяют зеленый анилин или хромовую зеленую краску. Коричневый цвет мыла образуется из светлой или темной коричневой анилиновой краски или жженого сахара.
В промышленности вместо щелочи применяют соду, а так как жиры являются одной из главных составляющих пищи человека, то за основу берут не животные жиры, а углеводороды, входящие в состав парафинов (нефти).
Мыла полученные из синтетических кислот аналогичны по своей химической природе обычным мылам.
Видео:Опыты по химии. Сравнение свойств мыла и синтетических моющих средств: мыло и СМС в жесткой водеСкачать

Урок по теме «Мыло»
Цель: сформировать знания о составе и моющем действии мыла, познакомить учащихся с историей мыла как необходимого компонента быта, расширить кругозор учащихся.
Оборудование и реактивы: мягкая вода, вода, содержащая ионы кальция и магния (жесткая вода), раствор мыла, раствор синтетического моющего средства, образцы твердого и жидкого мыла, жидкость “Мыльные пузыри”. Презентация (приложение 1).
План урока.
- История мыла.
- Мыло с химической точки зрения.
- Получение мыла.
- Механизм моющего действия мыла.
- Мыльные пузыри.
- Мыло в природе.
- Перспективы применения мыла.
1. История мыла.
Споры о том, кому человечество обязано изобретением мыла, до сих пор не завершены, впрочем, честь спасения человечества от грязи приписывается сразу нескольким древним народам.
По имеющимся данным, мыло изготавливалось еще в древнем Шумере и Вавилоне около 2800г. до н.э. Описания технологии изготовления мыла найдены в Месопотамии на глиняных табличках, относящихся примерно к 2200 г. до н.э. Египетские археологи после раскопок в дельте Нила пришли к выводу, что производство мыла было налажено, по меньшей мере, 6000 лет назад. Египетский папирус середины второго тысячелетия до н.э. свидетельствует, что египтяне регулярно мылись с помощью мыла.
Римский ученый и политик Плиний Старший утверждает, что еще древние галлы (населявшие территорию современной Франции) и германцы знали о приготовлении мыла. По его свидетельству, эти дикие племена делали из сала и золы букового дерева некую чудодейственную мазь, которую использовали для очистки и окрашивания волос, а также для лечения кожных заболеваний.
Так же существует версия, что мыло было изготовлено римлянами. Легенда гласит, что само слово soap (мыло) произошло от названия горы Сапо в древнем Риме, где совершались жертвоприношения богам. Смесь из растопленного животного жира и древесной золы жертвенного костра смывало дождем в глинистый грунт берега реки Тибр. Женщины, стиравшие там белье, обратили внимание, что благодаря этой смеси одежда отстирывается значительно лучше. Люди постепенно стали использовать «дар богов» не только для стирки одежды, но и для мытья тела. Кстати, первые мыловарни тоже были обнаружены археологами на территории Древнего Рима, а еще точнее — среди развалин знаменитых Помпей.
От римского слова sapo позднее у англичан образовалось soap, у французов — savon, у итальянцев — sapone.
Мыло не сразу стало предметом гигиены. Вплоть до XIII века оно стояло в одном ряду с медицинскими средствами и лекарствами. Не была чистота в чести и в средние века. Мылом пользовались только представители первых двух сословий — дворяне и священники, да и то не все поголовно. Окончательно моду на чистоту привили средневековой Европе рыцари, побывавшие во время крестовых походов в арабских странах. Вероятно, арабы в VII в. н.э. узнали способ изготовления твердого мыла. От арабов искусство мыловарения проникло в Испанию. Здесь научились делать твердое красивое мыло из оливкового масла и золы морских растений. Повсюду на Средиземноморье, где выращивали масличные растения, стало процветать мыловарение.
С XIII в. начинается расцвет мыловарения во Франции и Англии. Отношение к этому ремеслу было самое серьезное. В 1399 г. в Англии король Генрих IV основал орден, особой привилегией которого считалось: мытье в бане с мылом.
Известно, что в XV и XVI вв. рыцари и купцы привозили пахнущие шарики из Венеции. На них были вытиснены лилии, еловые шишки, полумесяцы — первые, если можно так сказать, торговые знаки.
На Руси секреты изготовления мыла унаследовали от Византии, а собственные мастера-мыловары появились у нас только в XV в. Известно, что некто Гаврила Ондреев завел в Твери «поварню мыльную с котлом мыльным и со всею поряднею», а в Москве существовал даже мыльный ряд. Промышленное производство мыла было налажено при Петре I, но вплоть до середины XIX в. им пользовалась только знать. Крестьяне же стирали и мылись щелоком — смесью получаемой из древесной золы, залитой кипятком и распаренной в печи. Главным центром мыловарения был город Шуя, на его гербе даже изображен кусок мыла.
2. Что же такое мыло?
Еще в 1808 году французский химик Мишель Эжен Шеврёль(1786 – 1889) установил состав мыла. В результате анализа оказалось, что мыло – это натриевая соль высшей жирной карбоновой кислоты. Причем, жидкое и твердое мыло различаются только катионами: одним из вариантов твердого мыла является С17Н35СООNa, жидкого – С17Н35СООК.
3. Получение мыла.
Получение мыла всегда было основано на реакции омыления – гидролиза сложных эфиров высших карбоновых кислот и глицерина (т.е. жиров) со щёлочами, в результате которого образуется трехатомный спирт глицерин и соли высших карбоновых кислот (мыло). Уравнение реакции выглядит следующим образом:
Мыло приготавливают кипячением в воде жирных масел со щелочами, такими, как каустическая сода или каустический поташ. Жирные масла извлекают из растительных продуктов, например хлопкового, пальмового и соевого масел, животных продуктов, таких, как животное сало и рыбий жир, и продуктов переработки орехов, в частности, кокосового масла. Очищенные жиры подвергаются гидролизу в присутствии щелочей под давлением 5 МПа и при температуре 240-260 градусов. При этом образуется мыло, жирные кислоты и глицерин. Глицерин отводят из реактора, а оставшуюся смесь обрабатывают избытком щелочи. Чистое мыло из мыловаренного котла переливается в смеситель, где в него вводятся отдушки, красители и другие компоненты. Потом оно заливается в формы, вмещающие по 410 кг мыла, и оставляется в них на несколько суток для охлаждения и затвердевания. Боковые стенки форм удаляются, масса подравнивается, разрезается на бруски, которые сушатся и подвергаются штамповке на отдельные куски, помещаемые в упаковку. Иногда мыло подвергают дополнительной обработке для улучшения товарного вида (например, мраморированию).
4. Механизм моющего действия мыла.
Мыло известно уже тысячи лет, но только относительно недавно химики поняли, почему оно обладает моющими свойствами. Мыло состоит из двух частей: гидрофобной (органического радикала) и гидрофильной (растворимой в воде). Для моющего действия важно то, что углеводородная часть отрицательного иона нерастворима в воде, но она растворима в жирах и маслах, а ведь именно благодаря жиру грязь прилипает к вещам; и если поверхность полностью очищена от жира, грязь не задерживается на ней. Как показано на рисунке, отрицательные ионы (анионы) мыла склонны концентрироваться на поверхности раздела воды и жира. Водорастворимый отрицательно заряженный конец остается в воде, тогда как углеводородная часть погружена в жир. Чтобы поверхность раздела была наибольшей, жир должен присутствовать в виде мельчайших капелек. В результате образуется эмульсия – взвесь капелек жира (масла) в воде.
Если на твердой поверхности имеется пленка жира, то при контакте с водой, содержащей мыло, жир покидает поверхность и переходит в воду в виде мельчайших капель. Анионы мыла находятся одним концом в воде, а другим – в жире. Грязь, удерживаемая пленкой жира, удаляется при полоскании.
У мыла есть серьезный недостаток – оно теряет свое мылящее действие в жесткой воде. Проведем эксперимент. Возьмем два стакана. В одном вода мягкая, не содержащая солей магния и кальция, а в другом – жесткая. Прильем раствор мыла в оба стакана. В одном из них (с мягкой водой) наблюдается полное растворение, при бурном перемешивании – вспенивание раствора, а в стакане с жесткой водой мы наблюдаем выпадение хлопьевидного осадка. При бурном перемешивании становится заметно, что мыло потеряло свое мылящее действие. Это связано с тем, что в жесткой воде мыло образует кальциевые и магниевые соли высших карбоновых кислот, которые являются нерастворимыми:
Если после стирки мылом прополоскать ткань в жесткой воде, на ней осаждается нерастворимое и трудно удаляемое “кальциевое мыло”, которое портит ее вид. Поэтому в районах с жесткой водой в прачечных приходится устанавливать оборудование для умягчения воды.
5. Мыльные пузыри.
У мыла есть интересное свойство – оно может создавать мыльные пузыри. Мыльный пузырь – это тонкая пленка мыльной воды, которая формирует сферу с переливчатой поверхностью. Он существует лишь несколько секунд. Пленка пузыря состоит из тонкого слоя воды, заключенного между двумя слоями молекул мыла. Гидрофильная часть привлекается тонким слоем воды, в то время как гидрофобная выталкивается. В итоге образуются слои, защищающие воду от быстрого испарения и уменьшающие поверхностное натяжение.
Еще в XIX веке русский химик Г.С.Петров действием серной кислоты на продукты переработки нефти получил синтетические моющие средства, которые прекрасно мылятся в жесткой воде. Например, раствор стирального порошка прекрасно образует пену как в мягкой, так и в жесткой воде. Проверим это на опыте. Для этого прильем раствор СМС в стаканы с мягкой и с жесткой водой. Как мы видим, при энергичном перемешивании пена образуется в обоих стаканах. Но главным недостатком СМС является способность накапливаться в окружающей среде, т.к. сульфокислоты в отличие от карбоновых кислот не перерабатываются микроорганизмами и накапливаются в водоемах, что приводит к гибели водной флоры и фауны. А добавляемые к этим моющим средствам фосфаты провоцируют бурный рост водной растительности, что приводит к эвтрофикации (старению и заболачиванию) водоемов.
6. Мыло в природе.
Мыло можно найти и в природе. Многие растения обладают моющим действием. Это и мыльнянка(Saponaria), и смолёвка обыкновенная(Silene vulgaris), и грыжник голый (Caryophyllaceae), и солодка (Glycyrrhiza glabra), и бузина черная (Sambucus nigra) и многие другие. При растирании корней мыльнянки образуется пышная, долго не оседающая пена. Такая же пена образуется с помощью порошка корня солодки. А ягоды бузины, хоть и не образуют пены, прекрасно отмывают грязь.
7. Перспективы применения мыла.
Невзирая на возраст, мыло не спешит сдавать позиции. Сегодня у мыла появились терапевтические задачи: оно используется для лечения акне, снятия напряжения, как продукт ароматерапии и для борьбы со старением кожи. Эксперты полагают, что будущее – за мылом с эстетическими качествами, когда цвет, форма, аромат становятся важнейшими критериями выбора продукции. Но все равно главной функцией мыла остается гигиеническая.
📺 Видео
Жиры: строение и свойства | Химия ЕГЭ 10 класс | УмскулСкачать

Химия 10 класс (Урок№9 - Жиры. Моющие средства.)Скачать

КАК СВАРИТЬ МЫЛО?Скачать

Как делают мыло. Этапы производста мылаСкачать

Опыты по химии. Получение сложного эфираСкачать

Сложные эфиры и мыла. 2 часть. 11 класс.Скачать

Химические свойства жиров. Мыла. Урок 23. Химия 10 классСкачать

Выделение свободных жирных кислот из мылаСкачать

Опыты по химии. Отношение мыла и синтетических моющих средств к растворам сильных минеральных кислотСкачать

№ 119. Органическая химия. Тема 20. Жиры. Часть 7. Мыла и моющие средства. Получение мылаСкачать

Проект "Омыление жиров Получение мыла"Скачать

А34 ЦТ 2020. Мыла. Тесты по химииСкачать

Выделение свободных жирных кислот из мылаСкачать

Выделение жирных кислот из мылаСкачать