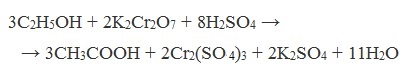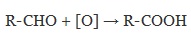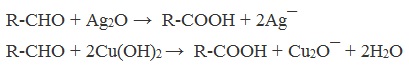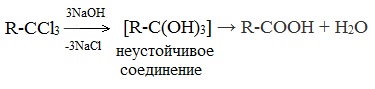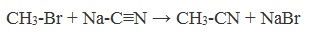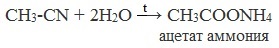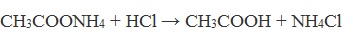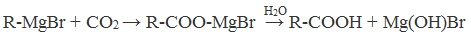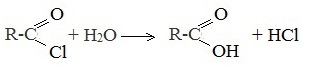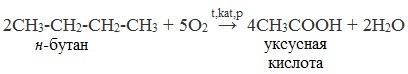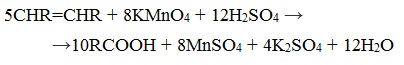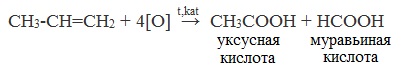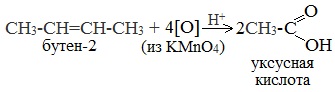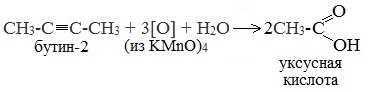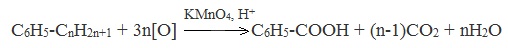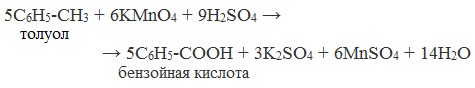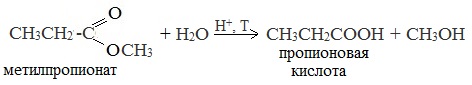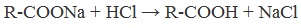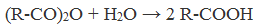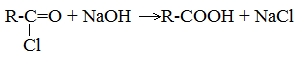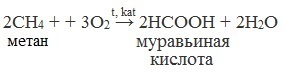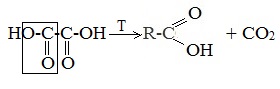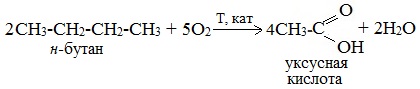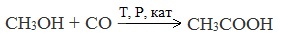лимонная молочная кислота уксус
Столовый уксус представляет собой слабый водный раствор уксусной кислоты, получаемый при окислении этанола уксуснокислыми бактериями или при разбавлении уксусной эссенции водой. Уксус используют при изготовлении майонезов, соусов, консервов, а также в качестве приправы.
Основное сырье для производства спиртового уксуса — спирт-сырец из зерна, картофеля или их смеси, ректификованный спирт I сорта. Для выработки фруктового уксуса используют сухие плодово-ягодные виноматериалы.
Ферментация осуществляется уксуснокислыми бактериями Acetobacter aceti.
Окисление этанола уксуснокислыми бактериями можно представить в виде суммарного уравнения
С2Н5ОН + O2 > СН3СООН + Н2O + 487 кДж.
Уксуснокислые бактерии — строгие аэробы, так как уксусная кислота образуется только в присутствии кислорода воздуха. Оптимальная температура для развития бактерий — около 30 оС. Бактерии могут развиваться в среде с рН около 3,0, оптимальными же значениями рН являются 5,4…6,3. Накапливающаяся при ферментации уксусная кислота угнетает клетки бактерий, в результате чего снижается скорость кислотообразования.
Содержание спирта в сбраживаемом сусле 6…10 o6. %. Повышенная концентрация спирта в среде затрудняет развитие уксуснокислых бактерий.
Уксуснокислые бактерии могут окислить уксусную кислоту с образованием диоксида углерода и воды. Этот процесс переокисления происходит, если окислен весь спирт, содержащийся в сбраживаемом сусле. Он приводит к снижению выхода уксусной кислоты. Для предотвращения переокисления ферментацию заканчивают при содержании 0,2. 0,3 об. % неокисленного спирта в сброженном сусле.
В питательной среде должны находиться сахара, минеральные соли, содержащие дзот, фосфор, серу, калий и магний.
Технологическая схема производства столового уксуса циркуляционным способом приведена на рис. 3.
Рис.3. Технологическая схема производства столового уксуса циркуляционным способом
Сусло для ферментации готовят из спирта, воды и добавок, обеспечивающих развитие бактерий. С этой целью в сусло вносят минеральные соли (сульфат аммония, диаммоннийфосфат, гидрофосфат калия, суперфосфат), сахара (техническая глюкоза, крахмальная патока, солодовое сусло).
Ферментацию проводят в генераторах-окислителях, изготовленных из дерева, керамики, нержавеющей стали и других кислотоустойчивых материалов.
Для увеличения площади поверхности окислительного взаимодействия в генератор вводят наполнитель — стружку из бука, граба, березы. Уксуснокислые бактерии закрепляются на поверхности стружек.
Стружку орошают подготовленным суслом, бактерии окисляют спирт в уксусную кислоту. Из сборника сусло с помощью насоса через теплообменник повторно перекачивают в ороситель. Оптимальная температура для интенсивного кислотообразования в верхней часта генератора 28…32 ?C, в нижней — 32. З6 ?С. Процесс ферментации продолжается 4…5 сут., накопление уксусной кислоты составляет 9. 10%. Высокая производительность генератора обеспечивается необходимой аэрацией среды. Полученный уксус сливают, оставляя в генераторе небольшое его количество, и начинают следующий цикл. В генератор-окислитель подают приготовленное сусло.
Подученный уксус осветляют, для этого его обрабатывают оклеивающими материалами (желатин, рыбий клей) и активным углем. Образующийся осадок отделяют фильтрованием.
Для улучшения вкуса и запаха уксус выдерживают в дубовых бочках.
Стандартную кислотность пищевого уксуса получают, разбавляя его водой до требуемой концентрации уксусной кислоты.
Готовый уксус пастеризуют для получения продукта, стойкого при хранении. Уксус разливают для розничной продажи в бутылки, а для использования в промышленности — в бочки и бутыли.
В зависимости от вида сырья и содержания уксусной кислоты получают пищевой спиртовой уксус 6, 9, 12%-й концентрации и фруктовый 6%-й.
Уксус должен быть прозрачным, без мути, осадка, слизи, посторонних включений. Запах и вкус соответствуют виду уксуса. Фруктовый уксус может иметь слабый запах исходного сырья без посторонних запахов и привкусов.
Наличие свободных минеральных кислот и солей тяжелых металлов в уксусе не допускается.
Уксус хранят в хорошо вентилируемых помещениях при температуре от 0 до 20 ?С и относительной влажности воздуха 75…80%. Срок хранения в бутылках: 6%-го — 6 мес., 9%-го и 12%-го — 12, фруктового — 3 мес.
Изобретение относится к усовершенствованному способу получения уксусной кислоты, которая широко используется в химической, текстильной и пищевой промышленности. Процесс парофазного окисления этилового спирта в уксусную кислоту кислородом воздуха на Sn-Mo-оксидном катализатора осуществляется с целью повышения концентрации уксусной кислоты в конденсаторе в реакторе, имеющем две рабочие зоны (двухреакторная система), и процесс ведут при оптимальных температурах в каждой зоне: в первой от 210 до 300 o C и во второй от 350 до 390 o C, молярном соотношении C2H5OH : H2O: воздух=1:(6,5-0,5):(11: 13) и объемной скорости процесса в интервале от 3849 до 5070 (1/час). 1 табл.
Изобретение относится к усовершенствованному способу получения уксусной кислоты, которая широко используется в химической, текстильной и пищевой промышленности.
Известен способ получения уксусной кислоты парофазным окислением этилового спирта на катализаторе MOaVb NbcXe, где X это ряд металлов: Li, Na Be, Mg, Ca, Sr, Ba, Zn, Cd, Hg, Sc, Y, La, Ce, Al, Ti, Zr, Hf, Pb, Ta, As, Bi, Cr, W, Te, Fe, Co и Ni, при этом a=0,5-0,9, b=0,1-0,4, c=0,001-0,2, d= 0,001-0,1 и e= 0,001-1,0 [1] Окисление 50%-ного этилового спирта ведут при температуре 200 400 o C, времени контакта от 0,1 до 10 с. Селективность процесса по уксусной кислоте составляет в среднем 60% при фактически полной конверсии (98% ) этилового спирта. Концентрация получаемой уксусной кислоты в конденсате достигает 20 25 мас.
Недостатками данного способа являются: ведение процесса при относительно высоких давлениях (до 75 атм.), присутствие разбавителей (N2 и He) в больших количествах в составе окислительной газовой смеси, что затрудняет выделение продуктов реакции.
Известен также способ получения уксусной кислоты окислением 20%-ного этилового спирта на Sn-Mo-оксидном катализаторе в паровой фазе в одну стадию при температуре 220 240 o C, объемной скорости 2070 (1/час), объемном соотношении C2H5OH:H2O:воздух: N2=1:10:6:5 [2] При полной конверсии этилового спирта выход уксусной кислоты составляет 60% Катализатор приготовлен по методике, изложенной в [3] Недостатки этого способа: применение азота для разбавления паровоздушной смеси спирт-воздух-вода, низкая концентрация получаемой уксусной кислоты в конденсате, которая составляет 10-11 мас.
Согласно предлагаемому нами способу процесс окисления этилового спирта кислодором воздуха проводят в реакторе проточного типа с двумя реакционными зонами (двухреакторная система) в присутствии Sn-Mo-оксидного катализатора. В каждой реакционной зоне процесс ведется при оптимальных температурах, зависящих от концентрации исходного спирта в первой от 210 до 300 o C и во второй от 350 до 390 o C и при молярном соотношении C2H5OH:H2 O:воздух=1:(6,5-0,5): (11-13). Дальнейшее увеличение воздуха приводит к существенному росту продуктов глубокого окисления, а уменьшение к падению степени превращения этилового спирта. Оптимальная объемная скорость процесса колеблется в интервале от 3849 до 5070 (1/час).
Проведение процесса в одну технологическую стадию в двухзонном реакторе позволяет, по сравнению с прототипом, получить конденсат, содержащий 35 48% уксусной кислоты при селективности по уксусной кислоте не ниже 60% и полной конверсии этилового спирта.
Осуществление процесса подробно описано на примере 1. Другие примеры представлены в таблице.
Пример 1. 4,2 мл 28,1%-ного водного раствора этилового спирта подается из калибровочной бюретки микронасосом МА-62 в верхнюю часть кварцевого испарителя, а в нижнюю часть поступает воздух, очищенный от примесей. Расход воздуха составляет 13,3 (л/час). Испарясь, пары спирта и воздуха в молярном соотношении C2H5OH:H2O: воздух=1:6,5:13 направляются в реактор N1.
Реактор N1 соединен последовательно с реактором N2 (две реакционные зоны), и оба представляют собой кварцевые трубки длиной по 10 см и диаметром 0,6 см, заполненные Sn-Mo-оксидным катализатором. Зернение катализатора соответствуют фракции 1 2 мм. Суммарный объем активного катализатора в обеих зонах составлял 3,4 мл. После реактора N2 имеется подконтактный холодильник. Реакторы помещаются в печи, имеющие электрообогрев, который регулируется ЛАТРом.
Реакционная смесь из испарителя поступает в верхнюю часть реактора N1 и двигается вниз через слой первого катализатора, далее поступает в реактор N 2, после которого сразу попадает в холодильник, где происходит «закалка» — быстрое охлаждение смеси, позволяющее предотвратить дальнейшее окисление до CO и CO2. Объемная скорость процесса составляет 5070 (1/час). Температура в зонах реакции 210 в первой и 350 o C во второй, измеряется хромникелевой термопарой по всей длине каждой зоны.
Реакционная смесь частично конденсируется в подконтактном холодильнике и поступает в приемник. Несконденсировавшиеся газы проходят последовательно соединенные скруббера, содержащие по 20 мл 10%-ного раствора солянокислого гидроксиламина для улавливания остаточных количеств ацетальдегида, после чего проходят газовые часы и выбрасываются в атмосферу.
Концентрация полученной уксусной кислоты составляла 19,5% при селективности процесса по уксусной кислоте 64.4% и полной конверсии этилового спирта (см. таблицу).
Методика анализа конденсата.
Хроматографическое определение жидких продуктов реакции осуществляется методом внутреннего стандарта. В качестве стандарта использовалась точная навеса изопропанола, выбранного по времени удерживания на колонне PORAPAK Q.
Анализ проб был осуществлен на хроматографе ЛХМ-80. Колонки были заполнены носителем PORAPAK Длина колонок 2 м, диаметр 3 мм. Температура испарителя 200 o C, температура детектора 200 o C, температура колонок 175 o C. Газ носитель гелий, расход газа 2,4 л/ч. В продуктах определяли: воду, ацетальдегид, этиловый спирт и уксусную кислоту.
Ацетальдегид, уловленный в скрубберах титровали 0,1 н. раствором NaOH.
Методика газового анализа.
Анализ газовых продуктов проводился хромотографически на приборе ЛКМ-8МО.
Колонка N 1- молекулярные сита 13Х, сталь, длина 3 м, диаметр 3 мм. Колонка N 2 Porarak Q, сталь, длина 3 м, диаметр 3 мм. На колонке N 1 определяли: H2, O2, N 2 , CO, на колонке N 2 — CO2. Условия анализа: температура испарителя 75 o C, температура детектора и колонок 60 o C. Газ носитель аргон. Расход газа 1,5 л/ч.
Способ получения уксусной кислоты из этилового спирта парофазным окислением кислородом воздуха на Sn-Мо оксидном катализаторе, отличающийся тем, что применяют реактор с двумя реакционными зонами (двухреакторная система) и процесс ведут при оптимальных температурах в каждой зоне в первой 210 300 o С и во второй 350 390 o С, моляром соотношении C2H5OH H2O воздух 1 (6,5 0,5) (11 13) и объемной скорости процесса в интервале 3849 5070 ч — 1 .
Агропортал — все для специалистов агропромышленного комплекса
- Окисление этилового спирта до уксусной кислоты
- Получение кислоты из этилового спирта уравнение реакции
- Общие способы получения карбоновых кислот
- В промышленности
- В лаборатории
- Специфические способы получения важнейших кислот
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 🌟 Видео
Видео:Получение этилена из этилового спиртаСкачать

Окисление этилового спирта до уксусной кислоты
Этиловый спирт окисляется до уксусной кислоты под влиянием уксуснокислых бактерий, относящихся к родам Gluconobacter и Acetobacter. Это грамотрицательные хемоорганогетеротрофные, не образующие спор, палочковидные организмы, подвижные или неподвижные.
Два рода уксуснокислых бактерий различаются между собой по характеру жгутикования клеток. У представителей рода Gluconobacter клетки движутся при помощи 3—8 полярных жгутиков, редко одного, или неподвижные. Бактерии рода Acetobacter движутся при помощи перитрихиальных жгутиков или неподвижные.
Уксуснокислые бактерии — строгие аэробы, поэтому они развиваются только на поверхности среды, и для них весьма характерно образование пленок. Одни виды этих организмов образуют тонкие пленки, состоящие лишь из одного слоя клеток, другие формируют пленки более толстые, иногда напоминающие папиросную бумагу. Некоторые уксуснокислые бактерии дают пленки слизистые, толстые. Уксуснокислые бактерии отличаются высокой устойчивостью к кислотам (могут расти в среде с начальным pH 4, оптимум pH 5—6). Эти бактерии обнаруживают на поверхности растений (цветков, плодов), на разлагающихся растительных остатках и т. д.
Характерная особенность уксуснокислых бактерий – их способность превращать этиловый спирт в уксусную кислоту:
СН3СН2ОН + О2 -» СН3СООН + Н2О
Два рода уксуснокислых бактерий различаются по степени окисления органических субстратов. Так, уксуснокислые бактерии рода Acetobacter (A. peroxydans) накапливают уксусную кислоту в качестве промежуточного продукта и могут подвергать ее дальнейшему окислению до СО2 и Н2О (эти бактерии называют переокислителями), а бактерии рода Gluconobacter (G. oxydans) вызывают образование уксусной кислоты как конечного продукта реакции, который обычно не подвергается последующему окислению (эти бактерии называют иедоокислителями). Способность видов рода Acetobacter окислять уксусную кислоту до СО2 объясняется наличием у них цикла трикарбоновых кислот. Уксуснокислые бактерии способны окислять не только этиловый спирт, но и другие спирты, в том числе алифатические многоатомные.
Кроме указанных окислительных процессов, уксуснокислые бактерии могут вызывать окисление сорбита до сорбозы, маннита до фруктозы, глюкозы до глюконовой кислоты, глюконовой кислоты до кетоглюконовых кислот. Эти окислительные превращения осуществляются по пентозофосфатному пути представителями рода Gluconobacter. Особый интерес представляет окисление уксуснокислыми бактериями D — сорбита до L — сорбозы. Последняя требуется в больших количествах для синтеза витамина С.
Интересно отметить, что представитель рода Acetobacter — Acetobacter xylinum при росте на среде с глюкозой или другими источниками углерода способен образовывать внеклеточную слизистую пленку, состоящую из чистой целлюлозы. Целлюлозные фибриллы представляют собой рыхлую массу, окружающую клетки бактерий. В культуре эти организмы образуют пленку толщиной 1 см и более, состоящую из целлюлозы и бактериальных клеток.
Уксуснокислых бактерий используют для производства пищевого уксуса из вина и спирта.
Видео:Получение этилового спирта по наукеСкачать

Получение кислоты из этилового спирта уравнение реакции
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
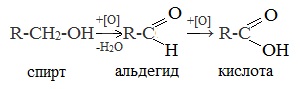
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
В качестве окислителей применяют KMnO4 и K2Cr2O7.
Например:
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.
А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
4. Использование реактива Гриньяра (по схеме)
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
Специфические способы получения важнейших кислот
Способы получения НСООН
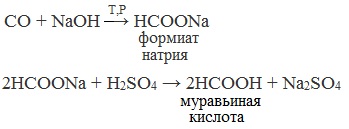
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
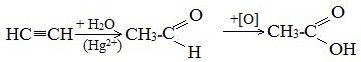
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Please wait.
Видео:Как получить этиловый спирт?Скачать

We are checking your browser. gomolog.ru
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e01b4b249880c31 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
🌟 Видео
Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Опыты по химии. Окисление спирта в альдегидСкачать

Окисление этанола оксидом меди (II). Опыт 3Скачать

Окисление этилового спирта оксидом меди(II)Скачать

ПОЛУЧЕНИЕ Галогенпроизводных. Получение хлорэтана. Реакция Этанола, Хлорида Натрия и Серной КислотыСкачать

7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать

Химические свойства КИСЛОТ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием кислотСкачать

65. Что такое реакция гидратации и реакция дегидратацииСкачать

7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

Абсолютный спирт. Химия – ПростоСкачать

Несколько лайфхаков со спиртом. Химия – просто.Скачать

8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать