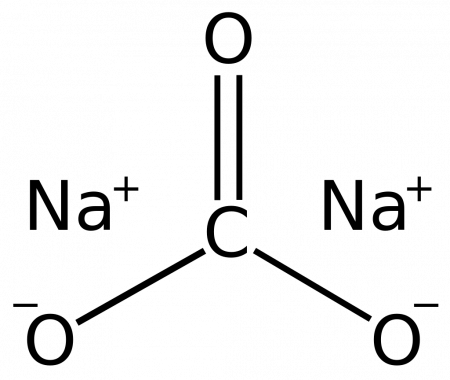
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
- Способ получения
- Качественная реакция
- Химические свойства
- Карбонат натрия (кальцинированная сода): свойства, применение, реакции
- Что такое карбонат натрия
- Физические характеристики карбоната натрия
- Способы получения карбоната натрия
- Химические свойства, реакции с карбонатом натрия
- Допустимые нормы приема карбоната натрия
- Области применения карбоната натрия
- Производство стекла
- Металлургия
- Химическая промышленность
- Добыча и переработка нефти
- Другие сферы применения
- Применение соды в быту
- Как влияет карбонат натрия на человеческий организм?
- Полезные свойства карбоната натрия
- Вредное воздействие карбоната натрия на организм человека
- Противопоказания
- Показания к применению
- Тип пищевой добавки, класс опасности и токсичности, условия хранения
- Заключение
- Карбонат натрия
- Содержание
- Свойства
- Нахождение в природе
- Получение
- Способ Леблана
- Промышленный аммиачный способ (способ Сольве)
- Способ Хоу
- Сравнение способов
- Применение
- Безопасность
- Тривиальные названия
Видео:Получение углекислого газа взаимодействием карбоната натрия с соляной кислотойСкачать

Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Видео:Качественная реакция на углекислый газСкачать

Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Видео:Практическая работа №5. Получение углекислого газа, качественная реакция на карбонат ионыСкачать

Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы . При этом образуются карбонат натрия и углекислый газ:
Видео:Получение углекислого газа и изучение его свойствСкачать

Карбонат натрия (кальцинированная сода): свойства, применение, реакции
Карбонат натрия или кальцинированная сода – это распространенное во многих сферах вещество. Когда-то домохозяйки не могли обойтись без него в процессе мытья посуды, а школьники – в ходе удаления пятен чернил с поверхности столов, за которыми они учились. Сегодня карбонат натрия востребован в химической промышленности и в изготовлении продуктов питания, его используют в производстве стекла и изделий из него, вводят в состав лекарственных препаратов и средств для ухода за проблемной кожей, применяют для добычи нефти.
По внешнему виду вещество представляет собой порошок из мелких, едва различимых кристаллов серовато-белого цвета – многие могли наблюдать его во время школьных опытов. Помимо белого порошка, реагент может также принимать вид бесцветных кристаллов.
Вещество великолепно растворяется в воде и многоатомных спиртах.
Существует две основные разновидности карбоната натрия: промышленная и пищевая. Вторая известна под индексом Е500. Карбонат натрия – это незаменимый помощник, когда речь идет о приготовлении хлебобулочных изделий и десертов.
Однако, если углубиться в особенности соединения, можно узнать, что под названием карбонат натрия скрывается целая группа веществ:
- карбонат натрия, пищевая добавка Е500 (i);
- гидрокарбонат натрия, пищевая добавка Е500 (ii);
- смесь солей двух вышеназванных соединений, пищевая добавка Е500 (iii).
Не следует путать кальцинированную соду с пищевой содой! Кальцинированная сода – это карбонат натрия, пищевая сода – это натрий двууглекислый.
Видео:Качественная реакция на углекислый газ.Скачать

Что такое карбонат натрия
Карбонат натрия – это соединение, принадлежащее к классу неорганических веществ. Внешне вещество представляет собой однородный белый или бело-серый порошок, может принимать вид бесцветных кристаллов. Соединение прекрасно растворяется в обычной воде при комнатной температуре и в многоатомных спиртах. Под воздействием открытого воздуха карбонат натрия легко поглощает водяные пары, при длительном пребывании в такой среде начинается процесс комкования: отдельные крупинки слипаются, порошок изменяет свой вид, темнеет.
До позапрошлого века вещество получали посредством переработки морских водорослей и растущих неподалеку от водных источников растений, основанием для которых служила солончаковая почва. В современном мире технология получения кальцинированной соды изменилась – в середине 19 века произошло внедрение метода Сольве, значительно упростившего процесс добычи вещества.
Карбонат натрия широко применяется в различных отраслях промышленности: химический синтез, переработка нефти, металлургия, производство стекла, цемента, тканей, бумаги, моющих средств. В быту его применяют для удаления въевшихся пятен с различных поверхностей.
Видео:Карбонат натрия из пищевой содыСкачать

Физические характеристики карбоната натрия
Стехиометрический состав соединения описывается следующей формулой – Na2CO3, молекулярная масса составляет – 105,99 а.е.м.
Плотность реагента – 2,53 г/см 3 .
Известны три основные модификации карбоната натрия:
- α–модификация обладает моноклинной кристаллической решеткой, устойчива до 350°C;
- β–модификация существует в диапазоне от 350 до 479°C, преобразование происходит без изменения пространственной структуры;
- γ-модификация отличается гексагональной кристаллической решеткой, для ее получения необходим нагрев выше 479°C.
Вещество плавится при температуре 854C. Нагрев более 1000˚C вызывает разложение карбоната натрия до двух составляющих – оксида натрия (Na2O) и углекислого газа (CO2).
Соединение легко растворяется в воде. При 20˚C растворимость реагента составляет 21,8 г на 100 г воды. С повышением температуры этот показатель растет, достигая максимума на отметке 40C (48,8 г), а затем постепенно снижается. Так при 100˚C растворимость равна 44,7 г, 140C – 39,3 г.
Гидролиз карбоната натрия протекает согласно следующее схеме:
CO3 2- + h3O HCO3 – + ОН –
Кальцинированная сода нерастворима в ацетоне, сероуглероде, слабо растворима в этаноле, зато легко растворяется в простейшем трехатомном спирте.
Молекула карбоната натрия
Видео:Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

Способы получения карбоната натрия
Потребность в кальцинированной соде невозможно удовлетворить, используя только природные источники. Для получения в промышленных объемах разработаны следующие способы:
Первый метод запатентовал бельгийский химик Эрнест Сольве. Этот вариант считается более экономичным и менее трудозатратным, чем способы, применяемые ранее. Процесс получения готового продукта включает несколько стадий.
Образование гидрокарбоната натрия:
Отделение осадка натриевой соли и последующее изменение отметки на термометре до 140-160˚C.
Продукты, образующиеся в ходе описанных реакций, используют повторно. Углекислый газ улавливают, а хлористый аммоний предварительно обрабатывают гидроксидом кальция для разложения на аммиак и воду.
Хлористый кальций (CaCl2) – единственный продукт, который выводится из системы.
Метод Хоу считается модификацией предыдущего способа. Он отличается тем, что хлорид аммония не используют для регенерации аммиака, а выводят из процесса.
Продукт широко применяют в качестве удобрения для выращивания риса, так-как избыток хлора не оказывает отрицательного влияния на этот злак. Процесс получения вещества описывается следующими уравнениями:
Раствор хлорида натрия нагревают до 40C, пропускают через него углекислый газ и аммиак в газообразном виде. Полупродукт гидрокарбонат натрия выделяют из охлажденного раствора (10˚C) благодаря низкой растворимости соединения и подвергают нагреву до 140-160˚C. В результате происходит обезвоживание и удаление избыточного количества оксида углерода (IV).
В лабораторной практике используют и другие способы получения:
- Na2O + CO2 → Na2CO3 – смешивание оксида натрия с окисью углерода (IV);
- 2NaOH + CO 2 → Na2CO3↓ + H2O – пропускания диоксида углерода через раствор гидроксида натрия, рассматриваемое соединение остается на дне колбы;
- NaHCO3 + NaOH → Na2CO3 + H2O – взаимодействие пищевой соды с гидроксидом натрия, приводящее к дегидратации;
- Na2S + CaCO3 → Na2CO3 + CaS – смешивание сульфида натрия с мелом приводит к образованию углекислого натрия и сульфида кальция.
Видео:Получение углекислого газа и тест на его обнаружениеСкачать

Химические свойства, реакции с карбонатом натрия
Карбонат натрия – это средняя соль сильного основания и слабой кислоты, поэтому водные растворы описываемого соединения имеют среды с высокой концентрацией гидроксид-ионов. Реакция протекает в две ступени.
Угольная кислота – довольно нестабильное соединение, которое легко разлагается на оксид углерода(IV) и обычную воду.
Кальцинированная сода отличается активностью, способна реагировать как с простыми, так и сложными веществами.
Взаимодействие с углеродом при температуре 900-1000C позволяет получить металлический натрий оксид углерода (II):
При реакции с галогенами (хлором, бромом, йодом) образуется соответствующие натриевые соли и углекислый газ. Уравнение процесса выглядит следующим образом:
В реакции используется горячий, концентрированный раствор описываемого вещества.
Хлорид натрия при взаимодействии с карбонатом натрия дает на выходе гипохлорит натрия, одновременно выделяются газообразный оксид углерода(IV) и вода.
Реакции с растворами минеральных кислот протекают с образованием средней соли, воды и углекислого газа. Взаимодействие компонентов описывают следующие схемы:
В случае взаимодействия карбоната натрия с соляной кислотой образуется хлористый натрий.
При смешивании соединения с серной кислотой получается сульфат натрия.
При добавлении плавиковой кислоты происходит образование фторида натрия.
Смешивание реагента с азотной кислотой на выходе дает нитрат натрия.
При соединении углекислого натрия и угольной кислоты получается пищевая сода.
Состав продуктов реакции между карбонатом натрия и ортофосфорной кислотой зависит от концентрации последней. При использовании разбавленного раствора получаются кислые соли, процессы описываются следующими уравнениями:
При взаимодействии с концентрированной ортофосфорной кислотой образуется средняя соль (Na3HPO4). Для протекания реакции необходимо нагреть реагенты до кипения.
Расплав карбоната натрия способен взаимодействовать с оксидом кремния. Температура расплава составляет 1150˚C, продукты реакции – метасиликат натрия и углекислый газ.
Кальцинированная сода взаимодействует с оксидом серы(IV). В нормальных условиях образуется сульфит натрия и оксид углерода (IV).
Если реагенты нагреть до температуры 40-60C, то в результате получается дисульфит натрия и углекислый газ.
В результате реакции кальцинированной соды с оксидом кальция в присутствии воды выделяется карбонат кальция и едкий натр. Метод применяют для получения едкого натра.
Карбонат натрия вступает в реакции с оксидами металлов (Fe, Al), образуя феррит и алюминат натрия, газообразный оксид углерода (IV). В первом случае компоненты нагревают до 800-900˚C, а во втором – 1000-1200˚C.
Карбонат натрия вступает в реакцию ионного обмена с нитратом калия с образованием нитрата натрия и карбоната калия.
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Допустимые нормы приема карбоната натрия
Описываемое вещество широко используется в качестве пищевой добавки в России, Украине, Беларуси, странах Евросоюза. Количество вводимого соединения строго регламентируется ГОСТом, техническими условиями и другой нормативной документацией. Его содержание в продуктах не способно оказать вред здоровью человека, поскольку содержится в них в минимальных количествах. Рекомендаций относительно суточной нормы употребления пищевой добавки на данный момент нет.
Видео:Практическая работа. Получение оксида углерода(IV) и изучение его свойств.Распознавание карбонатов.Скачать

Области применения карбоната натрия
Описываемое вещество широко используется в разнообразных отраслях народного хозяйства и быту. Наибольшей популярности карбонат натрия достиг в промышленности, а частности – в производстве стекла, металлургии, добыче и переработке нефти.
Производство стекла
Карбонат натрия исполняет роль флюса, снижая температуру плавления оксида кремния (IV) с 2500 до 500°C. Необработанное стекло растворяется в воде, поэтому дабы избежать этого к смеси добавляют соду, способствующую снижению способности материала к растворению. Так, карбонат натрия присутствует в составе практически всех оконных стекол и бутылок, которые вы видите. Кроме ого, соединение применяют для производства следующих разновидностей стекла:
- оптическое;
- электровакуумное;
- для медицинских целей;
- хрусталь;
- стеклоблоки и керамическая плитка;
- фритта.
Кальцинированная сода техническая
Металлургия
Карбонат кальция необходим в производстве металлов: цинка, стронция, вольфрама, хрома, свинца.
В черной металлургии кальцинированная сода отвечает за процессы десульфации дефосфации чугуна.
Он также участвует в системах, отвечающих за очистку промышленных газов и нейтрализацию кислых стоков.
Химическая промышленность
Описываемое соединение является исходным продуктом в синтезе таких реактивов, как едкий натр (NaOH), тетраборат натрия(Na2B4O7), гидрофосфат натрия (Na2HPO4). Кроме того, кальцинированную соду используют в производстве синтетических моющих средств, жирных кислот, мыловарении, красителей на анилиновой основе.
Добыча и переработка нефти
Карбонат натрия в сочетании с поверхностно-активными веществами позволяет снизить натяжение между водной средой и нефтью, что позволяет добиться более высоких результатов при разработке нефтяных месторождений.
Другие сферы применения
Реагент также востребован в следующих областях:
- текстильная и бумажно-целлюлозная промышленность – карбонат натрия часто применяют в производстве тканей и бумаги;
- уменьшение жесткости воды – карбонат натрия добавляют в воду, дают смеси настояться, а затем используют ее для хозяйственных нужд. Пить такую жидкость нельзя;
- пропитка для сигаретных фильтров;
- один из компонентов для проявляющего раствора в фотоделе;
- пищевая добавка, которая призвана регулировать кислотность, увеличивать срок хранения мясной продукции, выполнять эмульгатора и разрыхлителя, а также препятствовать комкованию сыпучих продуктов;
- удаление кожицы с овощей и фруктов – раствор на основе карбоната натрия заливают в специальные устройства, очищающие картофель, морковь, яблоки и груши;
- косметология;
- фармация – стабилизатор Е500 обладает ярко выраженными антацидными и антибактериальными свойствами, благодаря которым широко применяется в производстве антибиотиков и противотуберкулезных препаратов. Так, соду вводят в состав растворов для капельных инфузий, таблеток, растворов для промывания поврежденных участков кожи и полости рта, зубных паст и очищающих лосьонов для склонной к высыпаниям кожи.
Применение соды в быту
Не меньшей популярности карбонат натрия достиг в быту. Как уже было сказано выше, раньше он применялся для удаления въевшихся пятен и мытья посуды.
Помимо уже названных свойств, кальцинированная сода помогает справиться с накипью, нагаром, жировыми загрязнениями на поверхности посуды, плиты, мойки.
Она предназначена для борьбы с засорами, убирает практически любые загрязнения с сантехнического оборудования (ржавчину, кальцинированные отложения, плесень и др.). Так, с целью устранения засора в слив высыпают полстакана соды, а затем заливают его 2-3 литрами кипятка и оставляют на полчаса. По истечении 30 минут смесь смывают большим количеством воды.
Для избавления от въевшихся загрязнений влажную губку обильно посыпают содой и поливают водой, затем протирают загрязненную область. Жир, грязь и прочие загрязнения исчезают в считанные минуты.
Реагент в сочетании с нашатырным спиртом или раствором перекиси водорода выступает в качестве действенного пятновыводителя и отбеливателя. Бельевая сода используется для стирки изделий из хлопчатобумажных тканей.
В ходе ремонтных работ кальцинированную соду применяют для удаления старой краски. Для этого карбонат натрия высыпают на окрашенную поверхность, накрывают плотной влажной тканью и оставляют так на 10-12 часов. По истечении этого времени краска с легкостью отходит от любых поверхностей.
Также карбонат натрия применяют для мягкого отбеливания тканей и выведения пятен с любимых вещей. Для этого кальцинированную соду смешивают с теплой водой и наносят на пятно, спустя 15 минут раствор смывают. Если пятно не исчезло, процедуру повторяют. Для ускорения эффекта можно ввести в смесь нашатырный спирт.
При выпечке кулинарных изделий применяют только гидрокарбонат натрия (другое название пищевая сода). Кальцинированная сода для этих целей не используется – она не годится для употребления в пищу и несет опасность для человеческого здоровья.
А вот пищевую соду можно обнаружить в составе сухого молока, а также продуктов, приготовленных на основе шоколада или какао-порошка. Кроме того, соединение используют для обработки овощей в технологии щелочного удаления кожицы.
При работе с непищевыми разновидностями карбоната натрия важно соблюдать меры предосторожности: защищать чувствительную кожу рук, держать применяемое средство как можно дальше от слизистых рта и глаз.
Видео:Взаимопревращение карбонатов и гидрокарбонатовСкачать

Как влияет карбонат натрия на человеческий организм?
Согласно официальным данным описываемое соединение относится к безопасной категории пищевых добавок. При правильном использовании вещество не способно нанести вред человеку. Однако следует учитывать индивидуальные реакции на реагент. У людей с повышенной чувствительностью возможны такие проявления, как нарушение дыхательной функции, обморочное состояние, аллергические реакции, сбои в работе печени, мозговой деятельности.
Полезные свойства карбоната натрия
В данном случае речь пойдет о пищевой соде.
К положительным свойствам описываемого вещества относится способность нейтрализовать повышенную кислотность желудочного сока, благодаря чему его применяют для устранения боли, вызванной гастритом и язвенной болезнью. Способность карбоната натрия к нейтрализации кислот обеспечила ему широкое применение при отравлении кислотами.
Кроме того, карбонат натрия способен разжижать мокроту, благодаря чему часто применяется в муколитиках, применяемых при заболеваниях дыхательных путей. Он способствует разжижению мокроты и уменьшению кашля.
Содовый раствор также применяют для полоскания ротовой полости, снятия болезненных ощущений при укусах насекомых и повреждениях кожного покрова, как антисептическое и противогрибковое средство.
В косметологии хорошие результаты дает скраб на основе гидрокарбоната натрия.
Видео:Химия 9 класс (Урок№18 - Угарный газ. Углекислый газ.)Скачать

Вредное воздействие карбоната натрия на организм человека
Реагент, находящийся в порошкообразном состоянии, способен вызывать раздражение кожи, органов дыхания, глаз. Особенно важно не допускать соприкосновения карбоната натрия со слизистыми оболочками глаз и рта.
Раствор кальцинированной соды имеет сильно щелочную среду, поэтому при работе с ним желательно использовать перчатки. Они защитят кожу от покраснения и возможного химического ожога.
Употребление в пищу чрезмерного количества карбоната натрия может вызывать следующие последствия:
- резкое повышение кровяного давления;
- неприятные ощущения в области желудка;
- отек всего тела;
- уменьшение уровня калия в организме и, как следствие, быструю утомляемость, мышечные судороги и нарушение сердечного ритма.
Видео:Химия-9. Практическая работа 5. Получение углекислого газа. Качественная реакция на карбонат-ион.Скачать

Противопоказания
Описываемое вещество содержит в своем составе натрий, поэтому следует ограничить его применение лицам со следующими проблемами:
- артериальная гипертензия;
- нарушение в работе почек;
- мочекаменная болезнь;
- сердечно-сосудистые заболевания;
- отечность.
Видео:Качественная реакция на сульфат- и карбонат-ионы.Скачать

Показания к применению
Гидрокарбонат натрия назначают при отравлении, инфекциях, для снятия приступа изжоги, симптоматического лечения кашля.
Раствор пищевой соды используют локально для полоскания полости рта, горла, глаз, размягчения ушных пробок, в виде компресса с целью снятия зуда после укусов насекомых.
Также средства с карбонатом натрия показаны людям с проблемной кожей: он позволяет снизить количество высыпаний и убрать покраснение.
Видео:Опыты по химии. Получение и обнаружение оксида углерода (IV) в лаборатории в аппарате КиппаСкачать

Тип пищевой добавки, класс опасности и токсичности, условия хранения
К данной категории относятся следующие соединения:
- карбонат натрия E 500(i);
- гидрокарбонат натрия E 500(ii);
- смесь карбоната и гидрокарбоната натрия E 500(iii).
Задача добавок этого типа облегчить технологический процесс производства продовольственной продукции.
Описываемые соединения относятся к 3 классу опасности, нетоксичны. Сода обладает высокой гигроскопичностью, поэтому важно хранить ее в герметично закрытой таре, в сухом помещении. После вскрытия упаковки рекомендуется ограничить контакт с влажным воздухом и водой.
Видео:Получение, собирание и распознавание углекислого газаСкачать

Заключение
Карбонат натрия – это распространенное в разных сферах соединение. Он представляет собой однородный порошок серо-белого цвета, может принимать вид бесцветных кристаллов. Существует несколько разновидностей реагента: пищевая полностью безопасна, а вот при взаимодействии с технической необходимо применение средств индивидуальной защиты.
Карбонат натрия применяется в химической отрасли, нефтеперерабатывающей промышленности, металлургии, он значительно облегчает процесс ремонта и практически незаменим в быту. Кроме того, вещество часто вводят в состав продуктов питания, лекарственных препаратов и косметических средств.
Видео:Получение карбоната натрия - аналитического реагента. [ChemistryToday]Скачать
![Получение карбоната натрия - аналитического реагента. [ChemistryToday]](https://i.ytimg.com/vi/s_A2ri4V8YQ/0.jpg)
Карбонат натрия
| Карбонат натрия | |||
|---|---|---|---|
| |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий | ||
| Хим. формула | Na 2 CO 3 | ||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Константа диссоциации кислоты pKa | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| ГОСТ | ГОСТ 5100-85 | ||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| Кодекс Алиментариус | E500(i) | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Карбонат натрия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na 2 CO 3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Видео:Качественная реакция на углекислый газСкачать

Содержание
- 1 Свойства
- 2 Нахождение в природе
- 3 Получение
- 3.1 Способ Леблана
- 3.2 Промышленный аммиачный способ (способ Сольве)
- 3.3 Способ Хоу
- 3.3.1 Сравнение способов
- 4 Применение
- 5 Безопасность
- 6 Тривиальные названия
Видео:Взаимодействие соды с соляной кислотойСкачать

Свойства
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Первая константа диссоциации угольной кислоты равна 4,5⋅10 −7 . Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
Видео:Оксид углерода(IV). Углекислый газ. Состав и строение молекулы. Получение. Свойства и применениеСкачать

Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Сульфид натрия реагирует с карбонатом кальция:
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.
Безопасность
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м 3 . Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.