Изобретение предназначено для химической промышленности и может быть использовано при получении ацетилена и выплавке стали. Коксозольный остаток термической переработки окисленных бурых углей состава, маc.%: CaO — 47,5, C — 35,4, Fe2O3 — 6,6, SiO2 — 5,0, Mg — 3,3, Al2O3 — 1,6, S — 0,1, остальное — 0,5 смешивают с 12,9 — 28,3% от массы смеси карбоната кальция в виде известняка, подвергают высокотемпературной плавке при 2000-2100 o С, охлаждают, разделяют CaC2 и ферросилиций. Способ не требует дорогостоящих продуктов, литраж CaC2 275-285 л/кг, содержание ферросилиция 0,1-0,2 мас.%. 1 з.п.ф-лы.
Изобретение относится к химической технологии, в частности к получению карбида кальция.
Известен способ получения карбида кальция /Кузнецов Л.А. Производство карбида кальция. М., 1954, с. 32, 33/, включающий плавление шихты, состоящей из извести и углерода, при этом к свежей извести добавляют до 30% термически переработанного отхода производства — шлама «сухих» ацетиленовых генераторов, являющегося источником оксида кальция, кремния и железа, что снижает себестоимость карбида кальция и улучшает экологическую обстановку, так как часть вредных отходов, идущих на свалки, перерабатывается.
Недостатком известного способа является использование дорогостоящих продуктов /металлургического кокса, антрацита, обожженной извести/ в составе основной шихты /70%/, а также затраты антрацита, электроэнергии, пара при термопереработке шлама.
Известен способ получения карбида кальция /авторское свидетельство СССР N 664476, C 01 B 31/32, кл. C 01 B, 1976/, путем электротермической плавки извести и углеродистого восстановителя с периодической подачей корректирующего материала, в качестве которого используют коксозольный остаток термической переработки карбонатсодержащих горючих сланцев в количестве до 10% от веса шихты, при этом коксозольный остаток является источником оксидов кальция /24,0 — 31,0%/, кремния /14 — 20%/, железа /2,3 — 3,5%/ и углеродистого восстановителя /16 — 18%/.
Это снижает себестоимость карбида кальция, повышает содержание основного вещества в продукте и позволяет использовать отходы производства /коксозольный остаток/.
Недостатком известного способа является расход дорогостоящих продуктов /электродного графита, обожженной извести/ в основной части шихты /90 — 99%/.
Известен способ получения карбида кальция /авторское свидетельство СССР N 1168508, кл. C 01 B 31/32, 1983/, включающий плавление шихты, состоящей из извести и углерода, охлаждение плава и разделение продуктов реакции — карбида кальция и ферросилиция, при этом плавление шихты ведут в присутствии известняка или сланцевого кокса зольного в количестве 12,9 — 28,3% от массы шихты. Для корректировки соотношения кремния к железу в шихте вводят недостающее количество железа в виде стружки, обеспечивающее весовое соотношение кремния к железу 1: 2, получая при этом карбид кальция со знаком качества /литраж ацетилена — до 300 л/кг карбида/.
Недостатком известного способа является использование дорогостоящих продуктов в основном составе шихты /извести и углеродистого материала/.
В основу изобретения положена задача получения карбида кальция с использованием отходов угледобывающей промышленности в основном составе шихты, что снижает себестоимость карбида кальция и улучшает экологическую обстановку за счет переработки отвалов.
Поставленная задача решается тем, что в способе получения карбида кальция, включающем плавление шихты из материала, содержащего оксиды кальция, кремния, железа и углерод, охлаждение плава и разделение продуктов реакции — карбида кальция и ферросилиция, при этом плавление шихты ведут в присутствии известняка в количестве 12,9 — 28,3% от массы шихты, согласно изобретению в качестве указанного материала используют отходы угледобычи, в частности коксозольный остаток термической переработки окисленных бурых углей состава, мас.%: окись кальция 47,5; углерод 35,4; окись железа 6,6; окись кремния 5,0; окись магния 3,3; окись алюминия 1,6; сера 0,1; фосфор — следы, остальное 0,5.
Использование отходов угледобычи — коксозольного остатка термической переработки окисленных бурых углей с усредненным составом, приведенным выше, позволяет снизить себестоимость карбида кальция, так как эти отходы перевозят в отвалы, занимая при этом пахотные земли. В настоящее время под отвалами только в Канско-ачинском угольном бассейне находится 6000 га пахотных земель, дающих до этого урожай зерновых по 25 ц с гектара /Гаврилин К.В., А.Ю. Озерский. Канско-ачинский угольный бассейн. М.: Недра, 1996, с. 93, 152, 154/, при этом сырьевая база только по Березовскому разрезу Кабасса составляет 1 млрд. тонн забалансовых углей с высоким содержанием окиси кальция в коксозольном остатке /до 50%/.
Получение карбида кальция из отходов угледобычи снижает его себестоимость на 30%, так как сырьевая составляющая себестоимости составляет до 1/3 стоимости карбида кальция (Производство карбида кальция в СССР и за рубежом. Серия «Производство фосфора и карбида кальция». -М.: НИИТЭХИМ, 1973).
При этом термическая переработка отходов не требует дорогостоящих продуктов /антрацита, пара, электроэнергии/, так как коксозольный остаток термической переработки окисленных бурых углей является продуктом неполного их сгорания с использованием тепловой энергии этого процесса.
Готовят шихту из коксозольного остатка термической переработки окисленных бурых углей состава, мас.%: окись кальция 47,5; углерод 35,4; окись железа 6,6; окись кремния 5,0; окись магния 3,3; окись алюминия 1,6; сера 0,1; остальное 0,5; /фосфора — следы/. Весовое соотношение кремния к железу в шихте равно 1:2. Средняя крупность частиц шихты 2 — 3 мм. Полученную шихту подвергают высокотемпературной плавке в графитовом тигле при 2000 — 2100 o C в течение 15 мин, затем плав охлаждают до комнатной температуры. Образующийся плав состоит из 96,5 мас.ч. карбида кальция /содержащего 75% CaC2/ и 3,5 мас.ч. ферросилиция в виде самостоятельных несмешивающихся фаз. Литраж карбида кальция составляет 275 л/кг. Содержание ферросилиция в карбиде кальция составляет 3,4%.
Готовят шихты из коксозольного остатка термической переработки окисленных бурых углей /такого же состава, как в примере 1/ и вводят карбонат кальция в виде известняка /содержащего 96 — 98% CaCO3/ в количестве 12,9% от массы шихты. Крупность частиц смешиваемых компонентов 2 — 3 мм. Полученную шихту подвергают высокотемпературной плавке при 2000 — 2100 o C в течение 15 минут, затем плав охлаждают до комнатной температуры и разделяют продукты плавки. После разделения фаз образуется 93,3 мас.ч. карбида кальция и 6,7 мас. ч. ферросилиция. Литраж полученного карбида составляет 284 л/кг, при содержании в нем ферросилиция 0,2%.
Готовят шихту из коксозольного остатка термической переработки окисленных бурых углей /такого же состава, как в примере 1/ и вводят карбонат кальция в виде известняка /содержащего CaCO3 96 — 98%/ в количестве 28,3% от массы шихты. Крупность частиц смешиваемых компонентов 2 — 3 мм. Полученную шихту подвергают высокотемпературной плавке при 2000 — 2100 o C в течение 15 минут, затем плав охлаждают до комнатной температуры и разделяют продукты плавки. После разделения фаз образуется 93,2 мас.ч. карбида кальция и 6,8 мас. ч. ферросилиция. Литраж полученного карбида составляет 285 л/кг, при содержании в нем ферросилиция 0,1%.
Применение предлагаемого способа позволяет получить карбид высокого качества из отходов угледобычи, идущих в отвал. Ферросилиций также используется для раскисления сталей в черной металлургии. Наличие незначительных количеств серы и следов фосфора позволяет использовать промышленные печи для получения карбида этим способом, а неограниченная сырьевая база /17% от всего добываемого открытым способом бурого угля/ предполагает возможность крупнотоннажного производства, что исключает рост отвалов, так как отходы угледобычи могут перерабатываться в ценный продукт, себестоимость которого в настоящее время оценивается в 500 долларов за тонну и его не хватает.
1. Способ получения карбида кальция, включающий плавление шихты из материала, содержащего оксиды кальция, кремния, железа и углерод, охлаждение плава и разделение продуктов реакции — карбида кальция и ферросилиция, при этом плавление ведут в присутствии карбоната кальция в виде известняка в количестве 12,9 — 28,3% от массы шихты, отличающийся тем, что в качестве указанного материала используют коксозольный остаток термической переработки окисленных бурых углей.
2. Способ по п.1, отличающийся тем, что коксозольный остаток термической переработки окисленных бурых углей имеет следующий состав, мас.%: Окись кальция — 47,5 Углерод — 35,4 Окись железа — 6,6 Окись кремния — 5,0 Окись магния — 3,3 Окись алюминия — 1,6 Сера — 0,1 Остальное — 0,5
- Карбид кальция: свойства и применение. Получение ацетилена
- История получения
- Физические свойства
- Химические свойства
- Получение
- Транспортировка и хранение
- Применение
- Производство ацетилена
- Лабораторный опыт получения ацетилена
- Карбид кальция (CaC2): структура, свойства, производство, применение
- Содержание:
- Состав
- Номенклатура
- Свойства
- Физическое состояние
- Молекулярный вес
- Температура плавления
- Точка кипения
- Плотность
- Химические свойства
- Получение
- Приложения
- При производстве ацетилена
- В сокращении выбросов CO2
- При получении цианамида кальция
- В металлургической промышленности
- В различных применениях
- Прекращенное использование
- Риски
Видео:Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать

Карбид кальция: свойства и применение. Получение ацетилена
Карбиды – это группа неорганических соединений углерода с металлами, а также с кремнием или бором (поскольку эти элементы проявляют металлические свойства). Карбид кальция – одно из наиболее востребованных веществ этой группы. О свойствах и применении соединения читайте ниже.
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

История получения
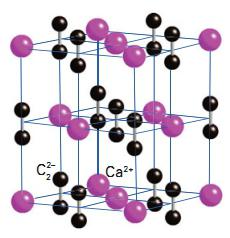
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2. Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
Видео:Карбид кальция и ацетилен - что это такое?Скачать

Физические свойства
По своим физическим свойствам карбид кальция является кристаллическим веществом с температурой плавления 2300 о С. Эта цифра является справедливой лишь для чистого соединения. Карбид, содержащий примеси, может иметь другие показатели температуры плавления. Основное агрегатное состояние вещества – твердое, а цвет варьирует от серого до коричневого.
Видео:7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

Химические свойства
Карбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы. С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой.
Видео:Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать

Получение
Производство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 о С. Расплав выходит из печи и в дальнейшем разливается по специальным формам. Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества. На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии.
Видео:Реакция оксида кальция с водой | CaO + H2O = Ca(OH)2Скачать

Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.
Видео:Получение Карбоната Кальция - чистого мела. CaCO3.Скачать

Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.
Видео:Опыты по химии. Превращение гидрокарбоната кальция в карбонат кипячениемСкачать

Производство ацетилена
Одной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓. На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа. Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается. На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер.
Видео:3.2. Алкины: Способы полученияСкачать

Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
Видео:Карбонат натрия из пищевой содыСкачать

Карбид кальция (CaC2): структура, свойства, производство, применение
Карбид кальция (CaC2): структура, свойства, производство, применение — Наука
Видео:🔥 Получил МЕТАЛЛ из СОДЫ. Старинный способ ДОБЫЧИ НАТРИЯ.Скачать

Содержание:
В карбид кальция Это неорганическое соединение, образованное элементами кальция (Ca) и углерода (C). Его химическая формула — CaC2. Это твердое вещество, которое может быть от бесцветного до желтоватого или серовато-белого и даже черного в зависимости от содержащихся в нем примесей.
Одна из его наиболее важных химических реакций CaC2 что происходит с водой H2Или, в котором образуется ацетилен HC≡CH. По этой причине его используют для получения ацетилена промышленным способом. Из-за такой же реакции с водой он используется для созревания фруктов, в ложных орудиях и военно-морских ракетах.
Реакция CaC2 с водой также образует полезный ил для приготовления клинкера (компонента цемента), который производит меньше диоксида углерода (CO2) по сравнению с традиционным методом производства цемента.
С азотом (N2) карбид кальция образует цианамид кальция, который используется в качестве удобрения. ЦК2 он также используется для удаления серы из некоторых металлических сплавов.
Некоторое время назад ЦК2 Он использовался в так называемых карбидных лампах, но они уже не очень распространены, потому что они опасны.
Видео:Реакция CaC2 с водой и образование ацетиленидовСкачать

Состав
Карбид кальция — это ионное соединение, состоящее из иона кальция Ca 2+ и карбид- или ацетилид-ион C2 2- . Карбид-ион состоит из двух атомов углерода, соединенных тройной связью.
Кристаллическая структура CaC2 происходит от кубической (как хлорид натрия NaCl), но как ион C2 2- при удлинении структура искажается и становится тетрагональной.
Видео:Карбид кальция или карбид алюминия?!Скачать

Номенклатура
- Карбид кальция
- Карбид кальция
- Ацетилид кальция
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Свойства
Видео:Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Физическое состояние
Кристаллическое твердое вещество, которое в чистом виде бесцветно, но если оно загрязнено другими соединениями, оно может быть желтовато-белым или от сероватого до черного.
Видео:Химия ЦТ | Задачи по термохимическим уравнениямСкачать

Молекулярный вес
Видео:Химия Заново 4. Ракушки, мрамор, карбонат кальция.Скачать

Температура плавления
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Точка кипения
ЦК2 кипит при 2300ºC с разложением. Точку кипения необходимо измерять в инертной атмосфере, то есть без кислорода и влаги.
Видео:¥ Жидкое стекло с известью.Скачать

Плотность
Видео:Карбонат кальцияСкачать

Химические свойства
Карбид кальция реагирует с водой с образованием ацетилена HC≡CH и гидроксида кальция Ca (OH).2:
Ацетилен легко воспламеняется, поэтому CaC в присутствии влаги2 он может быть легковоспламеняющимся. Однако когда он высохнет, это не так.
Карбид кальция реагирует с азотом N2 с образованием цианамида кальция CaCN2:
Получение
Карбид кальция производят промышленным способом в электродуговой печи из смеси карбоната кальция (CaCO3) и углерод (C), который подвергается воздействию температуры 2000 ° C. Реакция резюмируется следующим образом:
CaO + 3 C → CaC2 + CO ↑
В электродуговой печи электрическая дуга образуется между двумя графитовыми электродами, стойкими к высоким температурам. Получается карбид кальция с чистотой 80-85%.
Приложения
При производстве ацетилена
В промышленности реакция карбида кальция с водой используется для получения ацетилена C2ЧАС2.
Это наиболее важное применение карбида кальция. В некоторых странах высоко ценится ацетилен, так как он позволяет производить поливинилхлорид, который является разновидностью пластика. Кроме того, ацетилен используется для сварки при высоких температурах.
В сокращении выбросов CO2
Остатки, полученные от получения ацетилена из CaC2 (также называемый «осадок карбида кальция» или «остатки карбида кальция») используются для получения клинкера или бетона.
Грязь из карбида кальция имеет высокое содержание гидроксида кальция (Ca (OH)2) (около 90%), немного карбоната кальция (CaCO3) и имеет pH более 12.
По этим причинам он может реагировать с SiO.2 или Al2ИЛИ3 образуя продукт, аналогичный продукту, полученному в процессе гидратации цемента.
Один из видов деятельности человека, который производит больше выбросов CO2 это строительная отрасль. Сотрудничество2 он образуется на востоке, чтобы отделиться от карбоната кальция во время реакции с образованием бетона.
Использование осадка карбида кальция для замены карбоната кальция (CaCO3) было обнаружено, что снижает выбросы CO2 на 39%.
При получении цианамида кальция
Карбид кальция также используется в промышленности для получения цианамида кальция CaCN.2.
Цианамид кальция используется в качестве удобрения, потому что с почвенной водой он превращается в цианамид H2N = C = N, который обеспечивает растения азотом, важным для них питательным веществом.
В металлургической промышленности
Карбид кальция используется для удаления серы из таких сплавов, как ферроникель. CaC смешанный2 со сплавом, расплавленным при 1550 ° С. Сера (S) реагирует с карбидом кальция с образованием сульфида кальция CaS и углерода C:
CaC2 + S → 2 C + CaS
Удаление серы благоприятно, если смешивание является эффективным и содержание углерода в сплаве низкое. Сульфид кальция CaS плавает на поверхности расплавленного сплава, откуда его сливают и выбрасывают.
В различных применениях
Карбид кальция использовался для удаления серы из железа. Также как топливо при производстве стали и как мощный раскислитель.
Его используют для созревания фруктов. Ацетилен образуется из карбида кальция с водой, который способствует созреванию фруктов, таких как бананы.
Карбид кальция используется в манекенах, чтобы вызвать характерный для них громкий хлопок. Здесь также используется образование ацетилена, который взрывается искрой внутри устройства.
ЦК2 он используется для генерации сигналов на море при самовоспламенении морских ракет.
Прекращенное использование
ЦК2 он использовался в так называемых карбидных лампах. Их действие заключается в капании воды на карбид кальция с образованием ацетилена, который воспламеняется и, таким образом, дает свет.
Эти лампы использовались на угольных шахтах, но их использование было прекращено из-за наличия метана CH4 в тех шахтах. Этот газ легко воспламеняется, и пламя карбидной лампы может воспламениться или взорваться.
Они широко использовались в сланцевых, медных и оловянных рудниках, а также в ранних автомобилях, мотоциклах и велосипедах в качестве фар или фар.
В настоящее время их заменяют электрические лампы или даже светодиодные лампы. Однако они по-прежнему используются в таких странах, как Боливия, на серебряных рудниках Потоси.
Риски
Карбид кальция CaC2 в сухом виде он не горюч, но в присутствии влаги быстро образует ацетилен, которым и является.
Для тушения пожара в присутствии CaC2 нельзя использовать воду, пену, углекислый газ или галогенные огнетушители. Следует использовать песок или гидроксид натрия или кальция.