- Галогены
- Положение в периодической системе химических элементов
- Электронное строение галогенов
- Физические свойства и закономерности изменения свойств
- Соединения галогенов
- Способы получения галогенов
- Химические свойства галогенов
- Галогеноводороды
- Строение молекулы и физические свойства
- Способы получения галогеноводородов
- Химические свойства галогеноводородов
- Галогениды металлов
- Способы получения галогенидов
- Химические свойства галогенидов
- Кислородсодержащие кислоты галогенов
- Хлорноватистая кислота и ее соли
- Хлористая кислота и ее соли
- Хлорноватая кислота и ее соли
- Хлорная кислота и ее соли
- Получение и применение галогенов
- Что такое получение и применение галогенов
- Получение галогенов
- Получение фтора
- Получение хлора
- Получение брома и иода
- Применение галогенов
- Фтор
- Хлор
- Бром
- Иод
- Похожие страницы:
- VII группа главная подгруппа периодический таблицы Менделеева (галогены)
- Общая характеристика галогенов
- Нахождение в природе галогенов
- Способы получения фтора
- Физические свойства фтора
- Химические свойства фтора
- Способы получения хлора
- Физические свойства хлора
- Химические свойства хлора
- Способы получения брома
- Физические свойства брома
- Химические свойства брома
- Способы получения йода
- Физические свойства йода
- Химические свойства йода
- 📹 Видео
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns 2 np 5 .
Например , электронная конфигурация фтора :
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например , взаимодействием соляной кислоты с оксидом марганца (IV)
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
Например , бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например , оксид марганца (IV):
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
Например , хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например , оксид марганца (IV) в кислой среде окисляет йодид калия:
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей . Галогены реагируют с металлами и неметаллами .
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например , железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например , фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например , хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например , хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например , хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например , фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например , хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например , действием концентрированной серной кислоты на хлорид натрия:
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства . Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами . Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например , хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами , расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например , соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют , образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например , соляная кислота реагирует с карбонатом кальция:
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами . При этом более активные галогены вытесняют менее активные.
Например , бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например , бромоводород окисляется концентрированной серной кислотой:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например , йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, например , оксидом азота (IV):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами . При этом галогены проявляют свойства окислителя.
Например , хлор взаимодействует с магнием и кальцием:
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например , соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например , при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например , при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например , гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями , если образуется осадок, газ или вода.
Например , бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами . При этом более активные металлы вытесняют менее активные.
Например , магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например , натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например , при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
4. Галогениды металлов проявляют восстановительные свойства . Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например , бромид калия окисляется концентрированной серной кислотой:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака .
Например , хлорид серебра (I) растворяется под действием избытка раствора аммиака:
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например , хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями .
Например , с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например , хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например , пероксид водорода:
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например , соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
2. Гипохлориты вступают в обменные реакции с другими солями , если образуется слабый электролит.
Например , гипохлорит кальция реагирует с растворимыми карбонатами:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например , из хлората бария под действием серной кислоты:
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Например , хлорноватая кислота окисляет фосфор:
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например , хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например , из перхлората натрия под действием серной кислоты:
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
Например , хлорная кислота окисляет углерод:
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например , перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
Еще пример : перхлорат калия окисляет алюминий:
Видео:Опыты по химии. Вытеснение йода и брома хлоромСкачать

Получение и применение галогенов
Получение и применение галогенов: получение это процессы в результате которого выделяется в ходе реакции (химической, электролитической) галогены фтор, хлор, бром, иод.
Применение галогенов зависит от в первую очередь от нужд человека, самые большие потребители галогенов это сельское хозяйство и химическая промышленность.
Видео:1. Галогены (7 группа). Общая характеристика. Химические свойства фтора, хлора, брома и йодаСкачать

Что такое получение и применение галогенов
В природных соединениях галогены содержатся (за редким исключением) в виде отрицательно заряженных ионов, поэтому почти все способы получения свободных галогенов сводятся к окислению их ионов.
Это осуществляется или при помощи различных окислителей, или путем воздействия электрического тока.
Получение галогенов
Это процесс в результате которого образуется в свободном (чистом) состоянии определенный галоген, например для того чтобы получить хлор в свободном состоянии нужно проделать реакцию гипохлорита натрия с соляной кислотой:
NaClO + HCl → NaCl + Cl2↑ + H2O
Как известно, процесс электролиза сопровождается переходом электронов с катода на положительно заряженные ионы и с отрицательно заряженных ионов на анод. Следовательно, у катода происходит процесс восстановления, у анода — процесс окисления.
Таким образом, окисление или восстановление может быть осуществлено не только путем воздействия одного вещества на другое, но и при помощи электрического тока.
Электрический ток — наиболее мощное средство для окисления и восстановления.
Интересные факты о галогенах: все галогены без исключения в свободном состоянии токсические вещества, при вдыхании которых могут вызывать удушья, аллергические реакции, ожоги слизистых тканей дыхательных путей.
Получение фтора
Фтор, вследствие огромного сродства к электрону, может быть выделен из своих соединений исключительно электролитическим путем.
Впервые он был получен в 1886 г. путем разложения электрическим током безводного жидкого фтористого водорода HF, к которому было прибавлено около 20% фтористого калия KF.
Разложение производилось в приборе, выполненном из меди, на которую фтор не действует (после того, как медь покроется слоем фтористой меди). Электроды были сделаны из платины.
Метод, использованный для выделения элементарного фтора, осуществляется в настоящее время и при промышленном получении этого вещества.
Разложению электрическим током подвергают расплав состава KF • 2HF (темп. пл. 70° С). Электролиз ведут в стальных ваннах, пользуясь угольными электродами.
Получение хлора
Хлор получают в настоящее время в больших количествах путем электролиза водных растворов хлористых солей натрия или калия. Хлор выделяется у анода, а у катода образуется соответственно едкий натр или едкое кали. О получении хлора электролизом водного раствора хлористого натра.
Хлор в свободном состоянии можно получить при взаимодействии HCl и KClO3.
Интересные факты о галогенах: хлор считается микроэлементом, нехватка его в крови приводит к нарушении работы органов человека.
Недостаток хлорида натрия ведет к нарушению обмена веществ в организме, так как эта соль неотъемлемая часть жизнедеятельности всего организма.
В лабораториях хлор получают действием различных окислителей на соляную кислоту. Напомним, например , известный из школьного курса лабораторный способ получения хлора действием двуокиси марганца на соляную, кислоту:
В ионной форме эта реакция выразится уравнением:
из которого видно, что здесь происходит окисление ионов Сl’ в атомы хлора (образующие затем молекулы Сl2) и восстановление четырехвалентного марганца, входящего в состав МnO2, в двухвалентный (ионы Мn •• ). При помощи этой реакции хлор был впервые получен Шееле в 1774 г.
Аналогичным путем можно получить хлор из соляной кислоты, действуя на нее вместо МnO2 другими окислителями ( например , РbO2, КClO3, КМnO4).
Кислород не взаимодействует при обычных условиях с НСl в сколько-нибудь заметной степени Но если пропускать смесь НСl и О2 через трубку, нагретую до 400° и содержащую кусочки пемзы, на которых распределена в качестве катализатора хлорная медь СuСl2, то происходив окисление хлористого водорода (ионов Сl — ) кислородом:
причем выход хлора достигает 80%. Этой реакцией раньше часто пользовались для получения хлора.
Получение брома и иода
Бром и иод могут быть получены аналогично хлору окислением НВr и HJ различными окислителями. В промышленном масштабе их обычно получают из бромистых или йодистых солей металлов, действуя на растворы последних хлором.
Таким образом, получение брома и иода тоже основано на окислении их ионов, только в качестве окислителя применяется хлор. Например :
В СНГ бром добывают из воды Сакского озера (в Крыму), содержащей довольно большое количество бромистых солей, и из «рапы» (насыщенного раствора) залива Кара-Богаз-Гол.
Освоено также получение брома из буровых вод.
Главным источником получения иода в СНГ служат воды буровых скважин. Для извлечения из этих вод иода к концу первой пятилетки были выстроены два больших завода в Сураханах и в Нефге-Чале, производительность которых вполне обеспечивает потребность нашей страны в иоде.
Применение галогенов
Галогены, особенно хлор, широко применяются в химической промышленности. Применение галогенов в жизни человека напрямую связана с его средой обитания, а также сего жизнедеятельностью.
Например для получения более больших урожаев применяют хлорсодержащие минеральные вещества хлорид натрия и хлорид калия.
Также человек научился применять галогены и в других отраслях:
- Сельское хозяйство.
- Медицина.
- Фармакология.
- Химическая промышленность и т.д.
Фтор
Фтор используется в настоящее время для получения некоторых очень ценных фторпроизводных углеводородов, обладающих уникальными свойствами.
Например , смазочные вещества, выдерживающие высокую температуру, пластмасса, устойчивая по отношению к химическим реагентам (тефлон), жидкости для холодильных машин (фреоны) и др.
Хлор
Хлор служит для приготовления многочисленных неорганических и органических соединений. Он применяется в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, хлористой серы и др.
Большое количество хлора, как в свободном состоянии, так и в виде белильных солей, используется для отбелки тканей и целлюлозы, идущей на изготовление бумаги.
Хлор применяется также для стерилизации питьевой воды и обеззараживания сточных вод. В цветной металлургии его используют для получения некоторых металлов путем хлорирования их руд.
Особенно большое значение приобрели за последнее время различные хлорорганические продукты.
Хлорсодержащие органические растворители — дихлорэтан, четыреххлористый углерод и др. — широко применяются для экстракции жиров и обезжиривания металлов.
Хлорорганические препараты — ДДТ, гексахлоран и др. — служат эффективным средством борьбы с вредителями сельскохозяйственных культур.
На основе хлорорганических продуктов изготовляются различные пластические массы, синтетические волокна, высококачественные каучуки, заменители кожи.
С развитием техники область применения хлорорганических продуктов все время расширяется; это ведет к непрерывному увеличению производства хлора.
Широкое использование хлора в различных отраслях народного хозяйства, а также масштабы его производства и потребления позволяют отнести хлор, наряду с серной кислотой, аммиаком и содой, к числу важнейших продуктов, выпускаемых химической промышленностью.
Бром
Бром необходим для выработки различных лекарственных веществ, некоторых красителей, а также бромистого серебра, потребляемого в больших количествах фотографической промышленностью.
Иод
Иод широко применяется в медицине в виде так называемой йодной тинктуры (10%-ный раствор иода в спирте), превосходного антисептического и кровеостанавливающего средства.
Кроме того, иод входит в состав ряда фармацевтических препаратов.
Статья на тему Получение и применение галогенов
Похожие страницы:
Понравилась статья поделись ей
Видео:Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

VII группа главная подгруппа периодический таблицы Менделеева (галогены)
К элементам главной подгруппы VII группы периодической таблицы Менделеева относятся элементы с общим названием «галогены»:
- Фтор F
- Хлор Cl
- Бром Br
- Йод I
- Астат At
Видео:ПОЛУЧЕНИЕ ХЛОРИДА ЙОДА. Получение I2Cl6. Реакция Йода и ХлораСкачать

Общая характеристика галогенов
От F к At (сверху вниз в периодической таблице)
Увеличивается
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
Электронные конфигурации у данных элементов схожи, они содержат 7 электронов на внешнем слое ns 2 np 5 :
Br – 3d 10 4s 2 4p 5 ;
I — 4d 10 5s 2 5p 5 ;
At – 4f 14 5d 10 6s 2 6p 5
Электронная конфигурация фтора и хлора
Электронная конфигурация брома и йода
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Нахождение в природе галогенов
Галогены являются химически активными веществами, в связи с чем, в природе они встречаются только в виде соединений. Их распространённость в земной коре снижается при увеличении атомного радиуса (от фтора к иоду). Например, содержание астата в земной коре исчисляется граммами.
Наиболее распространённые соединения фтора — флюорит CaF2, криолит Na3AlF6 и др., хлора — каменная соль (галит) NaCl, сильвин KCl и сильвинит KCl⋅NaCl.
Бром и иод не образуют индивидуальных минералов, но их соединения содержатся в морской воде и могут накапливаться водорослями.
Способы получения фтора
Фтор получают методом электролиза расплава гидрофторида калия (смеси HF и KF):
Физические свойства фтора
Фтор при обычной температуре — зеленовато-жёлтый ядовитый газ, с резким запахом, очень реакционноспособный, хорошо растворим в жидких водороде и кислороде.
Химические свойства фтора
Фтор является самым сильным окислителем из всех простых веществ. Непосредственно он не взаимодействует только с N2, Не, Ne, Аr, а при нормальных условиях также и с O2.
Взаимодействие с простыми веществами
С кислородом
Реакция протекает при электрическом разряде (2100-2400 В, 25-30 мА), температуре от -196°C до -183°C и давлении 12 мм рт.ст. с образованием дифторида трикислорода (триоксодифторид, фторид озона) или фторида кислорода:
С галогенами (Cl, Br, I)
Фтор вступает в реакции с другими галогенами:
Например, Cl2 + F2 → 2ClF
С водородом
Взаимодействует с водородом со взрывом даже в темноте:
С серой
Реакция с серой протекает легко даже при сильном охлажлении:
С углеродом
Реакция окисления порошкообразного углерода сопровождается самовоспламенением последнего:
С азотом
При нагревании фтор реагирует и с азотом:
С фосфором
Фтор взаимодействует с P энергично (со взрывом) на свету и в темноте, даже при охлаждении жидким N2:
С кремнием
Взаимодействует с кремнием с образованием фторида кремния
C инертными газами
Окисляет ксенон, образуя фторид ксенона:
С металлами
При взаимодействии с металлами образуются фториды:
- К, Na, Pb, Feзагораются при обычной температуре на свету. С щелочными металлами реакция протекает со взрывом:
- Mg, Zn, Sn, Al, Ag, Cu и др. загораются на свету при слабом нагревании:
- с малоактивными металлами – Au, Pt реагирует при нагревании до 300-400°С
Взаимодействие со сложными веществами
С водой
Фтор активно разлагает воду с образованием таких соединений, как фториды кислорода OF2, O2F2; пероксид водорода Н2O2; кислород, озон, фтороводород:
С кислотами
- Взаимодействует с безводной азотной кислотой при комнатной температуре с образованием диоксида-гипофторита азота и фтороводорода:
- С серной кислотой образует гексафторид серы, фтороводород и кислород:
С щелочами и аммиаком
Фтор окисляет щелочи:
Реагирует с газообразным аммиаком:
С солями
Не взаимодействует
Взаимодействие фтора с водными растворами солей невозможны, т.к. он ступает в реакцию с водой.
С оксидами
Реагирует с оксидом кремния, который загорается в атмосфере F2:
Способы получения хлора
Промышленный способ
Электролиз расплавов или водных растворов хлоридов, чаще – NaCl.
- Электролиз расплава хлорида натрия:
A(+): 2Cl − ̶ 2e → Cl2 0
2Na + + 2Cl − → 2Na º + Cl2º
Таким образом, получаем:
- Электролиз раствора хлорида натрия.
A(+): 2Cl − ̶ 2e → Cl2 0
Таким образом, получаем:
Лабораторный способ
Окисление концентрированной HCI сильными окислителями:
Физические свойства хлора
Хлор Cl2 при обычной температуре – тяжелый, желто-зеленый газ с резким удушающим запахом.
Cl2 в 2,5 раза тяжелее воздуха, малорастворим в воде (
6,5 г/л); хорошо растворим в неполярных органических растворителях. В свободном состоянии встречается только в вулканических газах.
Химические свойства хлора
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, с образованием в устойчивые хлорид-ионы:
Взаимодействие с простыми веществами
С кислородом
Непосредственно не взаимодействует
С галогенами
Хлор взаимодействует с другими галогенами – более активные галогены окисляют менее активные. В зависимости от условий могут получиться различные соединения:
С водородом
Реакция с водородом при обычных условиях не протекает. Однако, при нагревании, УФ — освещении или электрическом разряде реакция протекает со взрывом:
Непосредственно не взаимодействует
С фосфором
Непосредственно не взаимодействует
С кремнием
2Cl2 + Si = SiCl4 (при нагревании)
С металлами
- Активные металлы самовоспламеняются и горят в атмосфере сухого газообразного хлора:
- Окисление малоактивных металлов происходит легче влажным хлором или его водными растворами:
Взаимодействие со сложными веществами
Окисляет сложные вещества:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кипячении)
С водой
При растворении хлора в воде вступает в реакцию диспропорционирования (самоокисления-самовосстановления), с образованием хлорноватистой кислоты:
С водными растворами щелочей
При взаимодействии с щелочами хлор диспропорционирует с образованием солей, состав которых зависит от условий проведения реакции:
- с холоднымраствором щелочи образуются хлорид и гипохлорит:
- с горячимраствором щелочи образуются хлорид и хлорат:
- Хлор также растворяется в холодном растворе гидроксида кальция:
Эти реакции имеют важное практическое значение, приводят к получению гипохлоритов — КClO3 и Са(ClO)2; хлората калия (бертолетова соль) — КClO3
С солями
Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов:
- замещение атомов водорода в молекулах органических соединений:
- присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
HC ≡ CH + 2Cl2 → Cl2HC — CHCl2 1,1,2,2-тетрахлорэтан
Способы получения брома
Промышленный способ
- Исходное сырьё для получения брома — морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие бром в виде бромид-иона Br-
Бром втесняют при помощи хлора:
Далее бром отгоняют из раствора водяным паром или воздухом.
Лабораторный способ
- В лаборатории для получения брома используют сильные окислители:
Физические свойства брома
В обычных условиях бром – красно-бурая жидкость с резким зловонным запахом. При Т=-7,2°C жидкий бром застывает, образуя красно-коричневые игольчатые кристаллы.
Пары брома жёлто-бурого цвета, Ткип = 58,78°C.
В воде бром растворяется лучше других галогенов (3,58 г брома в 100 г H2O при 20°C). Хорошо растворим во многих органических растворителях.
Бромная вода имеет желто-бурую окраску, быстро исчезающую, при взаимодействии растворенного Br2 с каким-либо веществом. «Обесцвечивание бромной воды» — широко используется в качестве теста на обнаружение в растворе многих неорганических и органических веществ.
Химические свойства брома
Химические свойства брома сходны с хлором. Различаются только условия протекания реакций.
Взаимодействие с простыми веществами
С металлами
Жидкий бром сильный окислитель. Например, железо и алюминий самовозгораются при соприкосновении с бромом даже при обычной температуре.
С водородом
Взаимодействие брома с водородом происходит лишь при повышенной температуре. Реакция эндотермической и обратимой.
С азотом, углеродом, кислородом и благородными газами
Непосредственно не взаимодействует
С галогенами
Бром окисляется более активными галогенами:
Взаимодействие со сложными веществами
- Бром окисляет сложные соединения:
- диспропорционирует в водном растворе:
3BrO — ↔ BrO3 — + 2Br —
4BrO — ↔ BrO4 — + 3Br —
Обесцвечивание бромной воды
Обесцвечивание бромной воды – качественная реакция на многие неорганические и органические соединения:
- в воде SO2 и H2S в газообразном и растворенном виде, а также растворимые сульфиты и сульфиды реагируют с бромной водой, обесцвечивая ее:
- Фенол и анилин также легко взаимодействуют с бромной водой:
Способы получения йода
Промышленный способ
- Йод, также как и бром, извлекают из морской воды, соленых озер, подземных рассолов и буровых вод, где он содержится в виде I — .
- Получение свободного йода с помощью различных окислителей, чаще всего газообразного хлора:
Лабораторный способ
- Йод можно получить также как и хлор или бром действием различных окислителей (КМnО4, МnО2, КСlO3, КВrО3, FеСl3 и СuSO4) на иодоводородную кислоту:
2 FеC3 + 2 НI = 2 FeCl2 + I2 + 2 НСl
Физические свойства йода
Свободный йод I2 при обычной температуре — черно-серое с фиолетовым оттенком кристаллическое вещество с металлическим блеском. Легко возгоняется. Пары йода имеют своеобразный запах и очень ядовиты.
Среди галогенов I2 обладает самой меньшей растворимостью в воде, однако он хорошо растворим в спирте и других органических растворителях.
Химические свойства йода
Химическая активность йода – наименьшая по сравнению с другими галогенами. Со многими элементами йод непосредственно не взаимодействует, а с некоторыми реагирует только при повышенных температурах (водород, кремний, многие металлы).
Йод-крахмальная реакция
Обнаружить I2 даже в самой минимальной концентрации можно с помощью раствора крахмала, который при наличии I2 окрашивается в грязно-синий цвет.
Йод-крахмальная реакция используется при качественном обнаружении йода, а также его количественного анализа
Взаимодействие с простыми веществами
С водородом
Реакция обратима и возможна только при высокой температуре:
С металлами
При добавлении капли воды в качестве катализатора цинк, железо и алюминий в смеси с порошком йода горят, образуя йодиды:
С азотом, углеродом, кислородом
Непосредственно не взаимодействует
Взаимодействие со сложными веществами
С водой
Частично реагирует с водой (реакция диспропорционирования):
С щелочью
Диспропорционирует в водном растворе щелочи:
C аммиаком
C аммиаком образует аддукт нитрид трииодида:
С иодидами щелочных металлов
Молекулы галогенов присоединяются к иодидам щелочных металлов с образованием полииодидов (периодидов):
С окислителями
Йод проявляет восстановительные свойства в реакциях с сильными окислителями:
C восстановителями
Иод менее сильный окислитель, чем фтор, хлор и бром. Восстановители, такие как H2S, Na2S2O3 и др. восстанавливают его до иона I − :
📹 Видео
Галогеноводороды. Строение, получение, качественные реакции | ХимияСкачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Галогены. 9 класс.Скачать

Получение ХЛОРИДА ЙОДАСкачать

ПОЛУЧЕНИЕ ОГНЯ ИЗ ЙОДА И АЛЮМИНИЯСкачать

Монохлорид Брома - BrCl. Реакция Брома и Хлора. Реакция Cl2 и Br2.Скачать

Галогены (F, Cl, Br, I). Химические свойстваСкачать
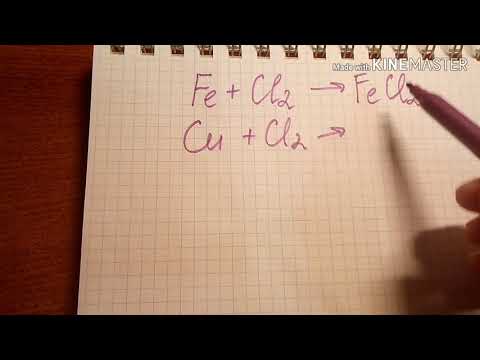
Как принимать ЙОД? (полное видео)Скачать

9 класс. Галогены. Химические свойства.Скачать
Хлор. 9 класс.Скачать

Однохлористый йод применение лечение дезинфекцияСкачать

ЙОД ОДНОХЛОРИСТЫЙ /Обработка/Дизинфекция курятника.Скачать

Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать

9 класс. Галогены. Решение упражнений и задач.Скачать











