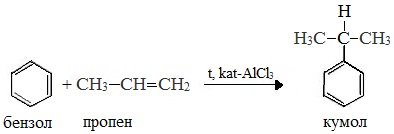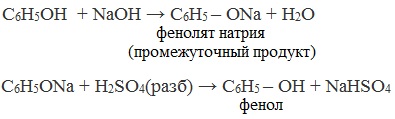Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
- Классификация фенолов
- По числу гидроксильных групп:
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 1. Взаимодействие хлорбензола с щелочами
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Получение фенола из хлорбензола уравнение реакции
- Получение фенола из хлорбензола уравнение реакции
- Получение фенола в промышленности
- 💡 Видео
Видео:9.2. Фенол: Способы полученияСкачать

Классификация фенолов
Видео:9.3. Фенол: Химические свойстваСкачать

По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Видео:Фенолы. Получение. Все 3 реакции ЕГЭ.Скачать

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Видео:Получение ФЕНОЛАСкачать

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видео:Нитрование разных производных бензола. Химический опытСкачать

5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Видео:9.1. Фенол: Строение, номенклатураСкачать

Получение фенолов
Видео:Определите массу (г) бензола, если при получении из ацетилена бензола (выход реакции 80);из (бензолСкачать

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
Видео:Способы получения фенола | Химия с Юлией ВишневскойСкачать

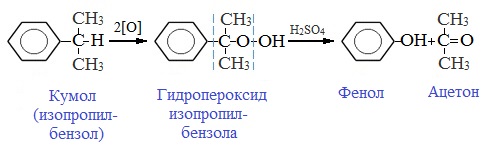
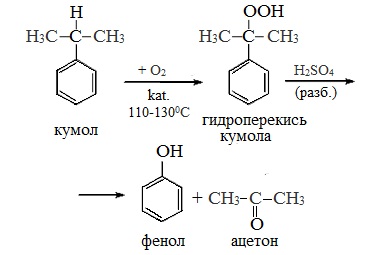
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Видео:Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Видео:Как получить ХЛОРБЕНЗОЛ, не используя БЕНЗОЛ!Скачать

Получение фенола из хлорбензола уравнение реакции
Фенолы – гидроксилпроизводные ароматических углеводородов, в которых группа ОН связана с атомом углерода ароматического ядра.
По количеству ароматических ядер в молекуле различают собственно фенолы, а также нафтолы, антролы, фенантролы и др. По числу гидроксильных групп различают одно-, двух-, трех-, многоатомные фенолы.
Названия фенолов образуют от названий соответствующих аренов с добавлением суффикса –ол. Простейший фенол – гидроксибензол С6Н5ОН называют просто фенол. При наличии нескольких заместителей начало нумерации определяет гидроксильная группа и эти соединения рассматриваются как производные фенола. Иногда в соединениях сложного строения наличие гидроксильной группы обозначают префиксом гидрокси-. Многие фенолы имеют тривиальные названия.
Фенол выделяют из каменноугольной смолы. Существует многочисленные синтетические методы получения фенола, промышленные и лабораторные.
1) Замещение сульфогруппы на гидроксил
Наиболее старый промышленный метод получения фенолов заключается в сплавлении щелочных арилсульфонатов с твердым гидроксидом натрия или калия или со сравнительно легкоплавкой смесью этих гидроксидов при 300-350 о С.
Хотя точный механизм реакции в расплаве двух ионных соединений неизвестен, ее следует отнести к процессам нуклеофильного ароматического замещения, где гидроксид-ион играет роль нуклеофильного агента, а сульфит-ион — уходящей группы.
Для получения самого фенола метод щелочного плавления в настоящее время не используется, но он широко используется для получения 2-нафтола, резорцина, ализарина и других фенолов.
2).Замещение галогена на гидроксил
Арилгалогениды, не содержащие активирующих электроноакцепторных заместителей, вступают в реакцию обмена в очень жестких условиях. Фенол получают нагреванием хлорбензола с 15-20%-ным водным раствором гидроксида натрия при 360-390 о С и давлении 280-300 атм.
В этих условиях реакция идет по ариновому механизму (см. лек.№24).
В присутствии солей меди (II), играющих роль катализатора, ариновый механизм полностью подавляется из-за резкого ускорения прямого замещения галогена по SNAr-механизму. Применение солей меди (II) позволяет проводить региоселективное замещение галогена на гидроксил без примеси какого-либо другого изомерного фенола.
Введение в молекулу арилгалогенида электроноакцепторных заместителей в орто— или пара-положения увеличивают скорость обмена галогена на гидроксил в некатализируемой реакции. Для таких реакций предложен SNAr-механизм замещения.
3) Замещение диазогруппы на гидроксил
Метод включает диазотирование первичного амина с последующими разложением соли диазония в водном растворе серной кислоты. Замещение диазогруппы на гидроксил протекает по SN1-механизму. Так как промежуточно образующийся арилкатион может реагировать с любым нуклеофилом, имеющимся в реакционной среде, наиболее целесообразно использовать для гидролиза в фенолы гидросульфаты диазония. В качестве побочного продукта при этом образуется эфир ArOSO3H, который легко гидролизуется в фенол. См. также лек. №24 и 43.
4) Получение фенола из гидропероксида кумола
Современный промышленный метод получения фенола заключается в кислотно-катализируемом разложении гидропероксида кумола. Исходное вещество для всего цикла превращений — кумол получают алкилированием бензола пропиленом по Фриделю-Крафтсу.
Далее кумол окисляют кислородом воздуха при 100-130 о С до гидропероксида кумола.
Эта реакция протекает по цепному радикальному механизму с участием кумильного радикала.
Разложение гидропероксида кумола до фенола и ацетона проводят в присутствии 1% водной серной кислоты при 50-90 о С.
Процесс разложения гидропероксида по своему механизму напоминает перегруппировки карбкатионов. Различие заключается в том, что миграция фенила происходит к положительно заряженному атому кислорода.
В целом это очень экономичный способ получения одновременно двух важнейших продуктов — ацетона и фенола.
3. Физические свойства и строение
Фенолы – жидкие или кристаллические вещества с сильным характерным запахом. При хранении на воздухе быстро темнеют из-за окисления. Ограниченно растворимы в воде.
Гидроксигруппа и ароматическое кольцо образуют сопряженную систему. Гидроксигруппа проявляет электронодонорные свойства за счет +М-эффекта, который превышает по силе –I-эффект.
Фенол и его гомологи – полярные соединения. Дипольный момент направлен в сторону бензольного кольца. Взаимодействии неподеленной пары электронов кислорода с p -системой кольца обусловливает электронодонорные свойства этих соединений. Энергия ионизации фенола составляет 8,5-8,6 эВ, что ниже, чем у бензола и спиртов.
Введение гидроксильной группы в бензольное кольцо вызывает сдвиг полос поглощения в УФ-спектрах в длинноволновую область и усиливает их: 210 ( e 6200) и 270 ( e 1450) нм.
В ИК-спектрах характеристические полосы поглощения валентных колебаний группы ОН лежат в области 3390-3600 см -1 и зависят от растворителя и концентрации.
В спектрах ПМР сигнал протонов группы ОН находится в широком диапазоне и зависит от температуры, концентрации, рН и растворителя (в дейтерохлороформе d 4,5-7,5 м.д.)
Для фенолов характерны нуклеофильные свойства, которые усиливаются при превращении их в феноксид-анионы в результате ионизации полярной связи О-Н. При этом электрофилы могут реагировать как по атому кислорода, так и по атомам углерода ароматического кольца фенолов или феноксид-анионов.
Фенолы являлются слабыми ОН-кислотами, но значительно превосходят по кислотности спирты. Например, фенол в 10 8 раз более сильная ОН-кислота по сравнению с циклогексанолом.
Причина более высокой кислотности фенолов состоит в стабилизации феноксид-аниона за счет делокализации отрицательного заряда с участием ароматического кольца.
Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электроноакцепторные заместители, особенно в орто- и пара-положениях, усиливают, а электронодонорные — понижают кислотные свойства фенолов.
Величины рКа орто-, мета- и пара-замещенных фенолов в воде при 25 о С
Большинство фенолов легко растворяется в водных растворах щелочей МОН с образованием фенолятов ArOM.
Получение простых и сложных эфиров фенолов
Нуклеофильные свойства атома кислорода фенолов понижены по сравнению со спиртами в результате сопряжения. Как следствие этого ариловые эфиры карбоновых кислот нельзя получать прямой этерификацией фенолов карбоновыми кислотами. Сложные эфиры получают ацилированием фенолов или их Na-и K-солей галогенангидридами или ангидридами кислот.
ArOH + RCOX ® RCOOAr + HX
ArO — Na + + RCOX ® RCOOAr + NaX
Феноляты легко алкилируются , алкилгалогенидами и диалкилсульфатами с образованием простых эфиров.
ArO — Na + + RX ® ArOR + NaX
Метиловые эфиры фенолов получают также действием диазометана в эфирном растворе.
В отличие от спиртов фенолы как более сильные кислоты метилируются диазометаном в отсутствие катализатора.
Перегруппировка Кляйзена аллилариловых эфиров
Аллиловый эфир фенола при нагревании до 200-220 о С превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца.
Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение:
Установлено, что и орто— и пара-перегруппировки являются внутримолекулярными реакциями первого порядка. Миграция в орто-положение сопровождается инверсией аллильной группы, т.е. она присоединяется к бензольному кольцу g -углеродным атомом.
Из этого следует, что переходное состояние перегруппировки Кляйзена должно быть циклическим шестизвенным. Такое переходное состояние включает шесть p -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия аналогична изомеризации кетона в енольную форму.
2,4-Циклогексадиенон является интермедиатом перегруппировки аллилариловых эфиров. Такой интермедиат может быть выделен при перегруппировке аллилового эфира 2,6-диметилфенола, когда аллильная группа мигрирует в пара-положение, поскольку енолизация кетона в фенол в этом случае не может происходить из орто-положения. Конечным результатом двух последовательных миграций аллильной группы является сохранение структуры мигрирующей группы.
Кроме того, при проведении перегруппировки в присутствии малеинового ангидрида 2,4-циклогексадиенон улавливается в виде аддукта диенового синтеза.
Реакции электрофильного замещения в ароматическом кольце
Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто— и пара-положения. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами.
Галогенирование фенолов не требует катализа кислотами Льюиса и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион, который содержит очень сильную активирующую группу –O — . Скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем сам фенол, что облегчает введение второго и третьего атома галогена в орто— и пара-положения.
Бромирование фенола в воде приводит к образованию нерастворимого 2,4,6-трибромфенола. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации 10 -5 М в водном растворе. 2,4,6-Трибромфенол взаимодействует еще с одним молем брома с образованием 2,4,4,6-тетрабромциклогекса-2,5-диенона, окрашенного в желтый цвет.
При обработке продукта этой реакции раствором гидросульфита натрия или другого слабого восстановителя он легко превращается в исходный 2,4,6-трибромфенол.
При бромировании фенола в растворе бромистоводородной кислоты диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол.
Аналогичным образом протекает хлорирование фенола хлором в соляной кислоте, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов.
В качестве галогенирующего агента кроме самих галогенов можно использовать комплексы галогенов с диоксаном, ДМФА.
Во всех случаях соотношение пара/орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании.
Нитрование фенолов разбавленной 20-25%-ной азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов.
Даже в таких мягких условиях нитрование сопровождается окислением фенола и этот процесс становится доминирующим, если для нитрования использовать концентрированную азотную кислоту. Поэтому для получения 2,4,6-тринитрофенола (пикриновой кислоты) используют видоизмененный способ нитрования. Фенол первоначально сульфируют до 4-гидрокси-1,3-бензолдисульфокислоты, а затем нитруют азотной кислотой.
Вторая стадия по существу представляет собой электрофильное ипсо-замещение сульфогруппы на нитрогруппу.
Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и N2O4. Эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе.
Моносульфирование фенола серной кислотой приводит к образованию смеси орто- и пара-изомеров гидроксибензолсульфоксилоты. При 20 о С в реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при 120 о С доля пара-изомера возрастает до 96%.
Изменение в соотношении продуктов сульфирования обусловлено обратимостью реакций, когда в равновесии преобладает термодинамически более стабильный пара-изомер. Сульфирование в орто-положение протекает с большей скоростью, но орто-гидроксибензолсульфокислота легко гидролизуется на исходные реагенты в отличие от пара-изомера, для которого скорость гидролиза мала.
Нитрозирование фенолов осуществляется с помощью азотистой кислоты в воде или уксусной кислоте. Эта реакция отличается очень высокой региоселективностью и замещение идет в пара-положение к гидроксильной группе. Типичное распределение орто— и пара-изомеров при нитрозировании можно проиллюстрировать на примере самого фенола.
Алкилирование и ацилирование по Фриделю-Крафтсу
Так как фенолы взаимодействуют с галогенидами алюминия и другими кислотами Льюиса с образованием солей типа ArOAlCl2, прямое их алкилирование в условиях реакции Фриделя-Крафтса провести не удается. Фенолы алкилируют алкенами и спиртами в условиях кислотного катализа. В качестве катализаторов предпочитают использовать серную, фтористоводородную, фосфорную кислоты или катиониты КУ-2 и другие катионообменные смолы. Таким образом, из крезола и изобутилена в промышленности получают пространственно затрудненный фенол — 2,6-ди-трет-бутил-4-метилфенол (ионол), который широко применяется для стабилизации полимеров.
Аналогично из фенола и изопропилового спирта получается 2,4,6-триизопропилфенол.
Ацилирование фенолов в классических условиях реакции Фриделя-Крафтса комплексом ацилгалогенида и хлорида алюминия приводит к неудовлетворительным результатам, так как ацилированию подвергается гидроксильная группа фенола. Более эффективна такая модификация этого метода, когда в качестве ацилирующего агента используется комплекс карбоновой кислоты и трехфтористого бора. Ацильная группа при этом вводится практически исключительно в пара-положение бензольного кольца. Так, например, фенол при взаимодействии с комплексом уксусной кислоты и BF3 дает пара-гидроксиацетофенон с 95%-ным выходом.
Наиболее общий метод получения гидроксикетонов ароматического ряда основан на перегруппировке Фриса. Ариловые эфиры карбоновых кислот при нагревании с AlCl3 или AlBr3 перегруппировываются в изомерные орто— и пара-гидроксикетоны.
Соотношение орто- и пара-изомеров зависит главным образом от температуры и растворителя. В более жестких условиях преобладает орто-гидроксикетон, а при 20-25 о С — пара-гидроксикетон.
Механизм перегруппировки Фриса, по-видимому, заключается в межмолекулярном ацилировании орто- или пара-положения бензольного кольца арилового эфира комплексом второй молекулы сложного эфира и AlCl3 с образованием ацильного производного гидроксикетона и фенола.
Перегруппировка завершается межмолекулярным переносом ацильной группы к фенолу.
Формилирование – это введение группы СНО (см. лек.35). Синтетически наиболее важными являются формилирование фенолов по Вильсмейеру-Хааку и Реймеру-Тиману.
N-Алкиламиды муравьиной кислоты — N,N-диметилформамид (ДМФА) и N-метилформамид в присутствии хлорокиси фосфора являются региоселективными формилирующими агентами. С помощью этих реагентов альдегидная группа вводится в пара-положение по отношению к ОН -группе. Эту реакцию можно также рассматривать как ацилирование, где роль катализатора (кислоты Льюиса) выполняют хлорокись фосфора (POCl3). Наиболее эффективна система ДМФА-POCl3, в которой ДМФА служит и реагентом, и растворителем. Электрофильным агентом в реакции Вильсмейера-Хаака является иминиевая соль, которая образуется при взаимодействии ДМФА и хлорокиси фосфора.
Иминиевая соль при необходимости может быть выделена в индивидуальном виде, однако обычно ее не выделяют и используют непосредственно после ее образования.
Реакция Вильсмейера-Хаака чрезвычайно проста в экспериментальном отношении и обеспечивает очень высокие выходы ароматических гидроксиальдегидов.
Формилирование фенолов по Реймеру-Тиману достигается при нагревании смеси фенола и большого избытка хлороформа с водным раствором гидроксида натрия при 50-70 о С. Выходы альдегидов обычно невелики и редко превышают 30%, однако метод исключительно прост и доступен в практическом отношении. Главное достоинство реакции Реймера-Тимана заключается в преимущественном образовании орто-, а не пара-изомеров, как это имеет место в реакции Вильсмейера-Хаака.
Механизм включает образование дихлоркарбена как интермедиата. Дихлоркарбен :CCl2 выполняет роль электрофильного агента по отношению к феноксид-иону, образующемуся в щелочной среде. Предполагаемый механизм реакции Реймера-Тимана может быть представлен следующей последовательностью превращений:
Реакция протекает только в сильно щелочной среде при наличии фенольного гидроксила, тогда как простые эфиры фенолов и диалкиланилины не формилируются в этих условиях.
Карбоксилирование феноксид-ионов (реакция Кольбе)
Будучи сильными нуклеофилами феноксид-анионы способны взаимодействовать с таким слабым электрофильным реагентом как оксид углерода (IV). При нагревании сухих фенолятов натрия или лития с СО2 при повышенном давлении, образуются натриевые или литиевые соли салициловой кислоты.
В аналогичных условиях из фенолятов калия, рубидия и цезия получаются только соли пара-гидроксибензойной кислоты.
Такое различие в направлении карбоксилирования Na- и К-солей фенола принято объяснять различием в хелатообразовании этих двух катионов с атомом кислорода CO2 в переходном состоянии реакции, приводящем к салициловой кислоте. Катионы натрия и, особенно, лития значительно более эффективны по сравнению с катионом калия в способности к образованию координационной связи с атомом кислорода.
Предполагается, что для фенолятов калия, рубидия и цезия электрофильная атака осуществляется исключительно в пара-положение без какой-либо координации катиона по атому кислорода.
В отличие от одноатомных фенолов двухатомные и трехатомные фенолы карбоксилируются в более мягких условиях. Так, резорцин карбоксилируется при пропускании СО2 в водный раствор его дикалиевой соли при 50 о С. При этом образуется 2,4-дигидроксибензойная кислота.
Конденсация с альдегидами и кетонами
Фенолы реагируют с формальдегидом в водном растворе в присутствии основания с образованием полимерного продукта, получившего название феноло-формальдегидной смолы, карболита или бакелита.
Взаимодействие феноксид-иона с формальдегидом напоминает альдольную конденсацию с той лишь разницей, что роль нуклеофильного агента вместо енолят-иона выполняет амбидентный феноксид-ион, а карбонильной компонентой является формальдегид.
Подобно альдолям, орто— и пара-изомеры гидроксиметилфенола подвергаются дегидратации с образованием хинонметидов — соединений, родственных орто— и пара-хинонам.
Последующее присоединение феноксид-иона к хинонметиду представляет собой присоединение амбидентного аниона к a , b -непредельному кетону по Михаэлю.
В результате дальнейшей поликонденсации в орто— и пара-положение к гидроксигруппе фенола получается трехмерная структура конечного продукта — бакелита. Бакелит представляет собой прозрачную смолу, в которой линейные звенья связаны «поперечными» связями в пара-положениях.
Фенол конденсируется с ацетоном в кислой среде с образованием так называемого бисфенола А.
Получено много подобных продуктов конденсации фенолов с кетонами. Они находят применение в качестве антиоксидантов и мономеров для получения эпоксидных смол.
Окисление фенолов относится к числу сложных, многостадийных процессов, приводящих к продуктам разного строения. Механизм окисления может сильно меняться в зависимости от строения фенола и природы одно- или двухэлектронного окислителя. Механизм окисления включает стадию образования стабилизированных резонансом ароксильных радикалов.
Направление дальнейших превращений зависит от характера заместителей в ароматическом кольце. При окислении большинства фенолов образуется несколько различных форм димеров в результате образования новых связей С-С между орто—орто, орто-пара- и пара-пара-положениями ароксильных радикалов, а также новых С-О связей между атомом кислорода одного радикала и орто- или пара-положением другой радикальной частицы. Всего, таким образом, образуется потенциально не менее пяти различных типов димеров, которые находится в равновесии с исходным ароксильным радикалом. Например, для монозамещенного фенола:
Димеры, возникающие в результате рекомбинации радикалов с образованием новой С-С связи, называются хинолидами. Хинолиды далее изомеризуются с образованием изомерных дигидроксибифенилов. Другой тип димеров, содержащих центральную связь С-О, носит название хиноловыхэфиров.
Ароксильные радикалы пространственно затрудненных фенолов, содержащие в обоих орто- и пара-положении третичные алкильные группы, мономерны и не проявляют тенденции к образованию димеров в растворе. Например, при окислении 2,4,6-три-трет-бутилфенола гексацианоферратом(III) калия K3Fe(CN)6 в бинарной системе бензол-вода в инертной атмосфере образуется устойчивый радикал одновалентного кислорода — три-трет-бутилфеноксил, окрашенный в синий цвет.
Этот радикал находится в мономерной форме в 0,1 молярном растворе в бензоле или эфире, а также в кристаллическом состоянии. Он очень чувствителен к действию кислорода воздуха, оксида азота (IY), оксида азота (II) и других радикальных частиц. Стабильность ароксильных радикалов пространственно затрудненых фенолов обусловливает их антиокислительные свойства. Они выполняют роль ловушек свободных радикалов в процессах пероксидного окисления. Активный свободный радикал, ведущий цепь окисления, быстро взаимодействует с таким фенолом, давая устойчивый ароксильный радикал, что приводит к обрыву цепи.
ArOH + RO2 s ® ArO s + ROOH
Пространственно затрудненные фенолы (ионол, гальваноксил) используют как антиоксиданты, стабилизирующие синтетические каучуки, пищевые жиры, витамины и др.
Видео:Фенолы. Получение. 10 класс.Скачать
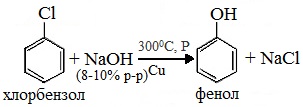
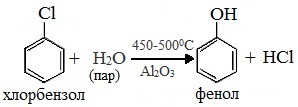
Получение фенола из хлорбензола уравнение реакции
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Получение фенола в промышленности
1. Кумольный способ
(СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
1 стадия – получение кумола
2 стадия – каталитическое окисление
2. Из каменноугольной смолы (как побочный продукт – выход небольшой)
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами
или с водяным паром
4. Сплавлением солей аренсульфокислот с твёрдыми щелочами
💡 Видео
6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА, ФЕНОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать
Определите массу (г) бензола, если при получении из ацетилена бензола (выход реакции 50), из бензолСкачать

Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

Определите массу (г) участвовавшего в реакции пропилена, если при получении из ацетилена бензолаСкачать

Получение бензола и его гомологов. 2 часть. 11 класс.Скачать