Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
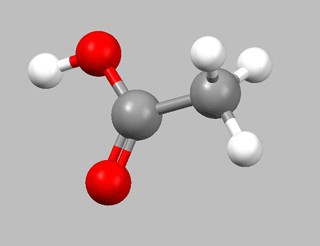
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать  Этановая кислота. Физические свойства, получение и применениеЭтановая кислота (другое название — уксусная) — это органическое вещество, представляющее собой предельно основную, слабую, карбоновую кислоту. Производные данной кислоты называются ацетатами. При помощи этого вещества можно получить метиловый эфир этановой кислоты: этаналь + этановая кислота = метиловый эфир. Физические свойства этановой кислоты 1. Этановая кислота (формула — CH3COOH) представляет собой жидкость без цвета со специфическим запахом и неприятным кислым вкусом. Этановую кислоту можно получить несколькими способами: 1. Путем окисления ацетальдегида кислородом из воздуха. Данный процесс возможен только в присутствии катализатора — марганца ацетата при температуре от 50 до 60 градусов. Реакция выглядит так: 2CH3CHO (ацетальдегид) + O2 (кислород) = 2CH3COOH (этановая кислота) 2. В промышленности используют окислительные способы. Раньше для получения этановой кислоты применяли окисление бутана и ацетальдегида. Ацетилальдегид окисляли только в присутствии марганца ацетата при повышенном давлении и температуре. При этом выход этановой кислоты составлял около девяноста пяти процентов. 2CH3CHO + O2 = 2CH3COOH Н-бутан окисляли при температуре от 150 до 200 градусов. При этом ацетат кобальта выполнял роль катализатора. 2C4H10 + 5O2 = 4CH3COOH + 2H2O Но в результате значительного повышения цен на нефть оба эти способа стали невыгодными и вскоре оказались вытеснены более эффективными способами карбонилирования метанола. 3. Карбонилирование метанола каталитическое — это важный способ синтеза этановой кислоты. Происходит по условному уравнению: CH3OH + CO = CH3COOH 4. Также существует биохимический способ получения, при котором используется способность микроорганизмов окислять этанол. Данный процесс называется уксуснокислым брожением. При этом в качестве сырья используют водный эфир спирта этилового или этанолосодержащие жидкости (забродившие соки). Это многоступенчатый сложный процесс. Его можно описать следующим уравнением: — водные растворы этановой кислоты применяются в пищевой промышленности, кулинарии и в консервировании; — этановая кислота используется для создания душистых веществ и лекарственных препаратов (ацетон, ацетилцеллюлоза); — применяется в крашении и книгопечатании; — в качестве реакционной среды для окислении некоторых органических веществ (окисление сульфидов пероксидом водорода); — так как пары этановой кислоты обладают неприятным резким запахом, то его можно использовать вместо нашатырного спирта. Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Составить уравнения хим. реакций, с помощью которых можно получить этановую кислоту из этана.Видео:Получение этилена из этилового спиртаСкачать  Ваш ответВидео:Получение концентрированной азотной кислотыСкачать  решение вопросаВидео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Похожие вопросы
Популярное на сайте: Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах. Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте. Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так. Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью. 🎬 ВидеоРешение задач на термохимические уравнения. 8 класс.Скачать  7.3. Спирты: Способы получения. ЕГЭ по химииСкачать  11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать  Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать  РЕАКЦИЯ ЭТЕРИФИКАЦИИСкачать  Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Хлороводородная кислота. 9 класс.Скачать  Синтез ЭтилацетатаСкачать  Реакция этерификации. Химический опытСкачать  Получение концентрированной уксусной кислоты.Скачать  Получение ледяной уксусной кислоты/Synthesis of glacial acetic acidСкачать  11.1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  Несколько лайфхаков со спиртом. Химия – просто.Скачать  7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  |