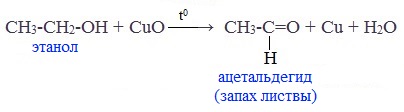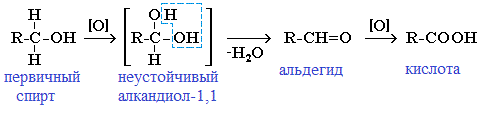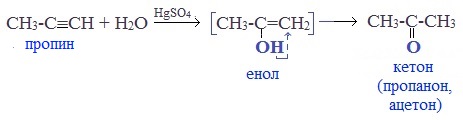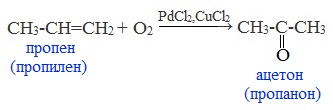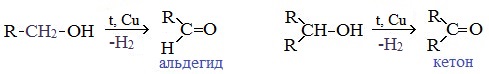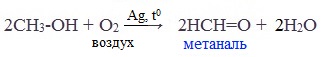1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
При окислении первичных спиртов образуются альдегиды:
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
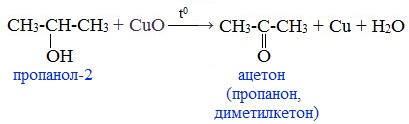
При окислении вторичных спиртов образуются кетоны:
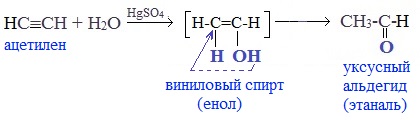
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
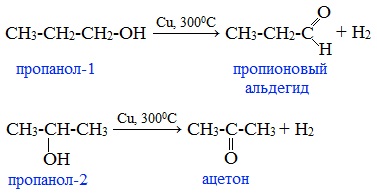
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. al conol dehyd rogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
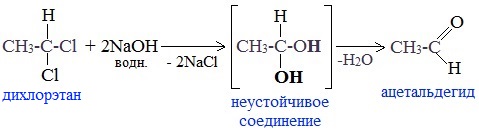
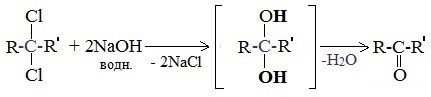
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Это лабораторный способ получения карбонильных соединений.
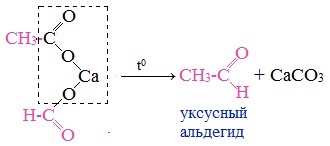
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
Это лабораторный способ получения карбонильных соединений.
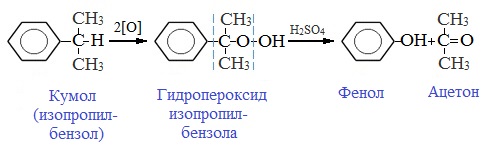
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
- Получение формальдегида
- Acetyl
- Получение этаналя из соответствующего спирта уравнение реакции
- Этаналь
- Строение
- Физические свойства
- Получение
- Процесс Вакера
- С дигалогенопохидних
- С этанола
- С ацетилена
- Химические свойства
- Нуклеофильное присоединение
- Взаимодействие с цианидами металлов
- Взаимодействие с водой
- Взаимодействие со спиртами
- Взаимодействие с аминами
- Восстановление
- Альдольно-кротоновая конденсация
- Реакции окисления
- Реакция «серебряного зеркала»
- Окисления гидроксидом меди
- Галогенирования
- Полимеризация
- Взаимодействие с аммиаком
- Применение
- Физиологическое действие
- Животные
- Человек
- Попадание в организм и преобразования
- 🌟 Видео
Получение формальдегида
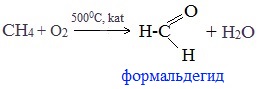
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Видео:Опыты по химии. Окисление спирта в альдегидСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Опыты по химии. Получение этилена и опыты с нимСкачать  Получение этаналя из соответствующего спирта уравнение реакцииЛ/О № 5 «Получение этаналя окислением этанола». Цель: изучить свойства получения этаналя окислением этанола в лабораторных условиях. Оборудование: виртуальная лаборатория , учебник 10 класса, штатив с пробирками, этанол, медная проволока, спиртовка, деревянный держатель Выполнение работы по инструкции. B пробирку налейте не более 0,5—1 мл этанола и погрузите в него раскаленную спираль из медной проволочки. Задание для самостоятельного вывода. Какие вещества образуются при взаимодействии этанола с оксидом меди( II )? Напишите уравнение реакции.
Номер материала: ДБ-1160890 ВНИМАНИЮ УЧИТЕЛЕЙ: хотите организовать и вести кружок по ментальной арифметике в своей школе? Спрос на данную методику постоянно растёт, а Вам для её освоения достаточно будет пройти один курс повышения квалификации (72 часа) прямо в Вашем личном кабинете на сайте «Инфоурок». Пройдя курс Вы получите: Пройдите дистанционный курс «Ментальная арифметика» на проекте «Инфоурок»! Низкая стоимость обучения Не требуется ЕГЭ
Не нашли то что искали? Вам будут интересны эти курсы: Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение редакции может не совпадать с точкой зрения авторов. Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако редакция сайта готова оказать всяческую поддержку в решении любых вопросов связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи. Фармацевтика, медицина, биология Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать  ЭтанальЭтаналь (уксусный альдегид) — второй член гомологического ряда алифатических альдегидов. Бесцветная жидкость с резким удушливым запахом, при разбавлении водой приобретает фруктового запаха. Промежуточный продукт обмена веществ в живом организме. Применяется для производства ацетатов целлюлозы, уксусной кислоты, бутанола и др. Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  СтроениеВ этаналя, как и у любого другого альдегида, три атома соединены с центральным тригонально атомом (а именно: атом кислорода, атом водорода и атом углерода). Все они лежат в одной плоскости с этим тригонально атомом. Все углы связей тригонального атома с этими атомами близки к 120 °. В карбонильной группе есть очень большая разница в электроотрицательности между атомами углерода и кислорода. Это отражается в большом дипольном моменте уксусного альдегида. Электроны связи распределены неравномерно, поэтому молекула этаналя сильно полярная. Для качественного описания природы связи в карбонильной группе обычно используют представление о двойной связь, содержащая σ- и π-компоненты с двумя парами несвязанных (n) электронов у атома кислорода. Принято, что тригонально атом углерода находится в состоянии sp 2 гибридизация и образует σ-связь с водородом и другим атомом углерода. Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать  Физические свойстваЭтаналь, как и все альдегиды, не способен образовывать водородных связей, поэтому его температура кипения составляет лишь 20,16 ° C. При обычных условиях — это бесцветная жидкость с резким удушливым запахом, при разбавлении водой приобретает фруктового запаха. Хорошо растворяется в воде, спирте, эфире. Видео:Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  ПолучениеПроцесс ВакераГлавным промышленным способом получения уксусного альдегида является процесс Вакера. Он заключается в окислении этилена, который получают при крекинга углеводородов. Этот способ имеет гораздо большее значение, чем окисления, каталитическая дегидрогенизация этанола или гидратация ацетилена. В процессе Вакера этилен окисляют в водном растворе, хлорид меди (II) и хлорид палладия (II). В одностадийном варианте катализатор регенерируют кислородом в условиях непрерывного синтеза, в двухстадийном варианте катализатор регенерируют воздухом в отдельном реакторе. Реакция катализируется палладием. С дигалогенопохиднихВ результате гидролиза дигалогенопохидних с двумя атомами галогена при одном атоме углерода образуются двухатомные спирты, содержащие две гидроксильные группы также при одном атоме углерода. Такие диолы крайне неустойчивы и легко отщепляют молекулу воды. Таким образом с 1,1-дихлорэтана можно получить этаналь. С этанолаПри окислении этанола кислородом воздуха при температуре 300-500 ° С при наличии катализаторов, а также такими окислителями, как хромовая смесь, оксид хрома (VI), марганца (IV) оксид и др., Образуется уксусный альдегид. Данный процесс довольно сложно остановить на стадии образования альдегида и он может длиться до получения уксусной кислоты. С этанола этаналь можно получить и дегидрогенизации. Для этого испарения спирта необходимо пропустить над катализаторами (цинк, медь) при высоких температурах. С ацетиленаЭтаналь можно получить гидратацией ацетилена. В качестве катализаторов в процессе применяются соли ртути. Видео:Реакции окисления этанола. Опыт 4Скачать  Химические свойстваНуклеофильное присоединениеВзаимодействие с цианидами металловПри взаимодействии этаналя с солями цианидной кислоты образуются гидроксинитрилы. Сама синильная кислота малодиссоциированных. Поэтому реакцию проводят в щелочной среде, где образуется цианид-ион, который является активной нуклеофильного частью. Реакция является весьма важной в органической химии. Во-первых, она позволяет продлить карбоновый цепь исходного соединения на один атом углерода. Во-вторых, продукт реакции — 2-гидроксипропанонитрил служит исходным продуктом для синтеза соответствующей гидроксикарбоновои кислоты. Взаимодействие с водойУксусный альдегид вступает в обратимую реакцию гидратации, образуя соответствующий гидрат. Этаналь в водном растворе гидратированный на 51%. Взаимодействие со спиртамиСпирты, как и вода, обратимо присоединяются к этаналя с образованием пивацеталей. В спиртовых растворах пивацетали находятся в равновесии с уксусным альдегидом. Так, в этанольная растворе этаналя содержится около 30% пивацеталю (1-етоксиетанолу) (в расчете на альдегид). При взаимодействий со второй молекулой спирта в условиях кислотного катализа пивацетали превращаются в ацетали. Взаимодействие с аминамиНа первой стадии реакции происходит нуклеофильное присоединение амина по двойной связи карбонильной группы. Первичным продуктом присоединения является биполярный ион, который стабилизируется в результате внутримолекулярного переноса протона от атома азота к атому кислорода, превращаясь в аминоспирт. Однако реакция не останавливается на этой стадии, ведь соединения, содержащие две электроноакцепторные группы при одном атоме углерода, неустойчивы и стремятся к стабилизации путем отщепления одной из групп в виде нейтральной термодинамически стабильной молекулы. В данном случае происходит отщепление молекулы воды от молекулы аминоспирта и образуется имин (основа Шиффа). Подобно взаимодействия с первичными аминами проходят реакции этаналя с такими производными аммиака, как гидроксиламин, гидразин, фенилгидразин C 6 H 5 NHNH 2 и др. Образующиеся производные уксусного альдегида — оксимы, гидразоны, фенилгидразоны — обычно устойчивы кристаллическими веществами с четкими температурами плавления. ВосстановлениеЭтаналь восстанавливается до этанола. Одним из эффективных восстановителей является алюмогидрида лития LiAlH 4. Он играет роль поставщика гидрид-ионов H -, которые являются нуклеофильными частицами и присоединяются по двойной связи. Для преобразования образованного сначала алкоксид-иона в спирт после окончания восстановления в реакционную среду добавляют воду. В промышленности этаналь превращают в этанол в результате каталитической гидрогенизации. Реакцию проводят, пропуская пары альдегида в смеси с водородом над никелевым или палладиевого катализатора. Альдольно-кротоновая конденсацияВ результате взаимодействия в щелочной среде двух молекул этаналя образуется 3-гидроксибутаналь. Поскольку продукт реакции содержит в молекуле гидроксильную и альдегидную группы, его назвали альдоль (от слов альдегид и алкоголь), а сама реакция конденсации оксосоединений в щелочной среде получила название альдольной конденсации. Эта реакция имеет большое значение в органическом синтезе, поскольку позволяет синтезировать различные гидроксикарбонильни соединения. Альдольно конденсацию можно проводить в смешанном варианте, с использованием различных карбонильных соединений. Часто альдольная конденсация сопровождается отщеплением воды и образованием α, β-ненасыщенного карбонильной соединения. В таком случае реакция называется кротонов конденсацией. Такое происходит часто, когда реакцию проводят при повышенной температуре. Реакции окисленияРеакция «серебряного зеркала»Одной из качественных реакций для определения альдегидной группы реакция «серебряного зеркала» — окисление альдегида аргентум (I) оксидом. Оксид серебра всегда готовят непосредственно перед опытом, добавляя к раствору аргентум (I) нитрата раствор гидроксида щелочного металла. В растворе аммиака аргентум (I) оксид образует комплексное соединение под названием гидроксид диаминсрибла или реактив Толленса. При действии этого соединения на этаналь происходит окислительно-восстановительная реакция. Уксусный альдегид окисляется до уксусной кислоты, а катион Аргентума восстанавливается в металлическое серебро, которое дает блестящий налет на стенках пробирки — «серебряное зеркало». Окисления гидроксидом медиЕще одна качественная реакция на альдегиды заключается в их окислении гидроксида меди (II). При окислении альдегида меди (II) гидроксид, что имеет светло-голубой цвет, восстанавливается до гидроксид меди (I) желтого цвета. Этот процесс проходит при комнатной температуре. Если подогреть исследовательский раствор, то меди (I) гидроксид желтого цвета превращается в оксид меди (I) красного цвета. ГалогенированияНаличие в молекуле этаналя електроноакцепторний оксогруппы является причиной повышенной реакционной способности атомов водорода, находящихся у атомов углерода в α-положении. Они способны замещаться на атомы галогена. ПолимеризацияУксусный альдегид подобно формальдегида способен полимеризоваться при наличии следов кислоты. При полимеризации трех молекул этаналя образуется паральдегид — жидкость с температурой кипения 124,5 ° С. При нагревании при наличии кислот он деполимеризуется с образованием исходного уксусного альдегида. Взаимодействие с аммиакомУксусный альдегид реагирует с безводным аммиаком в эфире, давая тригидрат гексагидротриазину, который после дегидратации над серной кислотой образует 2,4,6-триметилгексагидро-1,3,5-триазин, азотный аналог «паральдегида». В промышленности этаналь окисляют до уксусной кислоты и пероцтовои кислоты воздухом. Для получения уксусной кислоты окисления обычно проводят в испарениях и при повышенной температуре. Для получения пероцтовои кислоты реакцию проводят при 0 ° С или при более низкой температуре в растворителе. Как промежуточный продукт образуется 1-гидроксиетилперацетат, который разлагается с образованием пероцтовои кислоты и уксусного альдегида. Последний возвращают в цикл. Видео:ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  ПрименениеЭтаналь применяют в промышленности для производства ацетатов целлюлозы, уксусной и пероцтовои кислот, уксусного ангидрида, этилацетата, глиоксаля, 2-етилгексанолу, алкиламинов, бутанола, пентаэритрита, алкилпиридинив, 1,3-бутиленгликоль, хлорала. Также используется как восстановитель в производстве зеркал. Мировое производство в 1982 году составило 2 млн т / год (без СССР). Видео:Задачи по химии. Получение уксусного альдегида. Стехиометрические цепочкиСкачать  Физиологическое действиеЖивотныеДля белых мышей при 2-часовой экспозиции ЛК 50 = 21,8 мг / л, при введении в желудок ЛД 50 = 1232 мг / кг. Основные симптомы отравления — расстройство дыхания, раздражение слизистых оболочек. Вдыхание этаналя концентрацией 0,5 мг / л в течение семи часов вызывает заметное раздражение слизистых оболочек у кошек. При 2 мг / л — сильное раздражение, а 20 мг / л через 1-2 часа вызывает смерть. Вскрытие показывает отек и воспаление легких. Крысы и морские свинки переносили введение дозы 100 мг / кг в течение 6 месяцев. При этом отмечалось нарушение условнорефлекторной деятельности, повышение артериального давления. Те же изменения вызвала доза 10 мг / кг через 2-3 месяца. ЧеловекПорог восприятия запаха составляет 0,0001 мг / л, а уже при 0,004 мг / л ощущается резкий запах. Кроме легкого раздражения слизистых оболочек от 0,1-0,4 мг / л при хроническом воздействии этаналя других патологических изменений не отмечалось. При больших концентрациях наблюдается учащение пульса, ночное потоотделение. При очень больших — удушье, резкий кашель, головные боли, бронхит, воспаление легких. Возможно привыкание к небольших концентраций. Попадание в организм и преобразованияЗадерживается в дыхательных путях кролика в среднем на 60%, около 25% абсорбируется в верхних дыхательных путях. В организме окисляется до уксусной кислоты, которая вступает в нормальный обмен и сгорает в и. Скорость метаболизма большая и кроликов составляет 7-10 мг / мин .. Промежуточным продуктом окисления является ацетон. 1. Можно окислением перманганатом калия. 2. Окислением оксидом меди (II) — это качественная реакция на определение одноатомных спиртов: В результате реакции восстанавливается медь и слышен запах альдегида 🌟 Видео10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать  Получение уксусного альдегидаСкачать  7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  Вся теория по спиртам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  Химические свойства альдегидов и кетонов. 11 класс.Скачать  Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать  70. Получение альдегидовСкачать  Способы получения предельных одноатомных спиртовСкачать  Получение альдегидов и кетонов. 11 класс.Скачать  |