Реактивы и оборудование: этиловый спирт, серная кислота (конц.), пробирка, спиртовка, пробиркодержатель.
В сухую пробирку вводят 2 капли этилового спирта и 2 капли серной кислоты. Смесь осторожно нагревают над пламенем горелки до побурения раствора. К горячей смеси очень осторожно добавляют еще 2 капли этилового спирта. Ощущается характерный запах диэтилового эфира.
4. Взаимодействие глицерина с гидроксидом меди (ІІ)
Реактивы и оборудование: глицерин, 2 н. раствор сульфата меди, едкий натр 2н. р-р, пробирки, пипетки.
Помещают в пробирку 2 капли раствора сульфата меди, 2 капли раствора едкого натра, перемешивают, образуется голубой студенистый осадок гидроксид меди (ІІ). В пробирку добавляют 1 каплю глицерина и взбалтывают содержимое. Осадок растворяется и появляется темно- синее окрашивание вследствие образования глицерата меди


HC-OH + HO-Cu-OH + HO-CH → HC-O O-CH + H2O
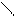
5. Реакция фенола с хлоридом железа (ІІІ)
Обратите внимание! При работе с фенолом нельзя допускать его попадания на кожу, он вызывает ожоги. Если это случилось, необходимо промыть пораженное место обильно теплой водой. После выполнения опытов содержимое всех пробирок выливают только в специальный слив (банки). Хорошо промойте пробирки.
Реактивы и оборудование: хлорид железа (ІІІ) 0,1н.р-р., фенол кристаллический, салициловая кислота, пробирки, пипетки.
В пробирку помещают 2 капли раствора фенола (кристаллики фенола растворяют в воде), добавляют 3 капли воды,1 каплю хлорида железа. Появляется интенсивное красно-фиолетовое окрашивание. Фенолы с хлоридом железа в водном растворе дают цветную реакцию, вследствие образования окрашенного соединения C6H5OFeCl2 или точнее, окрашенного иона C6H5OFe 2+ .Данная реакция служит для качественного открытия фенола.
Аналогичный опыт проводят с водным раствором салициловой кислоты. Для этого в воде растворяют небольшое количество (на кончике лопатки) салициловой кислоты добавляют 1 каплю хлорида железа.
1. Напишите формулу спиртов и фенолов:
б) 2,4- диметилпентанол-3;
2. Напишите уравнения реакций:
а) окисления бутанол-2;
б) межмолекулярной дегидратации изопропилового спирта.
3. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
б) бутилхлорид → бутанол-2.
4. При помощи, каких химических реакций можно отличить друг от друга этиловый спирт, глицерин и фенол? Составьте уравнения реакций.
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: СаС2 → С2Н2 →С6Н6 →С6Н5Сl →С6Н5ОН→С6Н5ОNа
Отчёт должен содержать тему лабораторной работы, цель, химизм процесса и выводы после каждого опыта и общий вывод по работе согласно поставленной цели. Все наблюдения должны быть оформлены в следующую таблицу:
- Этиловый эфир, свойства, структура, получение, использование
- Структура этилового эфира
- Межмолекулярные силы
- Этанол: химические свойства и получение
- Строение этанола
- Водородные связи и физические свойства спиртов
- Изомерия спиртов
- Структурная изомерия
- Химические свойства этанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление этанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование этанола
- Получение этанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Получение этанола спиртовым брожением глюкозы
- 📽️ Видео
Видео:Синтез диэтилового эфираСкачать

Этиловый эфир, свойства, структура, получение, использование
этиловый эфир, также известный как диэтиловый эфир, является органическим соединением, химическая формула которого C4H10О. Он характеризуется тем, что является бесцветной и летучей жидкостью, поэтому его бутылки должны быть как можно плотнее закрыты..
Этот эфир классифицируется как член диалкиловых эфиров; то есть они имеют формулу ROR ‘, где R и R’ представляют разные углеродные сегменты. И как он описывает свое второе имя, диэтиловый эфир, это два радикала-этила, которые связываются с атомом кислорода.
Первоначально этиловый эфир использовался в качестве общего анестетика, введенного в 1846 году Уильямом Томасом Грином Мортоном. Однако, из-за его воспламеняемости, его использование было отклонено, заменив его другими менее опасными анестетиками..
Это соединение также использовалось для оценки времени кровообращения, при оценке состояния сердечно-сосудистой системы пациентов..
В организме диэтиловый эфир может превращаться в углекислый газ и метаболиты; последние в конечном итоге выводятся с мочой. Однако большая часть вводимого эфира выдыхается в легких без каких-либо изменений..
С другой стороны, он используется в качестве растворителя для мыла, масел, парфюмерии, алкалоидов и камеди.
- 1 Структура этилового эфира
- 1.1 Межмолекулярные силы
- 2 Физические и химические свойства
- 2.1 Другие имена
- 2.2 Молекулярная формула
- 2.3 Молекулярный вес
- 2.4 Внешний вид
- 2.5 Запах
- 2.6 Вкус
- 2.7 Точка кипения
- 2.8 Точка плавления
- 2.9 Температура вспышки
- 2.10 Растворимость в воде
- 2.11 Растворимость в других жидкостях
- 2.12 Плотность
- 2.13 Плотность пара
- 2.14 Давление пара
- 2.15 Стабильность
- 2.16 Автоматическое зажигание
- 2.17 Разложение
- 2.18 Вязкость
- 2.19 Теплота сгорания
- 2.20 Тепло испарения
- 2.21 Поверхностное натяжение
- 2.22 Потенциал ионизации
- 2.23 Порог запаха
- 2.24 Показатель преломления
- 3 Получение
- 3.1 Из этилового спирта
- 3.2 Из этилена
- 4 Токсичность
- 5 использует
- 5.1 Органический растворитель
- 5.2 Общая анестезия
- 5.3 Дух эфира
- 5.4 Оценка кровообращения
- 5.5 Учебные лаборатории
- 6 Ссылки
Видео:Синтез диэтилового эфира (synthesis of diethyl ether)Скачать

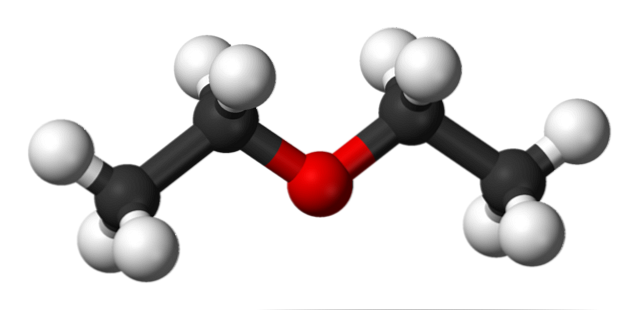
Структура этилового эфира
На изображении выше мы имеем представление с моделью сфер и стержней молекулярной структуры этилового эфира.
Как видно, красная сфера, соответствующая атому кислорода, имеет две этильные группы, связанные с обеих сторон. Все звенья простые, гибкие и свободно вращаются вокруг осей σ.
Эти вращения происходят из стереоизомеров, известных как конформеры; что больше, чем изомеры, они являются альтернативными пространственными состояниями. Структура изображения точно соответствует антиконформеру, в котором все его группы атомов расположены в шахматном порядке (отделены друг от друга).
Каким был бы другой конформер? Затмение, и хотя ваше изображение недоступно, просто визуализируйте его с помощью формы U. На верхних концах U будут расположены метильные группы -CH3, которые будут испытывать стерические отталкивания (они сталкиваются в космосе).
Следовательно, ожидается, что молекула СН3СН2ОСН2СН3 принять анти-конформации большую часть времени.
Межмолекулярные силы
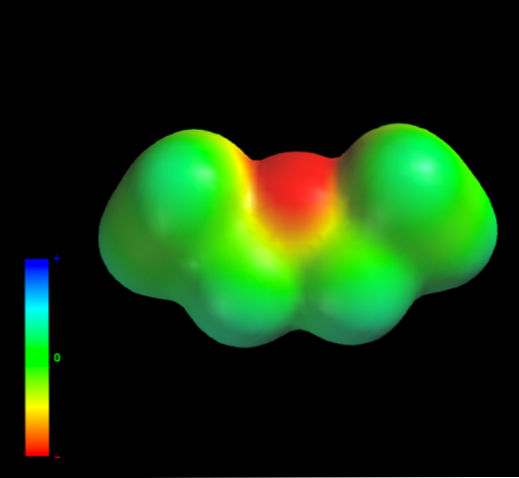
Какими межмолекулярными силами управляют молекулы этилового эфира в жидкой фазе? Они поддерживаются в жидкости главным образом благодаря дисперсионным силам, поскольку в их дипольном моменте (1,5D) отсутствует область, достаточно дефицитная по электронной плотности (δ +).
Это потому, что ни один атом углерода в этильных группах не дает слишком много электронной плотности для атома кислорода. Сказанное выше видно на карте электростатического потенциала этилового эфира под рукой (нижнее изображение). Обратите внимание на отсутствие синей области.
Кислород также не может образовывать водородные связи, опять же, потому что в молекулярной структуре нет доступных О-Н связей. Следовательно, мгновенные диполи и их молекулярная масса способствуют их силам рассеивания..
Несмотря на это, он хорошо растворяется в воде. Почему? Поскольку его атом кислорода, с более высокой электронной плотностью, может принимать водородные связи от молекулы воды:
Эти взаимодействия ответственны за растворение 6,04 г этого эфира в 100 мл воды..
Видео:Где взять диэтиловый эфир?Скачать

Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Опыты по химии. Получение сложного эфираСкачать

Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Видео:Получение диэтилового эфира.Скачать

Изомерия спиртов
Видео:Получение этилена из этилового спиртаСкачать

Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Видео:Очистка ДИЭТИЛОВОГО ЭФИРАСкачать

Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Видео:Простые эфиры. Получение. Все 4 реакции ЕГЭ.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Видео:13.3. Сложные эфиры: Химические свойстваСкачать

Видео:Получение диэтилового эфираСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
Видео:Как получить этиловый спирт?Скачать

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
Видео:7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Видео:Абсолютный спирт. Химия – ПростоСкачать

Получение этанола
Видео:Диэтиловый эфир С2Н5 О С2Н5 Невероятно летучая и легковоспламеняющаяся жидкостьСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Видео:Получение спиртов с помощью реактивов Гриньяра, часть 1Скачать

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
Видео:Способы получения предельных одноатомных спиртовСкачать

Видео:65. Что такое реакция гидратации и реакция дегидратацииСкачать

4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
📽️ Видео
8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать