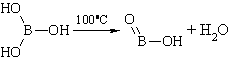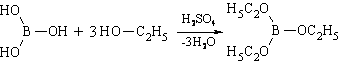ЛП неорганической природы
SHAPE * MERGEFORMAT
Acidum boricum – Кислота борная
Описание. Белые блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха. Летуч с парами воды и спирта. При продолжительном нагревании (до 100°С) теряет часть воды, переходя в метаборную кислоту ( HBO 2 ), при более сильном нагревании образуется стекловидная масса ( H 2 B 4 O 7 ), которая при дальнейшем нагревании, вспучиваясь, теряет всю воду и переходит в борный ангидрид ( B 2 O 3 ) бурого цвета. Водный раствор имеет слабокислую реакцию.
Растворимость. Растворим в 25 ч. воды, в 4 ч. кипящей воды, в 25ч. спирта, медленно в 7 частях глицерина.
Получение. Из природных минералов: ашарит ( Mg 2 B 2 O 5 ∙ H 2 O ), сассолин ( H 3 BO 3 ), бура ( Na 2 B 4 O 7 ∙10 H 2 O ), борокальций ( CaB 4 O 7 ∙10 H 2 O ):
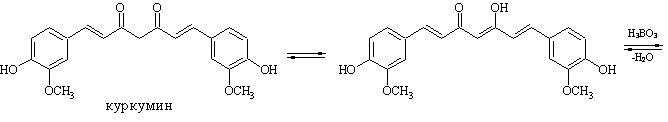
1. Реакция с куркумином (ГФ Х). Куркумовая бумага, смоченная раствором препарата и раствором соляной кислоты, окрашивается при высушивании в розовый или буровато-красный цвет, переходящий от смачивания раствором аммиака в зеленовато-черный:
SHAPE * MERGEFORMAT
SHAPE * MERGEFORMAT
Недопустимо присутствие Fe , Mo , W (образуют комплексы подобного цвета).
2. Образование борноэтилового эфира (ГФ Х) , горящего пламенем с зеленой каймой:
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо, тяжелые металлы, кальций.
Количественное определение (ГФ Х). Прямая алкалиметрия.
Титрант – NaOH , индикатор – фенолфталеин, среда – глицерин.
f экв ( H 3 BO 3 )=1, 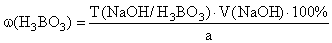
Видео:КАК СДЕЛАТЬ БУРУ ( ТЕТРАБОРАТ на́трия ), ДЛЯ ПЛАВКИ МЕТАЛЛОВ ДОМА ?Скачать

§ 1. Бор
Элемент этот принадлежит к числу довольно распространенных: содержание его в земной коре составляет около 5·10 –4 % – Скопления бора встречаются в виде кислородных соединений – борной кислоты (H3 BO3 ), буры (Na2 B4 O7 ·10Н2 О), ашарита (MgHBO3 ) и ряда более сложных минералов. Ежегодная мировая добыча соединений бора достигает 300 тыс. т. Важнейшими из них являются бура и борная кислота.
1) Борная кислота используется при эмалировании железных сосудов (вводится в состав эмалей) и в медицине (дезинфицирующие полоскания и т. д.), а также служит обычным исходным продуктом для получения остальных соединений бор»а. Бура применяется в ряде отраслей промышленности – стекольной, керамической, кожевенной и др. – из медицине.
В свободном состоянии бор может быть получен из борной кислоты. Нагреванием ее переводят в борный ангидрид (В2 О3 ), который затем накаливают с металлическим магнием:
После обработки продуктов реакции соляной кислотой (для удаления MgO) остается элементарный бор В чистом состоянии он имеет черный цвет, плотность 2,3, плавится при 2075°С и кипит при 3960°С.
В обычных условиях бор весьма инертен. Напротив, при высоких температурах он соединяется не только с кислородом, хлором и бромом, но также с серой и азотом. При очень сильном накаливании бор вытесняет свободные элементы даже из таких устойчивых окислов, как Р2 О5 , СО2 и SiO2 , а также из окислов многих металлов. При сплавлении бора с некоторыми из последних образуются бориды этих металлов, например борид магния – Mg3 B2 .
По отношению к воздуху и воде бор вполне устойчив. В обычных кислотах он не растворяется, но горячая концентрированная HNO3 постепенно окисляет его до борной кислоты:
Во всех устойчивых соединениях бор трехвалентен.
Наиболее характерны для бора кислородные соединения. При нагревании на воздухе до 700°С он сгорает по уравнению:
Образующийся борный ангидрид представляет собой бесцветную, довольно тугоплавкую стекловидную массу.
На воздухе В2 О3 притягивает влагу, а в воде растворяется с образованием борной кислоты.
Борная (точнее – ортоборная) кислота представляет собой бесцветные кристаллы. При нагревании она теряет воду и переходит сначала в метаборную кислоту (НВО2 ), затем в тетраборную (Н2 В4 О7 ) и, наконец, в борный ангидрид. Растворение этих веществ в воде сопровождается их переходом в Н3 ВО3 .
Диссоциация гидрата В(ОН)3 в растворе идет по кислотному типу. Однако борная кислота очень слаба и поэтому из растворов своих солей легко выделяется большинством других кислот. Соли ее (борнокислые, или бораты) производятся обычно от различных полиборных кислот общей формулы xВ2 О3 ·yН2 О, чаще всего – тетраборной (х = 2, y = 1). Последняя является кислотой значительно более сильной, чем ортоборная.
Избытком щелочи они могут быть переведены в метабораты: 2NaOH + Na2 B4 O7 = 4NaBO2 + Н2 О
С другой стороны, при действии на тетрабораты (или метабораты) сильных кислот выделяется свободная ортоборная кислота:
В воде из боратов растворимы только соли наиболее активных одновалентных металлов. Вследствие гидролиза растворы их показывают сильнощелочную реакцию. Важнейшим для практики боратом является бура.
Так как безводные бораты чрезвычайно устойчивы по отношению к нагреванию, при высоких температурах борная кислота выделяет большинство других кислот из их солей. В этом отношении (как и по своей слабости) она похожа на кремневую кислоту.
2) Борная кислота (K1 = 6·10 –10 , K2 = 2·10 – 13 , K3 = 2·10 –14 ) окрашивает пламя в зеленый цвет и несколько летуча с водяным паром, Тетраборной кислоте (K1 = 2·10 –4 , K2 = 2·10 –5 ) может быть придана структурная формула:
Из солей различных полиборных кислот многие встречаются в природе и служат исходными продуктами для получения соединений бора.
3) Сульфид бора (B2 S3 ) образуется в виде бесцветной стекловидной массы при накаливании бора в парах серы. Водой он полностью разлагается на борную кислоту и H2 S. С азотом бор соединяется только выше 1200 °С. Нитрид бора (BN) представляет собой белый порошок, плавящийся лишь около 3000 °С (под давлением). По кристаллической структуре BN сходен с графитом.
Карбид бора (В4 С) образуется в виде черных блестящих кристаллов принакаливании смеси бора (или В2 О3 ) с углем в электрической печи. Он отличается тугоплавкостью (т. пл. 2550 °С) и чрезвычайной твердостью (близкой к твердости алмаза). И нитрид и карбид бора характеризуются большой устойчивостью по отношению к различным химическим воздействиям.
Галоидные соединения бора общей формулы ВГ3 могут быть получены путем взаимодействия элементов при нагревании. Они представляют собой бесцветные вещества. При обычных условиях BF3 газообразен, ВСl3 кипит при + 18°С, ВВr3 – жидкость и BJ3 –твердое тело. В водном растворе все они подвергаются гидролизу по схеме:
Для галогенидов бора весьма характерны реакции присоединения к ним молекул различных других веществ. В частности, фтористый бор образует продукт присоединения с HF:
Комплексная борофтористоводородная кислота (HBF4 ) устойчива только в растворе, причем ее кислотные свойства выражены значительно сильнее, чем у HF. Большинство солей HBF4 (фтороборатов) бесцветно и легкорастворимо в воде. Как и в случае кремния, аналогичные производные с другими галоидами не образуются.
4) Строение молекул галогенидов ВГ3 отвечает плоскому треугольнику с атомом В в центре. Некоторые их свойства сопоставлены ниже:
При образовании галогенидами бора комплексов с другими веществами атом В выступает в качестве акцептора (IX § 2 доп. 1). Поэтому присоединяться к молекулам ВГ3 способны только молекулы, содержащие атом с достаточно отчетливо выраженной до норной функцией.
По ряду F–Сl–Br–J склонность молекул ВГз к комплексообразованию довольно быстро уменьшается. Фтористый бор является хорошим катализатором различных органических реакций. Вследствие образования HBF4 гидролиз BF3 идет несколько иначе, чем в случае остальных галогенидов бора, а именно по суммарной схеме: 4BF3 + 3H2 O = 3HBF4 + B(OH)3 .
С водородом бор не соединяется, однако при действии кислот на Mg3 B2 одновременно со свободным Н2 выделяются небольшие количества смеси различных бороводородов (иначе, боранов), среди которых преобладает В4 Н10 . Последний легко распадается на В2 Н6 и ряд других боранов, более бедных водородом.
Бораны бесцветны и по физическим свойствам очень похожи на углеводороды и силаны аналогичного состава, как это видно из приводимого ниже сопоставления:
По химическим свойствам они похожи на силаны. Так же как и последние (и даже в еще большей степени), бораны при обычных условиях неустойчивы. В частности, водой они постепенно разлагаются с выделением водорода по реакции, например
а получаемая при разложении Mg3 B2 кислотами газовая смесь на воздухе самовоспламеняется. Горение боранов сопровождается выделением огромного количества тепла (484 ккал/моль В2 Н6 ), что создает возможность их использования в качестве очень эффективного ракетного топлива.
5) Так как бор трехвалентен, его водородными соединениями должны были бы быть такие молекулы, как ВН3 , В2 Н4 , В3 Н5 и т. д. Между тем бораны подобного состава неизвестны.
Молекулы летучих бороводородов следует, по–видимому, рассматривать как результат сочетания друг с другом приведенных выше валентнонасыщенных структур при посредстве особого рода водородных связей. Так, строение В2 Н6 и В4 Н10 выражается с этой точки зрения следующими схемами:
Лучше других изучены шесть бороводородов, температуры плавления и кипения которых приводятся ниже:
Все эти бораны имеют отвратительный запах и очень ядовиты.
Видео:Разложение Борной Кислоты. Получение Оксида Бора. Разложение H3BO3.Скачать

Технология борной кислоты
Автор работы: Пользователь скрыл имя, 25 Ноября 2013 в 11:19, реферат
Краткое описание
Борная кислота (ортоборная кислота) —слабая кислота, имеющая химическую формулу H3BO3.Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
Содержание
Введение 4
1. Сырьевая база технологии 5
1.1. Получение борной кислоты из буры. 6
1.2.Получение борной кислоты из магниевых боратов. 6
1.3 Производство борной кислоты из датолитового сырья 9
2. Современное состояние технологии 12
3. Перспективы развития и совершенствование технологии 15
Литература 17
Вложенные файлы: 1 файл
Видео:Борная кислота из буры и пара опытов с ней.Скачать

bornaya_kislota.docx
Пермский Национальный Исследовательский Политехнический Университет
Кафедра Технологии Неорганических Веществ
Реферат на тему:
Технология борной кислоты.
Выполнил студент гр. ТНВ-09: Витовская М.А.
1. Сырьевая база технологии 5
1.1. Получение борной кислоты из буры. 6
1.2.Получение борной кислоты из магниевых боратов. 6
1.3 Производство борной кислоты из датолитового сырья 9
2. Современное состояние технологии 12
3. Перспективы развития и совершенствование технологии 15
Видео:Борная Кислота - ПОЛУЧЕНИЕСкачать

Введение
Борная кислота (ортоборная кислота) —слабая кислота, имеющая химическую формулу H3BO3.Бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решетку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями (d= 0,318 нм).
Метаборная кислота (HBO2) также представляет собой бесцветные кристаллы. Она существует в трех модификациях — наиболее устойчивой γ-НВО2 с кубической решеткой, β-НВО2 с моноклинной решеткой и α-НВО2 с ромбической решеткой.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n.
Борная кислота применяется во многих отраслях:
- В ядерных реакторах в качестве поглотителя нейтронов, растворённого в теплоносителе.
- Борное удобрение.
- В медицине — как самостоятельное дезинфицирующее средство.
- В фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В быту используется для борьбы с тараканами.
- В пищевой промышленности — зарегистрирована как пищевая добавка E284.
Видео:Как работает бура и борная кислотаСкачать

Сырьевая база технологии
В природе Борная кислота встречается в виде минерала сассолина, а также в термальных водах и природных рассолах, из которых ее экстрагируют спиртами или смесью полиолов, либо сорбируют неорганическими и органическими сорбентами. При получении Н3ВО3 из природных боратов их разлагают H2SO4 при 100°С и отфильтровывают нерастворимый остаток; фильтрат охлаждают до 15°С, выпавшие при этом кристаллы Н3ВО3 отделяют на центрифугах и сушат при температуре не выше 100°С.
Сырьем для производства борной кислоты в СССР служили, как известно, индерские бораты, содержащие кроме основного вещества, борного ангидрида, значительные количества окисей магния и кальция, а также глину, гипс, известняк и некоторые другие примеси. В соответствии с принятой на наших борнокислотных заводах технологией размолотую руду загружают в реактор, где обрабатывают серной кислотой и оборотными растворами разбавления, образующимися от промывки борной кислоты и шлама. Горячую суспензию из реактора ( реакторную пульпу) передавливают на фильтрпресс, где происходит отделение фильтрата от шлама. Отжатый на фильтр-прессе шлам содержит значительное количество борной кислоты и для ее отмывки репульпируется горячей водой. Полученная в результате репульпации шлама пульпа называется шламовой. Эту пульпу подвергают вторичной фильтрации на ленточных вакуум-фильтрах. Шлам на полотне ленточного фильтра дополнительно промывают водой. Маточные растворы и промывные воды направляют в головной реактор. Фильтрация шламовой, а в особенности реакторной пульп является операцией малопроизводительной и самой трудоемкой из всего процесса производства борной кислоты. При этой операции много рабочих занято тяжелым физическим трудом в атмосфере повышенной влажности и температуры. Кроме того, при фильтрации расходуется очень много фильтровальных тканей, что сильно удорожает продукцию.
В издержках производства борной кислоты главное место занимают затраты на сырье и энергию, причем стоимость боратовой руды и кислоты ( серной и азотной) составляет 55 — 60 % основных расходов.
Видео:Процесс горения борной кислоты(H3BO3) и соды(Na2CO3).Скачать

1.1. Получение борной кислоты из буры.
При обработке буры кислотами образуется борная кислота, например:
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
Кроме серной и соляной кислот, можно применять и сернистую. В последнем случае через раствор буры или через водную суспензию содержащего буру минерала пропускают SO2 .
Видео:Упаковками покупаю борную кислоту! #борнаякислота #бура #советы #лайфхак #хитростижизни #домСкачать

1.2.Получение борной кислоты из магниевых боратов.
Ашарит — распространённый минерал эндогенных месторождений Борных руд и соленосных осадочных толщ. Главный минерал эндогенных борных руд суанитового, котоитового, людвигитового и других типов. В Канаде, КНДР и Марокко значительны его концентрации в серпентинитах. В CCCР известны крупные скопления Ашарита в галогенных толщах.
Серная кислота — H2SO4
Серная кислота — довольно сильный окислитель, особенно при нагревании и в концентрированном виде.
Сульфат магния — MgSO4
Используется как протрава для крашения тканей, отбелке бумаги. Лекарственное средство: слабительное при приеме внутрь, спазмолитическое при инъекционном введении. Используется для производства водостойкого цемента.
Магниевые бораты сравнительно легко и полностью разлагаются серной, соляной, азотной и фосфорной кислотами. Ашарит трудно и недостаточно полно разлагается сернистым газом, а двуокисью углерода и растворами бикарбоната и соды ашарит практически не разлагается. Разложение ашарита и гидроборацита серной кислотой идёт по следующим реакциям:
2MgO*B2O3*H2O + 2H2SO4 + aq = 2MgSO4 + 2H3BO3 + aq
CaO*MgO*3B2O3*6H2O+2H2SO4+aq = CaSO4+MgSO4 +6H3BO3 +aq
Присутствующие в породе примеси, реагируя с серной кислотой, превращаются в сернокислые соли. Скорость разложения ашарита резко возрастает с повышением температуры до 80°.
Борную кислоту получают следующим способом. Ашаритовую руду дробят, высушивают при температуре 400° во вращающейся барабанной печи топочным газом, затем размалывают. Боратовую муку разлагают в системе реакторов с мешалками серной кислотой в течение 1часа при 90-95°. В 1-й реактор одновременно с мукой подают 75-78%-ную серную кислоту, маточный раствор от кристаллизации борной кислоты, воду и промывную воду. Во избежание выделения вместе с кристаллами борной кислоты полуторных окислов фильтрат, поступающий на кристаллизацию, должен быть слабокислым. Кристаллы H3BO3 отделяют от маточного раствора на центрифуге, на которой затем промывают чистой холодной водой-конденсатом. Промывную воду возвращают в реактор. Сушку борной кислоты во вращающейся сушилке с барабаном из нержавеющей стали осуществляют воздухом с температурой 90-100°.Более высокая температура сушки недопустима, так как вызывает потери кислоты и частичный переход её в метаборную кислоту.
Борная кислота способна флотироваться без специальных реагентов. Суспензия боратовой руды в маточном растворе после отделения кристаллов сульфата магния разлагается серной кислотой при 90-95°. Шлам отделяется и промывается, промывные воды возвращаются на разложение, а концентрированный раствор охлаждается, причём из него выделяется смесь кристаллов борной кислоты и сульфата магния. При разделении этой суспензии во флотационной машине борная кислота поступает в пенный продукт, а сульфат магния-в хвосты.Пенный продукт подвергается нескольким перечисткам, а затем полученная борная кислота репульпируется в промывной воде, отфуговывается, промывается водой и высушивается.
Видео:Разложение борной кислоты / Decomposition of boric acidСкачать

1.3 Производство борной кислоты из датолитового сырья
Датолит при обычных условиях плохо разлагается щелочами, но хорошо сильными минеральными кислотами, такими, как серная, фосфорная, азотная и соляная. Наиболее целесообразно использовать серную кислоту, так как она позволяет перевести кальций датолита в нерастворимый сульфат кальция.
Датолитовая руда разрабатываемого месторождения содержит 45 – 50% основного минерала датолита. Сопутствующими минералами являются: кальцит (CaCO3), волластонит (CaO∙SiO2), гранат (3CaO∙Fe2O3 ∙3SiO2), геденбергит (CaO∙ FeO∙2SiO2), гизингерит (Fe2O3 ∙nSiO2∙mH2O), кварц( SiO2). При взаимодействии с серной кислотой они частично или полностью разлагаются. С целью сокращения расхода серной кислоты на разложение минералов пустой породы, руду обогащают, в результате чего содержание датолита повышается до 72 – 76%.
Таким образом, при разложении датолитового концентрата образуется борная кислота, сульфаты кальция и железа(3) и гидротированная кремниевая кислота. Сульфат кальция ввиду его малой растворимости выпадает в осадок, а сульфат железа, борная и кремниевая кислоты переходят в раствор. Наличие в исходном сырье больших количеств кремниевой кислоты и переход ее в раствор обуславливает образование геля, поглощающего много воды. В результате этого раствор борной кислоты становится интермицеллярной жидкостью, отделение которой от твердого остатка затруднено.
Для извлечения кислоты студнеобразную массу необходимо подсушить, т.е. вызвать старение геля. При этом объем геля резко меняется. Практическое применение нашел способ подсушки реакционной массы. Ввиду способности массы к налипанию, требуется смешивание ее со значительными количествами подсушечной массы. Это малоэффективно, так как существенно снижает производительность сушильного агрегата. По этой причине от такого способа пришлось отказаться, а разложение концентрата стали проводить в типовой суперфосфатной камере непрерывного действия.
Благодаря теплоте реакции концентрата с серной кислотой масса в камере разогревается до 110 — 125°с. За время пребывания в камере гель частично обезвоживается, стареет, а сама масса затвердевает и вырезается из камеры в виде рассыпчатого продукта. В процессе его выщелачивания образуется удовлетворительно фильтрующаяся суспензия. Но процесс фильтрации ограничен по времени, фильтровальная ткань загипсовывается, происходит это из–за неполной гидратации сульфата кальция. Для завершения гидратации до процесса фильтрования разработан режим выщелачивания, по которому сначала суспензию выдерживают при 45 — 55°с в течении 15 – 60 мин., после чего температуру повышают до 85 — 90 °с.
Комбинацией перечисленных приемов удается положительно решить основной вопрос сернокислотного способа переработки датолитового сырья – отделение борной кислоты от кремниевой и разделение полученного раствора и гипсо – кремнеземистого остатка – шлама.
Концентрат упаковывают в бумажные мешки вместимостью на 50 килограмм и транспортируют в крытых железнодорожных вагонах либо в резинокордные контейнеры вместимостью на 2000 килограмм. На предприятии концентрат поступает в цех борной кислоты по трубопроводу в виде водной суспензии. При производстве борной кислоты применяют серную кислоту собственного производства, полученную контактным методом, с содержанием H2SO4 около 93%.
🌟 Видео
Бумага не горит. (Бура+борная кислота)Скачать

Борная кислота с яйцом от Тараканов как приготовить ? СОВЕТ МОЕЙ БАБУШКИ !!!Скачать

Процесс горения борной кислоты(H3B03) и соли(NaCl).Скачать

Как сделать флюс для пайки золота и серебра? How to make flux?Скачать

★10 способов применения БУРЫ, которым ты удивишься. Универсальное моющее средство для домаСкачать

качественная реакция на борную кислотуСкачать

Справляется лучше дорогих средств! Борная кислота снимает отек, убирает прыщи, запах ног и…Скачать

Тараканы уйдут навсегда. Простейший рецептСкачать

Как растворить борную кислоту .Скачать

Светосостав из борной кислоты в домашних условиях.Скачать

Микроэлемент бор для растений. Борные удобрения - Борная кислота и Бура. Подкормки бором.Скачать

Действенное средство: БУРА В ГЛИЦЕРИНЕ.Скачать