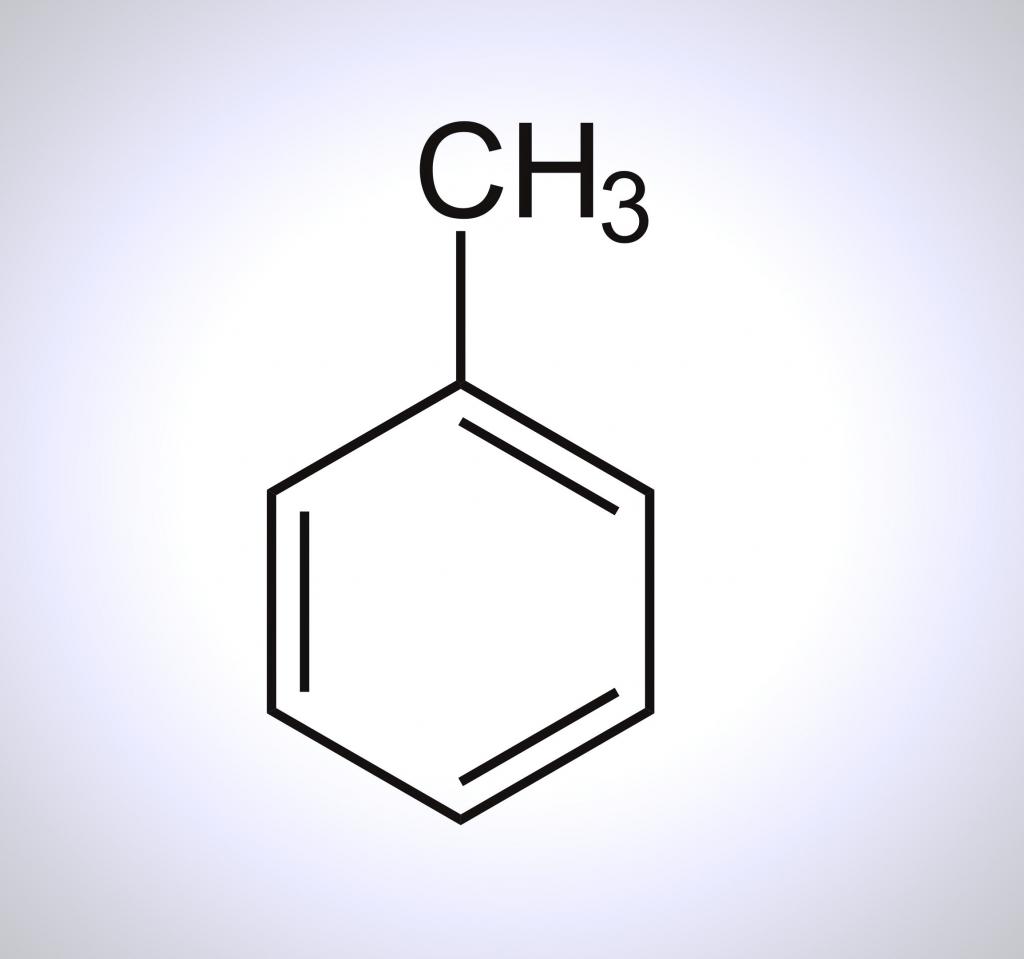
Толуол – это метилбензол, представляющий собой бесцветную жидкость, относящуюся к классу аренов, которые являются органическими соединениями с ароматической системой в составе.
Ключевой особенностью данного вещества можно считать его специфический запах. Впрочем, это не единственная «отличительная черта» вещества. Свойств и характеристик у толуола много, и обо всех них стоит вкратце рассказать.
- Немного истории
- Общие сведения
- Основные химические свойства
- Образование бензойной кислоты
- Получение вещества
- Толуол и бензол
- Реакция Фриделя-Крафтса
- Пожарная опасность
- Опасность для человека
- Применение
- Acetyl
- Бензойная кислота
- Физические свойства
- Получение
- Промышленный метод
- Лабораторные методы
- Химические свойства
- Токсичность
- Применение
- 📸 Видео
Видео:Получение бензойной кислоты (synthesis of benzoic acid) C6H5COOHСкачать

Немного истории
Химические свойства толуола начали изучать чуть меньше 200 лет тому назад, когда его и получили впервые. Вещество обнаружил в 1835 году французский фармацевт и химик Пьер Жозеф Пеллетье. Ученый получил толуол при перегонке сосновой смолы.
А спустя три года французский физикохимик Анри Сент-Клер Девиль выделил данное вещество из бальзама, который он привез из колумбийского города Толу. В честь этого напитка, собственно говоря, соединение и получило свое название.
Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Общие сведения
Что можно сказать о характеристиках и химических свойствах толуола? Вещество представляет собой летучую подвижную жидкость с резким запахом. Оказывает легкое наркотическое действие. Реагирует с неограниченным количеством углеводородов, взаимодействует с простыми и сложными эфирами, со спиртами. С водой не смешивается.
- Вещество обозначается формулой С7Н8.
- Его молярная масса равна 92,14 г/моль.
- Плотность составляет 0,86694 г/см³.
- Температуры плавления и кипения равны −95 ℃ и 110,6 ℃ соответственно.
- Удельная теплота испарения составляет 364 кДж/кг.
- Критическая температура фазового перехода равна 320 °C.
Еще это вещество отличается горючестью. Сгорает коптящим пламенем.
Видео:Синтез БЕНЗОЙНОЙ КИСЛОТЫ из ТОЛУОЛА. Реакция ПЕРМАНГАНАТА КАЛИЯ и ТОЛУОЛА. Опыты по химии дома.Скачать

Основные химические свойства
Толуол – это вещество, которому свойственны реакции электрофильного замещения. Они происходят в так называемом ароматическом кольце, проявляющим анормально высокую стабильность. Эти реакции идут, в основном, в пара- и орто-положениях относительно метильной группы -CH3.
Относятся к химическим свойствам толуола реакции озонолиза и присоединения (гидрирование). Под воздействием некоторых окислителей метильная группа становится карбоксильной. Чаще всего для этого используется щелочной раствор калийного перманганата или неконцентрированная азотная кислота.
Еще стоит отметить, что толуол способен самовоспламеняться. Для этого необходима температура в 535 °C. Вспышка происходит при 4 °C.
Видео:Бензойная кислота⚠️ Получение и изучение свойств. C6H5COOH.Скачать

Образование бензойной кислоты
Способность обсуждаемого вещества участвовать в этом процессе также обусловлена его химическими свойствами. Толуол, реагируя с сильными окислителями, образует простейшую одноосновную бензойную карбоновую кислоту, относящуюся к ароматическому ряду. Ее формула – С6Н5СООН.
Кислота имеет вид белых кристаллов, которые хорошо растворяются в диэтиловом эфире, хлороформе и этаноле. Ее получают посредством следующих реакций:
- Толуол и перманганат калия, взаимодействующие в кислой среде. Формула следующая: 5С6Н5СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 6MnSO4 + 3K2SO4 + 14Н2О.
- Толуол и перманганат калия, взаимодействующие в нейтральной среде. Формула такая: С6Н5СН3 + 2KMnO4 → С6Н5СООК + 2MnO2 + КОН + Н2О.
- Толуол, взаимодействующий на свету с галогенами, энергичными окислителями. Происходит по формуле: С6Н5СН3 + Х2 → С6Н5СН2Х + НХ.
Полученная вследствие этих реакций бензойная кислота применяется во многих сферах. В основном ее используют для получения реактивов – бензоилхлорида, бензоатных пластификаторов, фенола.
Также ее применяют при консервировании. Добавки Е213, Е212, Е211 И Е210 изготовлены именно на основе бензойной кислоты. Она блокирует ферменты и замедляет обмен веществ, подавляет рост дрожжей, плесени и бактерий.
А еще бензойная кислота используется в медицине для лечения кожных заболеваний, и как отхаркивающее средство.
Видео:Нитрование разных производных бензола. Химический опытСкачать

Получение вещества
Демонстрирующие химические свойства толуола уравнения реакций, представленные выше – это еще не все, что хотелось бы рассмотреть. Важно поговорить и о процессе получения данного вещества.
Толуол является продуктом промышленной переработки бензиновых фракций нефти. Это еще называется каталитическим риформингом. Вещество выделяют селективной экстракцией, после чего проводят ректификацию – разделяют смесь посредством противоточного тепло- и массообмена между жидкостью и паром.
Нередко данный процесс заменяется каталитическим дегидрированием гептана. Это органический алкан с формулой СН3(СН2)5СН3. Дегидрирование происходит через метилциклогексан – циклоалкан с формулой С7Н14. Это моноциклический углеводород, у которого метильной группой замещен один атома водорода.
Очищают толуол так же, как и бензол. Вот только если применяется серная кислота, нужно учесть – это вещество сульфируется легче. Значит, при очищениитолуола надо поддерживать более низкую температуру. Ниже 30 °C, если быть точнее.
Видео:Получение БЕНЗОЛАСкачать

Толуол и бензол
Поскольку эти два вещества похожи, стоит выполнить сравнение химических свойств. Бензол и толуол оба вступают в реакции замещения. Однако скорости их протекания отличаются. Поскольку в молекуле толуола метальная группа влияет на ароматическое кольцо, он реагирует быстрее.
Но бензол, в свою очередь, проявляет устойчивость к окислению. Так, например, когда на него воздействует перманганат калия, ничего не происходит. Зато толуол при такой реакции образует бензойную кислоту, о чем уже упоминалось ранее.
В то же время, известно, что предельные углеводороды не реагируют с раствором калиевого перманганата. Так что окисление толуола объясняется влиянием, оказываемым бензольным кольцом на метильную группу. Данное утверждение подтверждается теорией Бутлерова. В соответствии с ней атомы и их группы в молекулах оказывают взаимное влияние.
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Реакция Фриделя-Крафтса
Выше было многое сказано о формуле и химических свойствах толуола. Но еще не упоминалось о том, что данное вещество вполне реально получить из бензола, если выполнить реакцию Фриделя-Крафтса. Так называется способ ацилирования и алкилирования ароматических соединений с использованием кислотных катализаторов. К ним относится трифторид бора (BF3), хлорид цинка (ZnCl2), алюминия (AlCl3) и железа (FeCI3).
Вот только в случае с толуолом можно использовать только один катализатор. И это трибромид железа, который представляет сбой сложное бинарное соединение неорганического характера с формулой FeBr3. А реакция выглядит следующим образом: С6Н6 + CH3Br à FeBr 3 С6Н5СН3 + HBr. Так что не только химические свойства бензол и толуол объединяют, но еще и возможность получить одно вещество из другого.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Пожарная опасность
Нельзя не упомянуть и о ней, рассказывая про химические и физические свойства толуола. Ведь это очень огнеопасное вещество.
Оно относится к классу 3,1 легковоспламеняющихся жидкостей. В эту же категорию входит дизельное топливо, газойль, десенсибилизированные взрывчатые соединения.
Нельзя допускать возникновения рядом с толуолом открытого огня, курения, искр. Даже смесь паров этого вещества с воздухом является взрывоопасной. Если выполняются сливно-наливные операции, то соблюдение правил защиты от статического электричества приобретает первостепенную важность.
Производственные помещения, предназначенные для проведения работ, связанных с толуолом, обеспечиваются приточно-вытяжной вентиляцией, а техника – отсосами. Запрещен использование инструментов, которые могут при ударе дать искру. А если происходит возгорание вещества, то тушить его нужно лишь тонкораспыленной водой, воздушно-механической или химической пеной. Разлитый толуол обезвреживают песком.
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Опасность для человека
Характеристики и химические свойства толуола определяют его токсичность. Как уже было сказано, его пары оказывают наркотическое воздействие. Оно особенно сильно в повышенных концентрациях. У человека, вдохнувшего пары, появляются сильные галлюцинации. Мало кто знает, но до 1998 года это вещество входило в состав клея «Момент». Именно поэтому он был так популярен среди токсикоманов.
Высокие концентрации данного вещества также отрицательно влияют на нервную систему, слизистые оболочки глаз, кожу. Нарушается функция кроветворения, поскольку толуол – это высокотоксичный яд. Из-за этого может возникнуть такие заболевания, как гипоксия и цианоз.
Существует даже понятие толуольной токсикомании. Она имеет и канцерогенное влияние. Ведь пару, попадая через кожу или органы дыхания в организм человека, поражают нервную систему. Порой, данные процессы обратить невозможно.
Кроме того, пары могут вызвать заторможенность и нарушить работу вестибулярного аппарата. Поэтому люди, работающие с данным веществом, трудятся в хорошо проветриваемых помещениях, обязательно под тягой, и используют специальные резиновые перчатки.
Видео:Возгонка бензойной кислотыСкачать

Применение
Завершить тему физико-химических свойств толуола стоит рассмотрением областей, в которых данное вещество активно задействовано.
В основном оно используется в качестве сырья для производства нитротолуолов, бензилхлорида, бензойной кислоты, а также прочих органических веществ.
Также это соединение – эффективный растворитель для многих полимеров (аморфных кристаллических высокомолекулярных веществ). И еще его нередко добавляют в состав товарных растворителей для красок и лаков, некоторых лекарственных медикаментов. Даже в производстве взрывчатых веществ это соединение применимо. С его добавлением изготавливают тринитротолуол и тротилтол.
Видео:Нитрование бензолаСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Опыты по химии. Нитрование бензолаСкачать  Бензойная кислотаБензойная кислота — органическое соединение, самая ароматическая одноосновная карбоновая кислота состава С 6 Н 5 СООН. При обычных условиях кислота представляет собой бесцветные кристаллы, хорошо растворимые в эфире, спиртах, хлороформе, мало растворимыми в воде. Кислота образует ряд солей — бензоат. Срок бензойная кислота соединения происходит от названия бензойной смолы, которую выделяли из деревьев стиракс в Юго-Восточной Азии. Впервые кислота была выделена в чистом виде и описана французским алхимиком Блезом где Виженер в 16 веке — путем дистилляции бензоина. В 1832 году Фридрих Велер и Либих синтезировали бензойную кислоту с бензальдегида и установили ее формулу. Бензойная кислота и ее производные широко распространены в природе. Так, смола бензоин содержит 12-18% бензойной кислоты, а также значительное количество ее эфиров. Также эти соединения содержатся в коре, листьях, плодах вишни и чернослива. Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать  Физические свойстваБензойная кислота являются прозрачными, игловидными кристаллами. Имеет температуру кипения 249,2 ° C, но кристаллы могут сублимироваться уже при 100 ° C. Кислота слабо растворяется в воде, и хорошо — в органических растворителях.
Видео:Синтез о нитротолуола (Synthesis of o-nitrotoluene )Скачать  ПолучениеПромышленный методПочти вся получаемая в промышленных масштабах бензойная кислота синтезируется путем каталитического окисления толуола: Ее разработали на немецком предприятии IG Farbenindustrie в годы Второй мировой войны. Реакцию проводят при следующих условиях:
2-7 атм) К исходному сырью предъявляются требования высокой чистоты — примеси серы, азота, фенолов и олефинов могут замедлять ход окисления. Катализатором зачастую являются соли кобальта: нафтенат, ацетат, октоат. В качестве сокатализатор также применяются добавки марганца, однако в таком случае равновесие реакции будет нарушена и станет значительным образования побочного продукта — бензальдегида. Использование бромидов (например, бромид кобальта) позволяет существенно увеличить эффективность окислительных процессов в системе, но такие добавки вызывают высокую коррозионную действие и требуют установки дорогостоящего оборудования из титана. Степень превращения толуола составляет 50%, из которых 80% являются бензойной кислотой. Ежегодный объем производства бензойной кислоты составляет 750 тыс. Тонн. Лабораторные методыПри обработке бензальдегида водно-спиртовым раствором щелочи (например, 50% KOH), он диспропорционирует с образованием бензойной кислоты и бензилового спирта: Бензойную кислоту можно получить карбоксилирования магний- или литийорганичних соединений, например, фенилвмисного реактива Гриньяра C 6 H 5 MgBr (в эфире): Кислота образуется при гидролизе бензоилхлорида: Другим методом является синтез кислоты с бензола — путем ацилирования его фосгеном в присутствии хлорида алюминия (реакция Фриделя — Крафтса): Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать  Химические свойстваБензойная кислота проявляет все свойства карбоновых кислот: образование эфиров при взаимодействии со спиртами, образования амидов и тому подобное. Бензойная кислота устойчива к действию многих окислителей: воздух, перманганат, гипохлоритов. Однако, при нагревании свыше 220 ° C она взаимодействует с солями меди (II), образуя фенол и его производные. В результате взаимодействия кислоты с аммиаком образуется анилин. Нагрев бензойную кислоту до 370 ° C в присутствии катализатора (медный или кадмиевый порошки), происходит декарбоксилирование, что ведет к бензола на незначительных количеств фенола. При участии катализатора оксида циркония бензойную кислота может гидруватися к бензальдегида с количественным выходом. А гидрирования в присутствии благородных металлов ведет к образованию циклогексанкарбоновои кислоты (гексагидробензойнои). Хлорирование соединения дает продуктом преимущественно 3-хлоробензойну кислоту. Нитрования и сульфирования происходит аналогично по третьему положением. Видео:ХИМИЯ 10 класс ЕГЭ 2024 Гептан ➝ Толуол ➝ Ацетат калия ➝ Бензол ➝ Нитробензол ➝ Хлорид фениламмонияСкачать  ТоксичностьБензойная кислота является веществом средней токсичности. Ежедневные дозы кислоты до 5-10 мг / кг не имеют влияния на здоровье. Вещество может подразюваты слизистые оболочки человека, поэтому при работе с кислотой необходимо пользоваться для защиты органов дыхания. Видео:ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА, ФЕНОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать  ПрименениеОсновная часть получаемой бензойной кислоты применяется в производстве капролактама и вискозы; некоторые предприятия, синтезирующих данные речовны имеют собственные мощности для получения бензойной кислоты. Также значительным является использование кислоты в производстве ее солей — бензоат: бензоата калия, натрия, кальция и тому подобное. Данные соединения нашли широкое применение в качестве пищевых и косметических консервантов, ингибиторов коррозии. С 1909 бензойную кислоту разрешено использовать в продуктах питания, где она выполняет функции консерванта в концентрации не более 0,1%. В реестре пищевых добавок Европейского Союза бензойная кислота имеет код E210. Бензойная кислота является сырьем для производства красителей, например, анилинового синего и некоторых антрахиноновых красителей. Также незначительным является применение бензойной кислоты в медицине: кислота используется в изготовлении противомикробным и фунгицидным препаратов. 📸 ВидеоПолучение бензола и его гомологов. 1 часть. 11 класс.Скачать  Как получить ХЛОРБЕНЗОЛ, не используя БЕНЗОЛ!Скачать  Арены (бензол, толуол): цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать  |