Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
- Неорганическая химия
- Химические свойства.
- АММИАК
- ГИДРАЗИН И ГИДРОКСИЛАМИН
- ОКСИДЫ АЗОТА
- АЗОТНАЯ КИСЛОТА И НИТРАТЫ
- Азот. Химия азота и его соединений
- Положение в периодической системе химических элементов
- Электронное строение азота
- Физические свойства и нахождение в природе
- Строение молекулы
- Соединения азота
- Способы получения азота
- Химические свойства азота
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
- Оксиды азота
- Оксид азота (I)
- Оксид азота (II)
- Оксид азота (III)
- Оксид азота (IV)
- Оксид азота (V)
- Азотная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Азотистая кислота
- Соли азотной кислоты — нитраты
- Соли азотистой кислоты — нитриты
- 💥 Видео
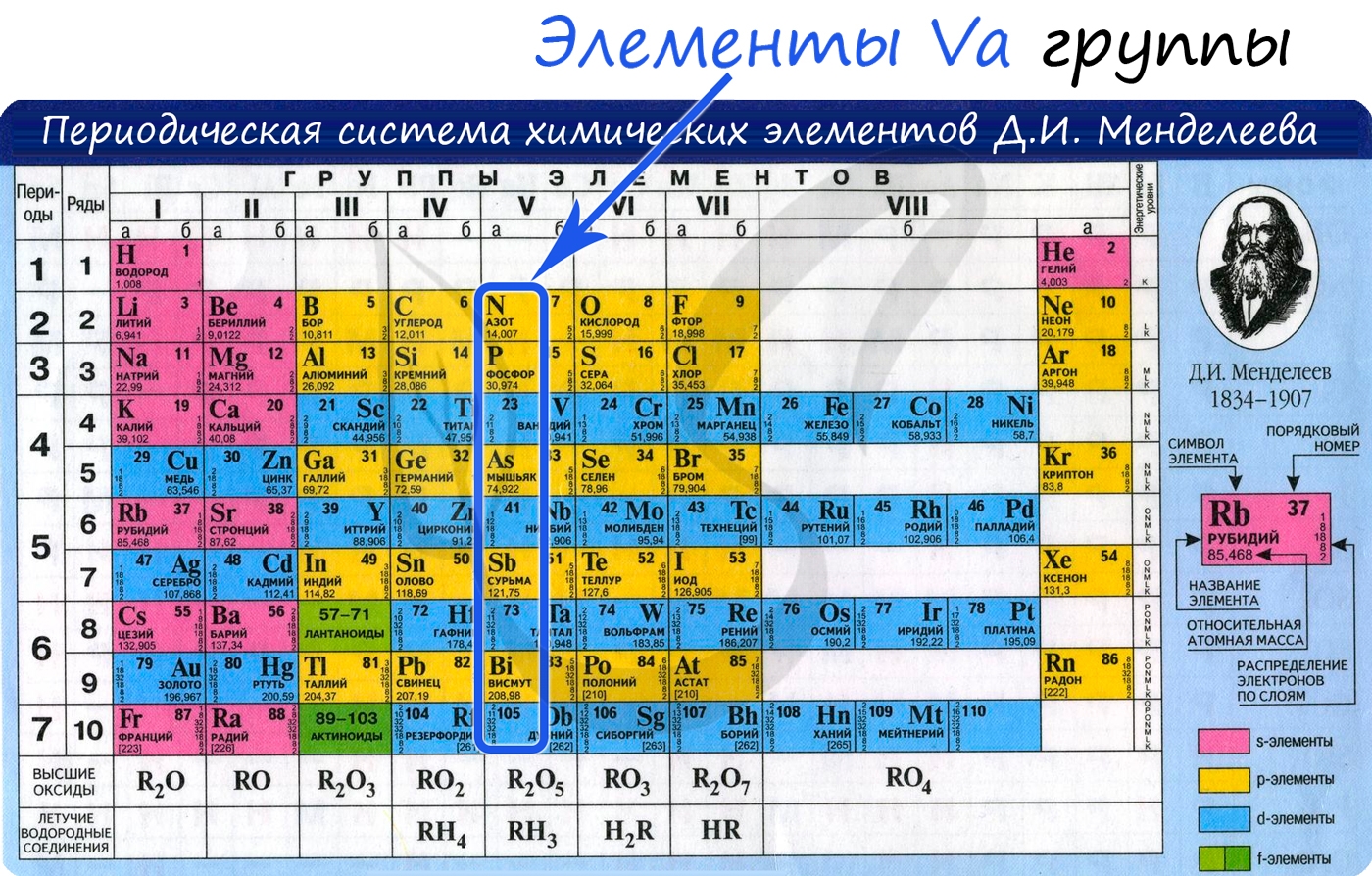
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 3 :
- N — 2s 2 2p 3
- P — 3s 2 3p 3
- As — 4s 2 4p 3
- Sb — 5s 2 5p 3
- Bi — 6s 2 6p 3
Основное и возбужденное состояние азота
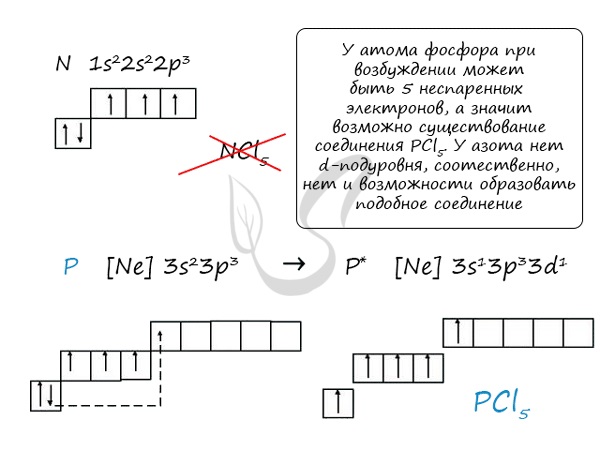
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.
- Реакция с металлами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Реакция с неметаллами
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
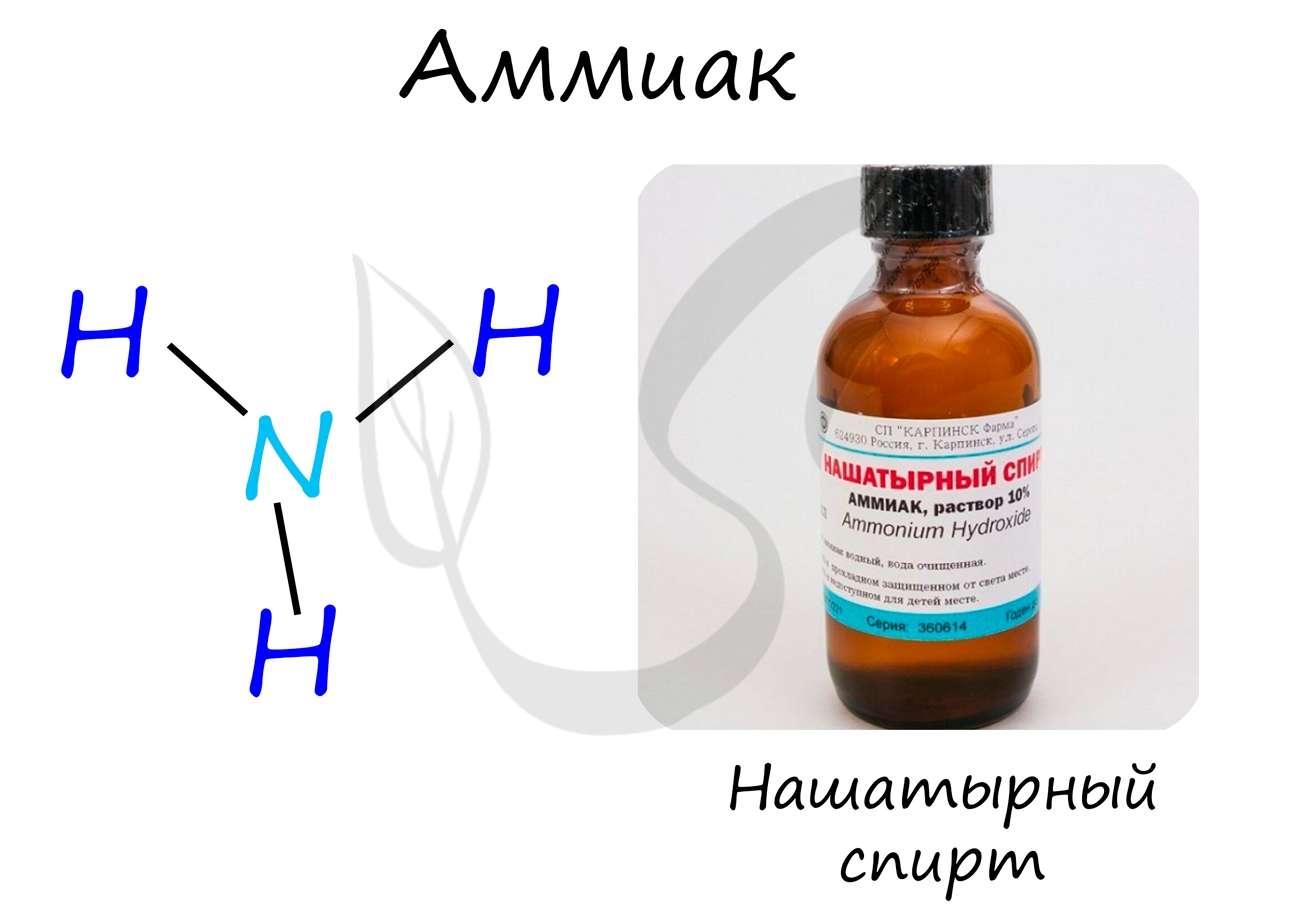
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.
Соли аммония
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
Реакции с щелочами
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
Реакции с солями
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры — 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2 — ). Реагирует с водой, основаниями.
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
Реакции с водой и щелочами
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Получение азота разложением нитрита аммонияСкачать

Неорганическая химия
Азот (символ N — от латинского Nitrogenium) — элемент 5 группы периодической системы, порядковый номер 7, электронное строение атома 1s 2 2s 2 2p 3 . В соединениях проявляет степени окисления от -3 до +5.
Элемент азот имеет два стабильных изотопа: 14 N и 15 N.
В природе азот находится в основном в виде простого вещества, являясь основным компонентом воздуха (объемная доля азотав воздухе 0,78, массовая 0,76). Незначительные количества связанного азота встречаются в виде чилийской селитры NaNO3 и индийской селитры KNO3. Азот входит в состав многих органических соединений, в частности в состав аминокислот. Массовая доля азота в земной коре, атмосфере и гидросфере составляет 0,0004.
Элемент азот образует одно простое вещество, состоящее из двухатомных молекул N2. Связь в молекуле тройная, энергия диссоциации составляет 946 кДж/моль, поэтому даже при 3000 o С диссоциирует только одна молекула из 1000.
Азот — бесцветный газ, без вкуса и запаха, температура кипения -196 o С, плавления -210 o С. Растворимость азота при 0 o С составляет 2 объема в 100 объемах воды. Азот не ядовит, но дыхания не поддерживает.
Химические свойства.
Высокая энергия связи в молекуле азота приводит к тому, что азот проявляет низкую химическую активность. При комнатной температуре он взаимодействует только с литием, образуя красно-бурый оксид лития:
При 200-300 o С азот реагирует с другими щелочными и щелочноземельными металлами, например:
При 1000 o С азот реагирует с алюминием:
а при 600-800 o С — с железом и некоторыми другими переходными металлами. В результате этих реакций образуются нитриды, которые по своим свойствам могут быть разделены на 3 группы:
1. Ионные нитриды — нитриды щелочных и щелочноземельных металлов. Водой эти нитриды разлагаются:
2. Ковалентные нитриды, например AlN, BN, Si3N4 — инертные, не разлагающиеся водой вещества, обладающие высокими температурами плавления.
3. Нитриды переходных металлов — образуются за счет внедрения атомов азота в кристаллическую решетку металла — вещества высокой твердости с высокими температурами плавления.
Азот взаимодействует с неметаллами:
а) водородом — при 5000 ат или в присутствии катализаторов:
б) кислородом — при 2500-3000 o С:
в) углеродом — в пламени электрической дуги (2500-3000 o С) с образованием циана:
г) бором — при 2000 o С:
С остальными неметаллами азот непосредственно не взаимодействует.
В промышленности азот получают при фракционной перегонке сжиженного воздуха одновременно с кислородом.
В лаборатории азот можно получить:
а) окислением аммиака оксидом меди при нагревании:
б) термическим разложением нитрата аммония:
или смеси нитрита натрия и хлорида аммония:
а) в синтезе аммиака
б) для наполнения электрических ламп
в) для создания инертной атмосферы в различных производствах
г) для азотирования металлов — создания на их поверхности пленки нитрида.
АММИАК
В молекуле аммиака азот находится в состоянии sp 3 гибридизации, молекула имеет форму тетраэдра:
Связи N-H — ковалентные полярные, общие электронные пары смещены в сторону атома азота. Атом азота имеет неподеленную электронную пару (не принимающую участия в образовании химической связи). Молекула аммиака полярна.
Аммиак — бесцветный газ с резким запахом “нашатырного спирта”, температура плавления -78 o С, кипения -33 o С, легко сжижается при 6-7 ат (0,6-0,7 МПа) и комнатной температуре в бесцветную жидкость. Аммиак хорошо растворим в воде: при 0 o С — 1200 объемов, при 20 o С — 70объемов в 1 объеме воды. Обладает сильным раздражающим свойством на слизистые оболочки, большое содержание аммиака во вдыхаемом воздухе может привести к тяжелым отравлениям. Раствор аммиака в воде с массовой долей NH3, равной 0,1, называется “нашатырным спиртом”.
Молекулы аммиака ассоциированы за счет водородных связей, поэтому теплота испарения жидкого аммиака велика и составляет 23,5 кДж/моль.
Наличие в молекуле аммиака неподеленной электронной пары атома азота приводит к тому, что аммиак может связывать протон (акцептор протона):
проявляя при этом свойства основания.
В водных растворах аммиака существует равновесие:
Водные растворы аммиака имеют щелочную реакцию. Аммиак — слабое оcнование, степень диссоциации его при 25 o С в 0,2 М растворе равна 0,02.
Аммиак может вступать в реакцию нейтрализации с кислотами, образуя соли аммония, например:
Cоли аммония — как правило, бесцветные кристаллические вещества, хорошо растворимые в воде. В растворах гидролизуются, давая слабокислую реакцию (если в состав соли входит анион сильной кислоты):
Сильные основания (щелочи) вытесняют аммиак из солей аммония, например:
— при нагревании образующийся аммиак улетучивается.
Соли аммония термически неустойчивы, при нагревании разлагаются. Продукты разложения определяются анионом, входящим в состав соли. Если это анион обычной кислоты (неокислителя), то разложение обратимо, например:
— при нагревании реакции протекают слева направо, при охлаждении — справа налево. Если в состав соли входит анион кислоты-окислителя, то разложение необратимо, при этом образуются азот или N2O, например:
Очень редко аммиак может проявлять свойства очень слабой кислоты, например образуя при взаимодействии с расплавленными щелочными металлами амиды:
Аммиак проявляет свойства восстановителя:
в присутствии платины (или родия) в качестве катализатора образуется NO:
б) окисляется хлорной известью:
в) восстанавливает oксиды металлов при нагревании, например:
В промышленности аммиак получают:
а) прямым синтезом:
N2 + 3H2 = 2NH3 
при давлении 150-1000 ат (15-100 МПа) и температуре 450-550 o С.
Катализатор — губчатое (пористое) железо с добавками Al2O3 и K2O. Процесс ведется в аппарате, называемом колонной синтеза. Так как выход аммиака за один проход азотоводородной смеси через колонну синтеза невелик, применяют принцип рециркуляции — после отделения аммиака (охлаждением смеси, в результате чего аммиак конденсируется) непрореагировавшие азот и водород снова направляются в колонну синтеза. Этим достигается высокая степень превращения азота в аммиак.
б) цианамидным способом, состоящим из следующих стадий:
1. образование цианамида кальция при 1000 o С:
2. разложение цианамида водой:
3. регенерация карбида кальция разложением карбоната при 1000 o С:
и прокаливанием образовавшегося оксида кальция с коксом при 2000-2500 o С:
В лаборатории аммиак получают вытеснением его из солей аммония щелочами при нагревании, например:
Применение аммиака и солей аммония.
а) для получения азотной кислоты
б) для получения удобрений
в) в качестве хладагента в холодильных установках
г) для азотирования металлов
Соли аммония применяют:
NH4NO2 — в качестве удобрения и в производстве взрывчатых веществ.
KNO3 — азотное удобрение, компонент пиротехнических смесей (например, черного пороха).
NH4Cl — (“нашатырь”) — для пайки металлов. Раствор NH4Cl используется в качестве электролита в ‘сухих’ гальванических элементах.
ГИДРАЗИН И ГИДРОКСИЛАМИН
Степень окисления -2 азот имеет в гидразине N2H4. При обычных условиях это жидкость. Гидразин — сильный восстановитель:
горит с выделением большого количества теплоты:
N2H4 + O2 = N2 + 2H2O 
Получают гидразин действуя на раствор аммиака гипохлоритом натрия:
Гидразин используют в качестве восстановителя и как ракетное топливо.
Степень окисления -1 азот имеет в гидрокисламине NH2OH. В обычных условиях это бесцветные кристаллы. Гидроксиламин проявляет свойства восстановителя:
но при взаимодействии с сильными восстановителями может проявлять окислительные свойства:
В щелочной среде гидроксиламин разлагается:
Получают гидроксиламин электролизом раствора HNO3 с ртутным катодом.
Выделяющийся на катоде атомарный водород восстанавливает азотную кислоту:
Гидроксиламин применяют в качестве восстановителя.
ОКСИДЫ АЗОТА
Оксид азота (1) — N2O — “веселящий газ” имеет строение N=N=O, центральный атом азота находится в состоянии sp-гибридизации. N2O — бесцветный газ, обладабщий наркотическим действием. Несолеобразующий оксид. При нагревании N2O разлагается:
Оксид азота (1) получают термическим разложением нитрата аммония:
Применяется для газового наркоза.
Оксид азота (2) — NO — бесцветный газ. Несолеобразующий оксид. Легко окисляется кислородом:
NO — единственный оксид азота, который может быть получен из простых веществ:
В лаборатории NO получают при взаимодействии меди с разбавленной (массовая доля 0,3-0,4) азотной кислотой:
NO — промежуточный продукт в производстве азотной кислоты.
Оксид азота (3) — N2O3 — азотистый ангидрид — синяя жидкость, при взаимодействии с водой образует азотистую кислоту HNO2:
Азотистый ангидрид может быть получен при взаимодействии NO c NO2 при охлаждении:
Азотистая кислота — слабая одноосновная кислота, существует только в разбавленных водных растворах, легко разлагается:
HNO2 легко вытесняется из своих солей — нитратов серной кислотой,поэтому вместо самой азотистой кислоты используют подкисленные растворы нитритов. Из-за промежуточной степени окисления азота (+3) азотистая кислота (и ее соли в кислой среде) могут проявлять восстановительные свойства (при взаимодействии с окислителями), например:
или окислителя (при взаимодействии с восстановителями):
Оксид азота (4) — NO2 — бурый газ, ядовит, обратимо димеризуется:
При температуре ниже -11 o С существует димер, выше 140 o С — мономер, при промежуточных температурах — смесь мономера и димера. NO2 — кислотный оксид, взаимодействие его с водой протекает по-разному, в зависимости от условий:
Аналогично протекает взаимодействие NO2 с растворами щелочей.
NO2 — сильный окислитель, например при комнатной температуре он окисляет SO2:
В промышленности NO2 получают окислением NO кислородом воздуха:
в лаборатории — действием концентрированной азотной кислоты (массовая доля 0,6-0,7) на медь:
или термическим разложением нитрата свинца:
Оксид азота (5) — N2O5 — азотный ангидрид — нестойкое белое кристаллическое вещество, медленно разлагается:
при растворении в воде образует азотную кислоту:
N2O5 — сильный окислитель, например при соприкосновении с ним воспламеняется фосфор:
Получают N2O5 обезвоживанием азотной кислоты фосфорным ангидридом:
Все оксиды азота восстанавливаются молекулярным водородом до свободного азота по общей реакции:
АЗОТНАЯ КИСЛОТА И НИТРАТЫ
Азот в азотной кислоте четырехвалентен, степень окисления +5:
пунктиром показана трехцентровая связь — электронная пара связывает 3 атома.
Азотная кислота — бесцветная, дымящая на воздухе жидкость, плотность 1,5 г/см 3 , температура плавления -41 o С, кипения +80 o С с частичным разложением. Растворимость азотной кислоты в воде неограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют “дымящей азотной кислотой”, с массовой долей 0,6-0,7 — концентрированной азотной кислотой.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до -3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Смесь одного объема концентрированной азотной кислоты и трех объемов концентрированной соляной кислоты называется царской водкой. В царской водке растворяется золото и платина:
Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители, например:
Получение азотной кислоты.
Промышленный способ получения HNO3 состоит из следующих основных стадий:
1. окисления аммиaка в NO в присутствии платино-родиевого катализатора:
2. окисления NO в NO2 на холоду под давлением (10 ат, 1 МПа):
3. поглощения NO2 водой в присутствии кислорода:
Массовая доля HNO3 в получаемом растворе составляет около 0,6.
Изредка применяемый дуговой способ получения азотной кислоты отличается только первой стадией, которая состоит в пропускании воздуха через пламя электрической дуги:
Лабораторный способ получения HNO3 -действие концентрированной серной кислоты на твердые нитраты при нагревании:
при этом получается дымящая азотная кислота.
Нитраты получают действием азотной кислоты на гидроксиды, оксиды или карбонаты металлов:
Применение азотной кислоты и нитратов.
Азотная кислота применяется в производстве:
а) азотных удобрений
б) взрывчатых веществ
в) органических красителей
г) лаков и кинопленки
NaNO3 — натриевая селитра — как удобрение
NH4NO3 — аммиачная селитра — удобрение и компонент взрывчатых веществ (аммоналов).
KNO3 — калийная селитра — удобрение и компонент пиротехнических составов, например, черного пороха.
Ca(NO3 )2 — кальциевая селитра — удобрение.
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Азот. Химия азота и его соединений
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии :
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:
Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5 азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III) нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3 нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
Суммарное уравнение процесса:
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Например , разложением азида натрия:
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре
3CuO + 2NH3 → 3Cu + N2 + 3H2O
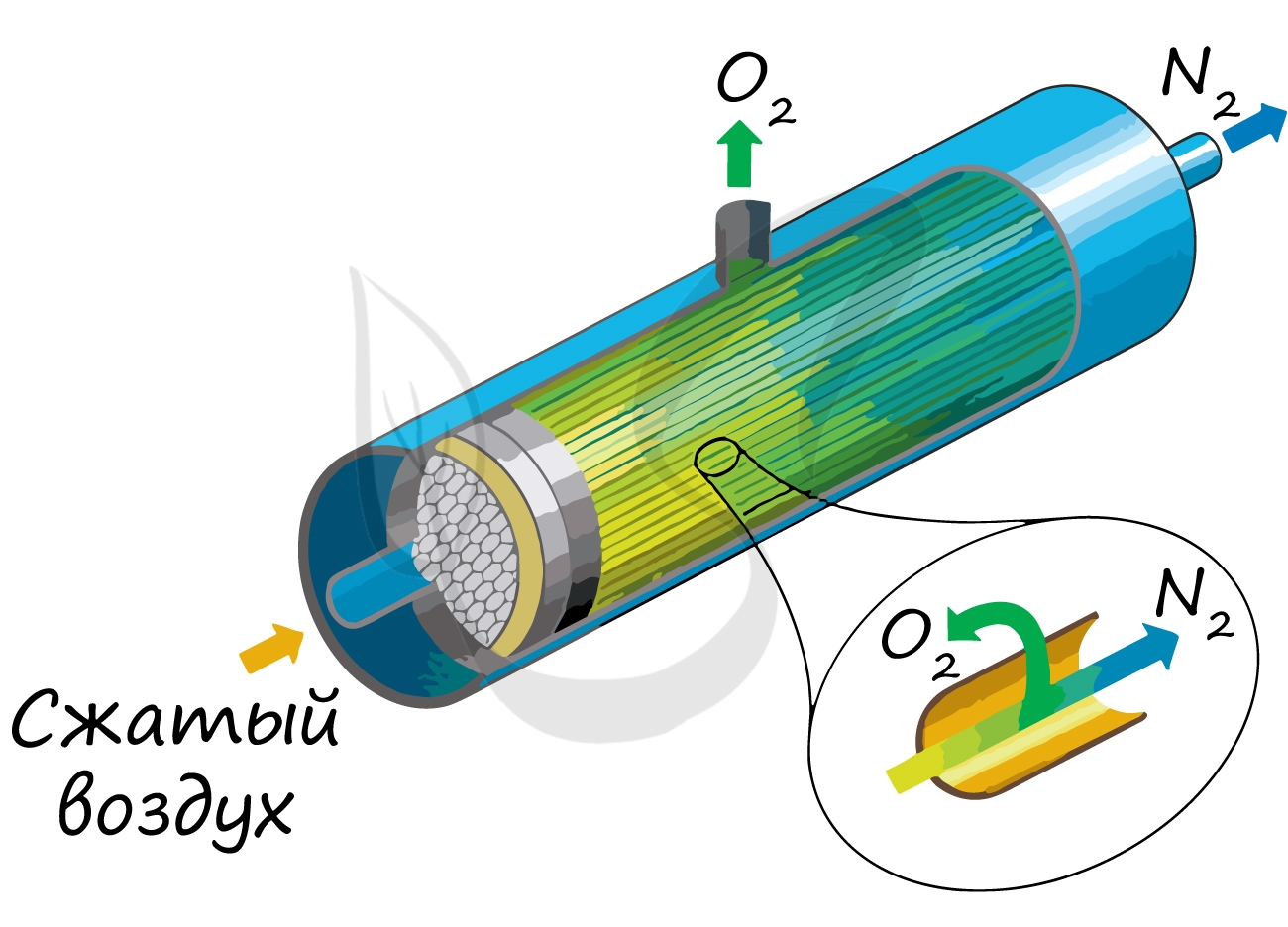
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами .
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000 о С), на электрической дуге (в природе – во время грозы) :
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000 о С-5000 о С или действие электрического разряда) образуется атомарный азот, который реагирует с серой , фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой , фосфором, мышьяком, углеродом.
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами : с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например , литий реагирует с азотом с образованием нитрида лития:
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например , азот окисляет гидрид лития:
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II) | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид . Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя . Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + Mg → N2 + MgO
Еще пример : оксид азота (I) окисляет углерод и фосфор при нагревании:
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например , N2O окисляется раствором перманганата в серной кислоте:
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например , при действии 30 %-ной азотной кислоты на медь образуется NO:
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей .
Например , горит в атмосфере кислорода:
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
2. В присутствии более сильных восстановителей проявляет свойства окислителя . В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например , оксид азота (II) окисляет водород и сернистый газ:
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид . За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: м ожно получить при низкой температуре из оксидов азота:
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами :
Например , оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например , при действии концентрированной азотной кислоты на медь:
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например , при разложении нитрата серебра:
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Если растворение NO2 в воде проводить в избытке кислорода , то образуется только азотная кислота:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор , уголь , сера , оксид серы (IV) окисляется до оксида серы (VI):
4. Оксид азота (IV) димеризуется :
Оксид азота (V)
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота :
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V) :
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например , оксид азота (V) реагирует с гидроксидом натрия:
Еще пример : оксид азота (V) реагирует с оксидом кальция:
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель .
Например , он окисляет серу:
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами .
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет йодоводород:
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например , соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO 2 существует только в разбавленных растворах, при нагревании она разлагается :
без нагревания азотистая кислота также разлагается :
2. Азотистая кислота взаимодействует с сильными основаниями .
Например , с гидроксидом натрия:
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства . Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например , HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
Азотистая кислота окисляет соединения железа (II):
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства . Под действием окислителей азотистая кислота переходит в азотную.
Например , хлор окисляет азотистую кислоту до азотной кислоты:
Кислород и пероксид водорода также окисляют азотистую кислоту:
Соединения марганца (VII) окисляют HNO2:
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы , причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов ( до Mg в электрохимическом ряду ) разлагаются до нитрита и кислорода.
Например , разложение нитрата натрия:
Исключение – литий .
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов ( от Mg до Cu, включая магний и медь ) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например , разложение нитрата меди (II):
- Нитраты малоактивных металлов ( правее Cu ) – разлагаются до металла, оксида азота (IV) и кислорода.
Например , нитрат серебра:
Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
Нитрат марганца (II) разлагается до оксида марганца (IV):
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители .
Например , смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
Лабораторные окислители — перманганаты , дихроматы — также окисляют нитриты до нитратов:
В кислой среде нитриты выступают в качестве окислителей .
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
При взаимодействии с очень сильными восстановителями ( алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
Смесь нитратов и нитритов также проявляет окислительные свойства. Например , смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
💥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение азота разложением нитрита аммонияСкачать

Строение молекулы азота Получение Физические свойства/химия 9Скачать

Получение азота разложением нитрита аммонияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

9 класс. Химия. Азот и его соединенияСкачать

Азот и его соединения: химические свойства #азот #химшкола #неметаллы #егэхимияСкачать

Урок химии (Научфильм) - 015 - Получение Азота, Аммиака, Азотной кислотыСкачать

Азот - Газ, окружающий нас ПОВСЮДУ!Скачать

азотный кислота чуть не взорвалась до конца смотрите химия реакция лабораторияСкачать

Химия. 9 класс. Азот /10.02.2021/Скачать

Получение азота, аммиака, азотной кислоты..часть 1Скачать

Особенности строения и свойства молекулы азота. 11 класс.Скачать