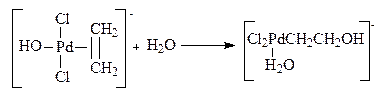В промышленности ацетальдегид получают тремя способами:
1. Гидратация ацетилена (реакция Кучерова)
2. Гидратация этилена до этанола с его последующим дегидрированием
3. Непосредственное окисление этилена кислородом воздуха на PdCl2
наиболее дешевый способ
Окисление идет кислородом в жидкой фазе. При этом к катализатору PdCl2 добавляют сокатализатор СиС12и раствор подкисляют НС1; 100-130 °С, 0,3-1,0 МПа.
В системе протекают окислительно-восстановительные реакции:
Медь выступает в роли переносчика кислорода. Суммарное уравнение окисления:
Можно проводить как в одну стадию в одном реакторе, так и в нескольких реакторах. Чаще проводят в одну стадию.
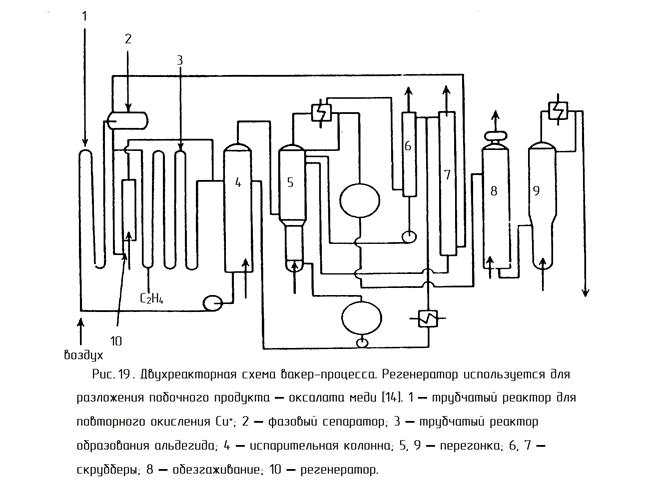
Технологическая схема одностадийного синтеза ацетальдегида при окислении этилена кислородом
В реактор 1 типа пустотелой барботажной колонны, заполненной катализаторным раствором, подают кислород и этилен (свежий и рециркулирующий). Реактор работает с постоянным уровнем жидкости при 130°С и 0,3 МПа. Избыточный этилен выдувает из раствора образовавшийся ацетальдегид, чем предотвращаются побочные реакции его конденсации. Вместе с ацетальдегидом испаряется часть воды, которую конденсируют в холодильнике 3 и возвращают в реактор.
Газопаровую смесь направляют в абсорбер 4, где ацетальдегид поглощают водой, орошающей насадку абсорбера. Основное количество остаточного газа, содержащего этилен, немного кислорода и инертные примеси, возвращают на окисление, дожимая его циркуляционным компрессором 2. Меньшую часть газа выводят с установки во избежание чрезмерного накопления в нем инертных примесей. Водный раствор ацетальдегида из куба абсорбера 4 поступает в отпарную колонну 5, где отгоняют растворенные газы и летучие примеси. Затем в колонне 6 в виде дистиллята получают ацетальдегид, а большую часть кубовой жидкости, содержащей менее летучие побочные продукты (кротоновый альдегид и др.), возвращают после охлаждения на абсорбцию. Часть этой жидкости выводят в систему очистки сточных вод.
По сравнению с двухстадийным процессом одностадийный синтез ацетальдегида дает экономию в капиталовложениях и расходе энергии, но связан с применением более дорогостоящего окислителя (кислород). Показатели этих методов в общем близки, и оба они успешно эксплуатируются в промышленности.
Окислительное сочетание на PdCl2
Этим способом получают винилацетат, этиленгликольдиацетат. Винилацетат получают вииилированием уксусной кислоты, однако при этом используется дорогое сырье (ацетилен), поэтому большее значение для получения винилацетата имеет окислительное сочетание этилена и уксусной кислоты на PdCl2
Процесс может осуществляться в жидкой фазе, в барботажной колонне, но при этом образуется много побочных продуктов, поэтому чаще этот процесс ведут в газовой фазе на гетерогенном катализаторе PdCl2+CH3-COONa на носителе. Температура 160-170 °С. Давление 1,5 МПа. Реактор трубчатый. Этилен : уксусная кислота : кислород =8:4:1.
- Получение ацетальдегида из этилена
- Содержание
- Физические свойства [ править | править код ]
- Получение [ править | править код ]
- Реакционная способность [ править | править код ]
- Реакция конденсации [ править | править код ]
- Производные ацеталя [ править | править код ]
- Применение [ править | править код ]
- Биохимия [ править | править код ]
- Табачная зависимость [ править | править код ]
- Болезнь Альцгеймера [ править | править код ]
- Проблема алкоголя [ править | править код ]
- Канцероген [ править | править код ]
- Безопасность [ править | править код ]
- Санитарно-гигиенические рекомендации [23] [ править | править код ]
- Применение СИЗОД [23] [ править | править код ]
- Врожденная непереносимость алкоголя [ править | править код ]
- Acetyl
- 📺 Видео
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Получение ацетальдегида из этилена
Уксусный альдегид и уксусная кислота – продукты, используемые людьми тысячи лет. В допромышленную эпоху эти продукты получали с помощью ферментативного катализа при брожении растительных продуктов. Первый промышленный способ получения ацетальдегида основан на реакции гидратации ацетилена, открытой Кучеровым в 1881 г.
Производство ацетальдегида этим способом началось в 1916 г. в Германии. Основной недостаток этого процесса – токсичность катализатора.
Кроме этого ацетальдегид получали дегидрированием и окислительным дегидрированием этилового спирта на оксидных ( ZnO, CuO, FeO) и металлических катализаторах (Ag, Cu, Au), соответственно.
Более эффективный способ – окислением этилена был разработан в конце 50-х почти одновременно группой Смидта, Хафнера и др. (Консорциум электрохимической промышленности) и И.И. Моисеевым, М.Н. Варгафтиком и Я.К. Сыркиным (МИТХТ им. М.В. Ломоносова). Метод был основан на трех стехиометрических реакциях, которые в совокупности складывались в каталитический цикл. Cложение этих реакций приводит к итоговому уравнению каталитического процесса.
Pd(0) + 2 CuCl2 → PdCl2 + 2 CuCl
2 CuCl + 2 HCl + 0,5 O2 → 2 CuCl2 + H2O
Это полифункциональная каталитическая система, в которой каждый из трех катализаторов (PdCl2, CuCl2, H2O) выполняет свою кинетическую функцию. Палладий (II) и нуклеофильный катализатор – вода – участвуют в стадиях окисления этилена в ацетальдегид (механизм приведен ниже). Медь (II) катализирует окисление восстановленного палладия кислородом.
Процесс может проводиться с различными алкенами. Продуктами являются альдегиды и кетоны. Показатели зависят от природы используемого алкена. В случае этилена селективность – до 95%, побочные продукты – уксусная кислота – 2%, СО2 – 1%, хлорпроизводные – 1% (хлористый метил, хлористый этил, хлоруксусный альдегид). В случае окисления пропилена основным продуктом является ацетон. Селективность его образования достигает 90%. Пропионовый альдегид является побочным продуктом.
4.4.1 Механизм и кинетика Вакер-процесса.
Общепринятый механизм Вакер-процесса, основной вклад в изучение которого внесла группа И.И. Моисеева, включает стадии замещения анионов хлора в тетрахлорпалладате на этилен и воду с последующим депротонированием координированной в транс-положении к этилену воды.
Далее в зависимости от разных обстоятельств возможны два варианта механизма лимитирующей стадии. Первый – изомеризация π-комплекса PdCl2(OH)(C2H4) — , имеющего транс-строение, в π-комплекс цис-строения с последующей внутримолекулярной нуклеофильной атакой гидроксильного лиганда на углерод этилена (цис-присоединение, внедрение этилена по связи Pd-O) с образованием σ-палладий-органического соединения σ1.
Второй вариант предполагает нуклеофильную атаку воды на углерод этилена из раствора с образованием того же соединения σ1.
Распад σ1 приводит к образованию ацетальдегида и восстановленной формы палладия.
Кинетическое уравнение, соответствующее приведенному механизму, описывает закономерности процесса при низких концентрациях палладия ([Pd] + ][Cl — ] 2
При более высоких концентрациях палладия механизм принципиально не изменяется, но появляются димерные комплексы Pd(II) и еще один маршрут образования ацетальдегида с их участием.
4.4.2 Технология получения ацетальдегида
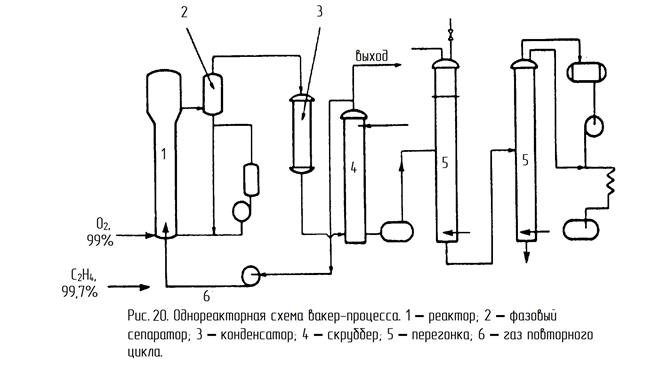
Существует два технологических варианта проведения этого процесса – двухреакторный и однореакторный. В случае двухреакторной схемы в одном реакторе проводят первую и вторую реакции из вышеприведенных трёх (с. 83), а во втором реакторе — реакцию реокисления меди кислородом воздуха (рис. 19). В случае однореакторной схемы все три реакции протекают в одном аппарате (рис. 20).
В Советском Союзе (России) была реализована только двухреакторная схема. Процесс в этом случае проводят при 100-110º и 1 МПа. Этилен и водный раствор солей палладия и меди подают в реактор типа «труба в трубе» 3 (рис. 19), который содержит инертную насадку для увеличения межфазной поверхности газ-жидкость. После реактора 3 контактный раствор вместе с реакционными газами поступает в отпарную колонну 4. Газовая фаза из колонны 4 (органические продукты) попадает в ректификационную колонну 5. Кубовый продукт колонны 5 используют для орошения колонны 4. Жидкую фазу из колонны 4 (водный слой) перекачивают в реактор 1, в котором происходит реокисление солей меди воздухом. Регенерированный каталитический раствор через фазовый сепаратор 2 поступает в реактор 3. Часть раствора из фазового сепаратора 2 отводится в регенератор 10, в котором под воздействием хлористого водорода при 150º происходит разложение труднорастворимых оксалатов меди и палладия (щавелевая кислота – один из побочных продуктов). Это необходимо для поддержания активности катализатора. Газовая фаза из сепаратора 2 поступает в скруббер 7, орошаемый, как и скруббер 6, кубовым продуктом из колонны 5. В скруббере 6 промывается несконденсировавшийся газ с верха колонны 5. Конденсат из колонны 5, содержащий ацетальдегид, через холодильник поступает на ректификацию в колонну 8 для отделения лёгких побочных продуктов (диоксид углерода, хлористый метил, хлористый этил), а затем в колонну 9 для отделения более высококипящих продуктов (хлорацетальдегид, уксусная и щавелевая кислоты). Тепло реакции (52 ккал/моль) используется для обогрева колонны 4.
Основной проблемой этого варианта является большое количество аппаратов, через которые циркулирует коррозионноактивный контактный раствор. Реакторы 1, 3, 10, сепаратор 2, насосы, коммуникации необходимо изготавливать из дорогих коррозионностойких материалов (титановых сплавов). Еще одним недостатком двухреакторной схемы является низкая производительность (
7 г/л·час). Преимущество двухреакторной схемы над однореакторной – безопасность, поскольку этилен и кислород не контактируют между собой.
Альтернативная схема (рис. 20) использует один реактор, содержащий контактный раствор, в который подают высокочистые этилен и кислород. Процесс проводят при 120-130º и 0,3 МПа. Тепловой эффект снимают за счет испарения части воды. Убыль воды восполняется. Газообразные продукты, пройдя фазовый сеператор 2 и холодильник 3, поглощаются в скрубберах 4. Непрореагировавший этилен в избытке которого проводят процесс (выше верхнего предела взрываемости) рециркулируют обратно в реактор 1. Ацетальдегид очищают ректификацией в колоннах 5.
Достоинства однореакторной схемы:
1) Мало аппаратов соприкасается с контактным раствором.
2) Производительность выше, чем в 2-х реакторном варианте.
1) Необходимость использования чистого кислорода и этилена из-за рециркуляции газа.
2) Большой расход энергии на рециркуляцию газа.
4) Потери части этилена из-за отдувки газа из рецикла.
Результаты сравнения показателей процессов получения ацетальдегида, проведенного во ВНИИОС, представлены в таблице 13 (затраты на двухреакторный вариант приняты за 100%). Из этих данных следует, что однореакторная схема обладает существенными преимуществами перед двухреакторным вариантом и в отношении капитальных вложений, и по себестоимости ацетальдегида. Только потенциальная взрывоопасность ставит под сомнение целесообразность использования однореакторной схемы. Данные, приведенные в той же таблице и относящиеся к технологии получения ацетальдегида из ацетилена, свидетельствуют о неконкурентоспособности этого варианта в основном из-за высокой стоимости сырья и несоответствия экологическим требованиям.
Сравнение показателей процесов получении ацетальдегида окислением этилена для однореакторной и двухреакторной схем и гидратацией ацетилена (по данным ВНИИОС)
ацетальдегид — ацетальдегид … Орфографический словарь-справочник
АЦЕТАЛЬДЕГИД — (уксусный альдегид) СН3СНО, бесцветная жидкость с резким запахом, tкип = 20,2 .С. Сырье в производстве уксусной кислоты, уксусного ангидрида, пентаэритрита … Большой Энциклопедический словарь
АЦЕТАЛЬДЕГИД — АЦЕТАЛЬДЕГИД, см. ЭТАНАЛЬ … Научно-технический энциклопедический словарь
ацетальдегид — сущ., кол во синонимов: 2 • альдегид (10) • этаналь (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Ацетальдегид — (уксусный альдегид) бесцветная жидкость с удушающим запахом. Температура кипения: 20,16 C, плотность: 0,778 г/куб. см. Смешивается во всех соотношениях с водой и большинством органических растворителей. Оказывает наркотическое, раздражающее,… … Официальная терминология
АЦЕТАЛЬДЕГИД — АЦЕТАЛЬДЕГИД, СН3 . СН : О, уксусный альдегид, находится в сыром древесном и винном спирте, в вине, во многих эфирных маслах (камфарном, анисовом, мятном и других), а также в молодых плодах гороха. А. является одним из продуктов, промежуточно… … Большая медицинская энциклопедия
ацетальдегид — (уксусный альдегид), СН3СНО, бесцветная жидкость с резким запахом, tкип 20,2ºC. Сырьё в производстве уксусной кислоты, уксусного ангидрида, пентаэритрита. * * * АЦЕТАЛЬДЕГИД АЦЕТАЛЬДЕГИД (уксусный альдегид), СН3СНО, бесцветная жидкость с резким… … Энциклопедический словарь
ацетальдегид — (см. ацет. ) органическое соединение, альдегид уксусной кислоты; жидкость, кипящая при 20 с; получается из ацетилена или этилового спирта; примен. для производства уксусной кислоты, различных фармацевтических препаратов и др. Новый словарь… … Словарь иностранных слов русского языка
ацетальдегид — acetaldeh >Chemijos terminų aiškinamasis žodynas
ацетальдегид — см. Уксусный альдегид … Большой медицинский словарь
| Ацетальдегид | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | этаналь |
| Традиционные названия | ацетальдегид, метилформальдегид |
| Хим. формула | СH3СHO |
| Рац. формула | С2H4O C 54,53 %, H 9,15 %, O 36,32 % |
| Физические свойства | |
| Состояние | бесцветная жидкость, с резким запахом |
| Молярная масса | 44,0526 ± 0,0022 г/моль |
| Плотность | 0,784 г/см³ |
| Динамическая вязкость | |
| Энергия ионизации | 10,22 ± 0,01 эВ [2] |
| Термические свойства | |
| Т. плав. | −123,37 °C |
| Т. кип. | 20,2 °C |
| Т. всп. | −36 ± 1 °F [2] |
| Т. воспл. | 234,15 K (−39 °C) °C |
| Т. свспл. | 458,15 K (185 °C) °C |
| Пр. взрв. | 4-60 % |
| Кр. точка | 192,85 |
| Энтальпия образования | -166 кДж/моль |
| Давление пара | 2,76 50 ; 4,86 70 ; 10,0 100 [1] атм |
| Химические свойства | |
| pKa | 13,57 (25 °C) |
| Растворимость в воде | С водой, этанолом смешивается во всех соотношениях. |
| Оптические свойства | |
| Показатель преломления | 1,3316 |
| Структура | |
| Дипольный момент | 2,750 ± 0,006 Д |
| Классификация | |
| Рег. номер CAS | 75-07-0 |
| PubChem | 177 |
| Рег. номер EINECS | 200-836-8 |
| SMILES | |
| Рег. номер EC | 200-836-8 |
| RTECS | AB1925000 |
| ChEBI | 15343 |
| Номер ООН | 1089 |
| ChemSpider | 172 |
| Безопасность | |
| ПДК | 5 мг/м 3 |
| ЛД50 | 1232 мг/кг (мыши, внутрижелудочно), 900 мг/кг (мыши, перорально), 661 мг/кг (крысы, перорально) |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
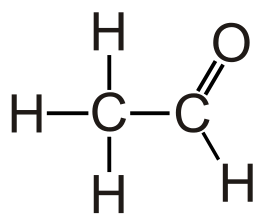
Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов с химической формулой CH3-CHO , является альдегидом этанола и уксусной кислоты. Это один из наиболее важных альдегидов, широко встречающийся в природе и производится в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма. Также производится окислением этанола.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Содержание
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Физические свойства [ править | править код ]
Вещество представляет собой бесцветную ядовитую жидкость, при стандартных условиях, бесцветный газ с резким запахом, похожим на запах прелых яблок, хорошо растворяется в воде, спирте, эфире. Из-за очень низкой температуры кипения (20,2 °C) хранят и перевозят ацетальдегид в виде тримера — паральдегида, из которого он может быть получен нагреванием с минеральными кислотами (обычно серной).
Видео:10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химииСкачать

Получение [ править | править код ]
В 2003 глобальное производство было около миллиона тонн в год.
Основной способ получения — окисление этилена (процесс Вакера):
2 C H 2 = C H 2 + O 2 → 2 C H 3 C H O >CH_ +O_
ightarrow 2CH_ CHO>>>
В качестве окислителя в процессе Вакера используется хлорид палладия, регенерирующийся окислением хлоридом меди в присутствии кислорода воздуха:
C H 2 = C H 2 + P d C l 2 + H 2 O → C H 3 C H O + P d + 2 H C l >CH_ +PdCl_ +H_ O
ightarrow CH_ CHO+Pd+2HCl>>> 
ightarrow PdCl_ +2CuCl>>> 
ightarrow 4CuCl_ +2H_ O>>>
Также получают уксусный альдегид гидратацией ацетилена в присутствии солей ртути (реакция Кучерова), с образованием енола, который изомеризуется в альдегид:
C 2 H 2 + H 2 O → H g 2 + , H + C H 3 C H O H_ +H_ O ],H^ >>CH_ CHO>>>
Другой метод доминировал до открытия процесса Вакера. Он состоял в окислении или дегидрировании этилового спирта, на медном или серебряном катализаторе.
C 2 H 5 O H → A g , o C C H 3 C H O + H 2 H_ OH ] C>>CH_ CHO+H_ >>> 
Видео:Получение и изучение свойств этилена. Опыт 2Скачать

Реакционная способность [ править | править код ]
По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом, и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами: активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы, вследствие индуктивного эффекта карбонила.
Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризируется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6⋅10 −5 при комнатной температуре [3] ):
Реакция конденсации [ править | править код ]
Из-за небольших размеров молекулы и доступности в виде безводного мономера (в отличие от формальдегида) ацетальдегид является широко распространённым электрофильным агентом в органическом синтезе [4] . Что касается реакций конденсации, альдегид прохирален. Он используется, в основном, как источник синтона «CH3C + H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксиэтила. В одной из реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(CH2OH)4.)
В реакции Штрекера [5] ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин [6] . Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиден циклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация [7] .
Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин») [8]
Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Её можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой:
C H 3 — C H O + C H 3 — C H O → C H 3 — C H ( O H ) — C H 2 — C H O >CHO+CH_ >CHO
ightarrow CH_ >CH(OH) >CH_ >CHO>>>
Производные ацеталя [ править | править код ]
Три молекулы ацетальдегида конденсируются, образуя «паральдегид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид.
Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт CH3CH(OCH2CH3)2 называется «ацеталь» [9] , хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR’)2.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Применение [ править | править код ]
Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров.
Традиционно ацетальдегид, в основном, использовался в качестве прекурсора к уксусной кислоте. Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производится из метанола с помощью процессов Монсанто [10] и Катива [11] . В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротональдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетата.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Биохимия [ править | править код ]
В печени имеется фермент алкогольдегидрогеназа, который окисляет этанол в ацетальдегид, который затем окисляется в безопасную уксусную кислоту посредством ацетальдегиддегидрогеназы. Эти две реакции окисления связаны с восстановлением NAD + в NADH [12] . В мозгу алкогольдегидрогеназа не играет особой роли в окислении этанола в ацетальдегид, это делает энзим каталаза. Конечные шаги алкогольной ферментации в бактериях, растениях и дрожжах включают конверсию пирувата в ацетальдегид под действием пируват декарбоксилазы, после чего — конверсию ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, но уже в обратном направлении.
Табачная зависимость [ править | править код ]
Ацетальдегид — значительная часть дыма табака. Была продемонстрирована синергическая связь с никотином, увеличивающая появление зависимости, особенно у молодёжи. [13] [14]
Болезнь Альцгеймера [ править | править код ]
Люди, у которых отсутствует генетический фактор конверсии ацетальдегида в уксусную кислоту, могут иметь большой риск предрасположенности к болезни Альцгеймера. «Эти результаты указывают, что отсутствие ALDH2 — это фактор риска для поздно возникающей болезни Альцгеймера.» [15]
Проблема алкоголя [ править | править код ]
Ацетальдегид, полученный из поглощённого этанола, связывает ферменты, образуя аддукты, связанные с заболеваниями органов. [16] Лекарство дисульфирам (Antabuse) предотвращает окисление ацетальдегида до уксусной кислоты. Это даёт неприятные ощущения при принятии алкоголя. Antabuse используется в случае, когда алкоголик сам хочет излечиться.
Канцероген [ править | править код ]
Ацетальдегид является канцерогеном первой группы. [17] [18] «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) в экспериментах на животных», кроме того, ацетальдегид повреждает ДНК [19] и вызывает несоразмерное с общей массой тела развитие мускулов, связанное с нарушением белкового равновесия организма. [20] В результате исследования 818 алкоголиков ученые пришли к выводу, что у тех пациентов, которые подвергались действию ацетальдегида в большей степени, присутствует дефект в гене фермента алкогольдегидрогеназы. Поэтому такие пациенты подвержены большему риску развития рака верхней части ЖКТ и печени. [21]
Безопасность [ править | править код ]
Ацетальдегид токсичен при действии на кожу, ирритант, канцероген. Однако токсичность ацетальдегида ниже, чем у формальдегида, так как ацетальдегид в организме быстро окисляется до безвредной уксусной кислоты. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Кроме того, этаналь образуется при термической обработке полимеров и пластиков. [22]
При длительном контакте с воздухом могут образоваться перекиси, и произойти взрыв, который может разрушить ёмкость [23]
Санитарно-гигиенические рекомендации [23] [ править | править код ]
- Кожа: Использование адекватной защитной одежды для предотвращения контакта с кожей.
- Глаза: Использование адекватных средств индивидуальной защиты (СИЗ) глаз
- Переодевание: При намокании (из-за пожароопасности)
- Рекомендации: Установить фонтанчики для промывки глаз, оборудовать места для быстрого переодевания
Применение СИЗОД [23] [ править | править код ]
При превышении ПДК следует использовать изолирующие СИЗОД с постоянным избыточным давлением под полнолицевой маской (подача воздуха по потребности под давлением и т. п.). При использовании шланговых СИЗОД они должны быть укомплектованы вспомогательным автономным дыхательным аппаратом с постоянным избыточным давлением под маской и сроком службы, достаточным для покидания опасного места при нарушении подачи воздуха по шлангу.
Для эвакуации могут использоваться фильтрующие СИЗОД с полнолицевой маской и фильтрами для защиты от паров органических соединений, или изолирующий самоспасатель.
Врожденная непереносимость алкоголя [ править | править код ]
Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида.
Видео:Опыты по химии. Получение ацетилена и опыты с нимСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📺 ВидеоПолимеры. Ч.3-3. Полимеризация этилена (элементарно о реакции)Скачать  Химия 10 класс (Урок№3 - Непредельные углеводороды – алкены.)Скачать  Получение этилена и изучение его свойствСкачать  8 класс. ОВР. Окислительно-восстановительные реакции.Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Химические свойства алкенов | Химия 10 класс | УмскулСкачать  2.2. Алкены: Способы полученияСкачать  7.3. Спирты: Способы получения. ЕГЭ по химииСкачать  10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Альдегиды и кетоны: цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать  10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать  |