Современный процесс получения аммиака основан на его синтезе из азота и водорода при температурах 380 — 450 0C и давлении 250 атм с использованием железного катализатора:
N2 (г.) + 3H2 (г.) = 2NH3 (г.)
Азот получают из воздуха. Водород получают восстановлением воды (пара) с помощью метана из природного газа либо из лигроина. Лигроин (нафта) представляет собой жидкую смесь алифатических углеводородов, которая получается при переработке сырой нефти (см. гл. 18).
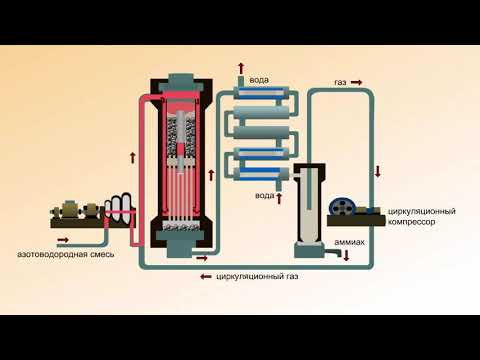
Работа современного аммиачного завода очень сложна. На рис. 7.2 показана упрощенная схема действия аммиачного завода, работающего на природном газе. Эта схема действия включает восемь стадий.
1-я стадия. Удаление серы из природного газа. Это необходимо, поскольку сера представляет собой каталитический яд (см. разд. 9.2).
2-я стадия. Получение водорода восстановлением пара при 750 0C и давлении 30 атм с помощью никелевого катализатора:
CH4 (г.) + H2O (г.) = СО (г.) + ЗН 2 (г.)
3-я стадия. Впуск воздуха и сгорание части водорода в кислороде вводимого воздуха:
2H2 (г.) + O2 (г.) = 2H2O (г.) В результате получается смесь водяного пара, моноксида углерода и азота. Водяной пар восстанавливается с образованием водорода, как на 2-й стадии.
4-я стадия. Окисление моноксида углерода, образующегося на стадиях 2 и 3, до диоксида углерода по следующей реакции «сдвига»: СО (г.) + H2O (г.) = CO2 (г.) + H2 (г.)
Этот процесс проводится в двух «реакторах сдвига». В первом из них используется катализатор из оксида железа и процесс проводится при температуре порядка 400 0C Во втором используется медный катализатор и процесс проводится при температуре 220°С.
5-я стадия. Вымывание диоксида углерода из газовой смеси при помощи буферного щелочного раствора карбоната калия или раствора какого-либо амина, например этаноламина NH2CH2CH2OH. Диоксид углерода в конце концов сжижают и используют для производства мочевины, либо выпускают в атмосферу.
6-я стадия. После 4-й стадии в газовой смеси остается еще около 0,3% моноксида углерода. Поскольку он может отравлять железный катализатор во время синтеза аммиака (на 8-й стадии), моноксид углерода удаляют путем конверсии водородом в метан на никелевом катализаторе при температуре 325°С.
7-я стадия. Газовую смесь, которая теперь содержит приблизительно 74% водорода и 25% азота, подвергают сжатию; при этом ее давление возрастает от 25-30 атм до 200 атм. Поскольку это приводит к повышению температуры смеси, ее сразу же после сжатия охлаждают.
8-я стадия. Газ из компрессора поступает теперь в «цикл синтеза аммиака». Схема, приведенная на рис. 7.2, дает упрощенное представление об этой стадии. Сначала газовая смесь попадает в каталитический конвертер, в котором используется железный катализатор и поддерживается температура 380-450°С. Газовая смесь, выходящая из этого конвертера, содержит не более 15% аммиака. Затем аммиак сжижают и направляют в приемный бункер, а непрореагировавшие газы возвращают в конвертер.
Видео:Схема установки для производства аммиакаСкачать
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Видео:Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Способы получения аммиака в промышленности и лаборатории
Получение аммиака происходит различными методами. Этот процесс осуществляется как в лаборатории, так и на промышленном производстве. Легковесный газ с резким запахом состоит из азота и водорода. Чаще всего он используется для изготовления удобрений, полимеров и некоторых кислот.
Видео:Практическая работа №4 Получение аммиака и изучение его свойствСкачать

История получения
Аммиак известен с давних времен. По сведениям ученых, свое название он получил в честь бога Амона, которого почитали в Древнем Египте. Образовывался газ в результате разложения мочевины в жарком климате. Резкий запах соединения египтяне связывали с культом божества.
В чистой форме аммиак H2+N2=NH3+Q получил известный ученый Джозеф Луи Пристли. В своей лаборатории он нагревал хлорид аммония с гашеной известью. Такая схема до сих пор используется, если нужно получить на выходе небольшое количество газа. Полученный аммиак Пристли собирал надо ртутью. Раствор в водной основе имеет признаки щелочи.
В 1784 году французский химик Бертолле разложил аммиак на элементный состав. Спустя 3 года было утверждено официальное название «нашатырь». Оно сохраняется до сих пор в ряде западноевропейских языков.
Видео:Химия. 9 класс. Получение аммиака. Производство аммиака /19.02.2021/Скачать

Промышленный метод
Получение аммиака в промышленности происходит на основе азота, который соединяют с водородом. Последний берут из воды, азот набирают в воздухе. Метод разработал Фриц Габер. Сейчас процесс получения аммиака в производстве носит имя этого ученого.
Реакция 3H2+N2=2NH3+Q происходит при понижении объема и выходе тепла. Поскольку она обратима, то необходимо соблюдать некоторые условия. Высокое давление и небольшие температуры способствуют повышению объема полученного аммиака, при этом происходит замедление процессов. Благодаря сохранившимся описаниям первых опытов удалось обеспечить необходимые параметры для создания реакций:
- Температура должна достичь 500 °C.
- Давление — 350 атмосфер.
- В качестве катализатора выступает оксид железа (магнетит). К нему добавляют части оксида серебра, кальция и других веществ.
Газ, который удалось сделать в таких условиях, имеет 30% аммиака. Чтобы избежать обратной реакции, вещество требуется охладить, тогда оно превратится в жидкость. В то же время не до конца израсходованные газы будут возвращены в синтез. Тогда можно собрать аммиак в большом количестве с возможностью максимального использования полученного сырья.
Видео:Производство аммиака учебный фильм Союза химиковСкачать

Лабораторный способ
Лабораторный способ получения вещества обеспечивается благодаря действию щелочи на твердые соли аммония. Для этого используют формулу 2NH4Cl+CaOH2=2NH3+2H2O+c=CaCl2. Собирание проводят в перевернутую пробирку из-за воздуха, так как он легче по плотности. Распознавание происходит следующими методами:
- по запаху;
- лакмусовая бумажка окрасится в синий цвет;
- от поднесенной стеклянной палочки, смоченной в HCl, будет идти дым белого цвета.
Полностью осушить газ можно смесью извести и едкого натрия. Через нее пропустят получившуюся реакцию. С аналогичной целью жидкий аммиак перемешивается с металлическим натрием, после чего подвергается дистилляции. Благодаря этому будет легче распознать газ.
Видео:получение аммиакаСкачать

Химические свойства
Газ представляет собой довольно реакционное вещество. В таком виде NH3 окисляется. Продукт окисления будет зависеть как от силы окислителя, так и от условий проведения реакции. Например, 8NH3+3Cl2=N2+6NH4Cl или 2NH3+2Na=2NaNH2+H2.
Водный раствор обычно называют нашатырным спиртом. При этом его не относят к соответствующей группе, так как это неорганическое соединение. У химиков такой продукт называют гидроксидом аммония.
Также NH3 относится к лигандам в комплексных соединениях. Его молекулы образовывают донорные связи как с водородом, так и с частью переходных металлов в виде меди или кобальта. Это приведет к появлению растворимых химикатов. Они применяются в качестве реактивов для качественного анализа.
NH3 можно получить различными методами, которые описываются соответствующими уравнениями. В промышленных масштабах газ получают смешиванием азота и водорода. Благодаря своим свойствам его можно применять как на производстве, так и в лабораториях и рабочих условиях.
💥 Видео
Практическая работа получение аммиакаСкачать

Промышленное получение аммиака. 11 класс.Скачать

Производство аммиака, 1987Скачать

Промышленный синтез аммиакаСкачать

Аммиак. 9 класс.Скачать

Видео 360 | Производство аммиака. Неорганическая химия. Азот.Скачать

Опыты по химии. Получение и собирание аммиакаСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Галилео. Эксперимент. Растворение аммиакаСкачать

Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Получение аммиака и сульфата аммонияСкачать

Севдон. Получение аммиакаСкачать

Практическая работа химия 9 класс: аммиакСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать










