Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Видео:Получение аммиака и изучение его свойствСкачать

Практическая работа № 7(c). Получение аммиака и изучение его свойств
Получение аммиака. Проведем все действия, описанные в учебнике.
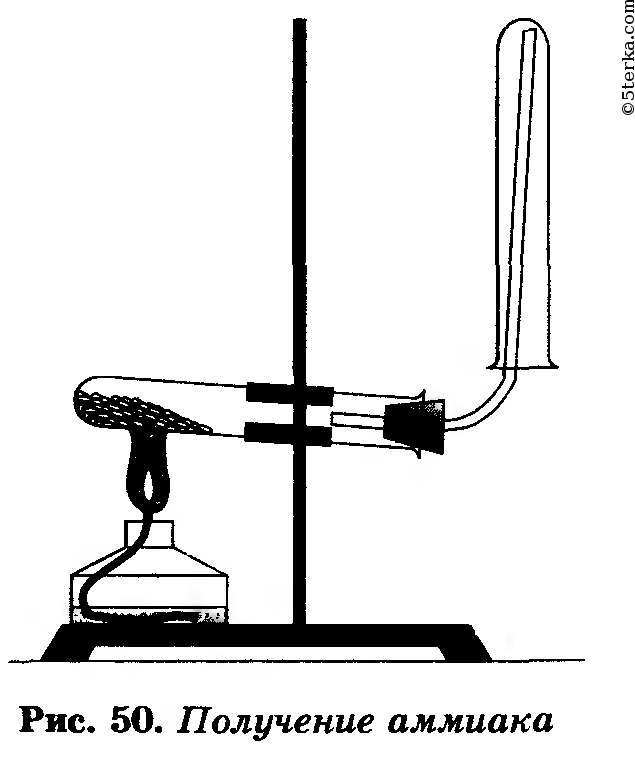
Соберите прибор, как показано на рисунке 50.
На лист бумаги или в небольшую фарфоровую чашку (можно ступку) насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ).
Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой с газоотводной трубкой и укрепите в лапке штатива.
При укреплении прибора в лапке штатива обратите внимание на наклон пробирки относительно ее отверстия. На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 дви
жения пламени), а затем нагрейте в том месте, где находится смесь. Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку. Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную концентрированной соляной кислотой. Что вы наблюдаете? Напишите уравнения реакции.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, осторожно снимите с газоотводной трубки, держа ее вверх дном (конец газоотводной трубки сразу же после снятия с нее пробирки с аммиаком закройте кусочком мокрой ваты).
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Снова закройте пальцем отверстие пробирки под водой и выньте ее из сосуда.
1. Почему в данном случае пробирку со смесью веществ нужно укреплять в лапке штатива так, чтобы ее дно было несколько выше открытого конца? Запись уравнения реакции между хлоридом аммония и гидроксидом кальция поможет вам ответить на вопрос.
2. Почему аммиак собирают в перевернутую вверх дном пробирку? Какие еще газы можно собирать таким способом?
3. Что можно наблюдать, если вместо соляной кислоты поднести к отверстию пробирки с аммиаком палочку, смоченную концентрированной азотной кислотой? Напишите уравнение реакции.
4. Как доказать, что в водном растворе аммиака содержатся гидроксид-ионы?
Изучение свойств водного раствора аммиака
1. В пробирку налейте 2—3 мл водного раствора аммиака и добавьте 2—3 капли раствора фенолфталеина. Каков цвет раствора? Нагрейте этот раствор до кипения. Как изменится окраска раствора? Чем вызвано это изменение?
2. Налейте в пробирку 2—3 мл водного раствора аммиака. Добавьте 2—3 капли раствора фенолфталеина и приливайте по каплям раствор соляной кислоты до исчезновения малиновой окраски. Почему исчезла окраска? Напишите ионные уравнения реакции (полное и сокращенное).
3. В пробирку налейте 2—3 мл водного раствора хлорида алюминия и добавьте еще столько же водного раствора аммиака. Что вы наблюдаете? Напишите ионные уравнения реакции (полное и сокращенное).
Изучение свойств водного раствора аммиака.

задача №7
к главе «Практические работы».
Видео:Получение АММИАКА NH3. Реакция ХЛОРИДА АММОНИЯ и ГИДРОКСИДА НАТРИЯ. Опыты по химии дома.ЭкспериментыСкачать

Получение аммиака

Средняя оценка: 4.2
Всего получено оценок: 247.
Средняя оценка: 4.2
Всего получено оценок: 247.
Аммиак (NH3) – соединение азота и водорода. Это лёгкий газ с резким запахом. Получение аммиака в промышленности и лабораториях необходимо для производства удобрений, полимеров, азотной кислоты и других веществ.
Видео:Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

В промышленности
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород – из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура – 500°C;
- давление – 350 атм;
- катализатор – оксид железа Fe3O4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы – азот и водород – возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.

Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
Видео:Получение хлорида аммонияСкачать

В лаборатории
Для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
Также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O;
- NH4OH ↔ NH3↑ + H2O.
Полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. Для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Видео:Практическая работа №4 Получение аммиака и изучение его свойствСкачать

Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве – для производства азотсодержащих удобрений;
- в промышленности – для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии – для изготовления азотной кислоты, соды;
- в медицине – в качестве нашатырного спирта.

Видео:Получение аммиака и сульфата аммонияСкачать

Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
🔍 Видео
Практическая работа получение аммиакаСкачать

хлорид аммония с гидроксидомСкачать

Получение хлорида аммонияСкачать

Взаимодействие хлорида аммония с гидроксидом натрия | ЕГЭ по химииСкачать

Опыты по химии. Получение и собирание аммиакаСкачать

Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Хлорид Аммония. Аммиак. МНОГО ДЫМА БЕЗ ОГНЯ!Скачать

Аммиак и соли аммония. 11 класс.Скачать

Получаю хлорид аммония из концентрированной соляной кислоты и аммиака. #химия #химияснуля #учительСкачать

Практическая работа химия 9 класс: аммиакСкачать

Получение аммиака NH3Скачать

NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Получение аммиакаСкачать

Аммиак. 9 класс.Скачать