- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Аммиачная вода: формула, получение, применение
- Описание
- Получение
- Физические свойства
- Химические свойства
- Техника безопасности при работе с веществом
- Где используется водный раствор аммиака?
- Применение аммиачной воды в сельском хозяйстве
- Аммиачная вода: получение, формула, применение
- Образование иона аммония
- Меры предосторожности
- Получение гидроксида аммония. Физические свойства
- Химические свойства гидроксида аммония
- Аммиачная вода: применение в разных отраслях хозяйства
- Соли аммония: свойства и практическое значение
- 🔥 Видео
Аммиак
Строение молекулы и физические свойства
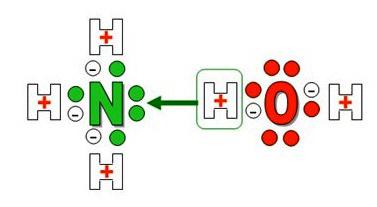
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
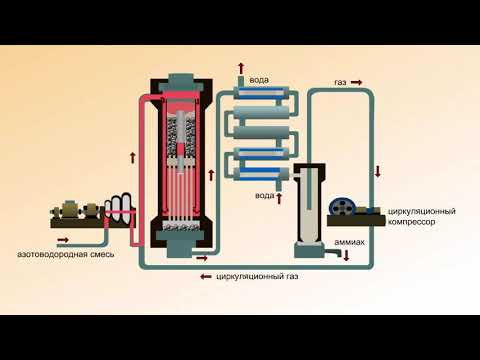
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
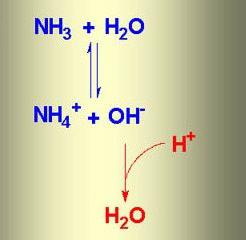
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Видео:Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Аммиачная вода: формула, получение, применение
Аммиачная вода находит широкое применение в качестве реагента в синтезе различных веществ, а также как удобрение в сельском хозяйстве. Наибольший эффект достигается при одновременном ее внесении в почву с органикой. Основной промышленный способ получения вещества — насыщение воды парами аммиака.
Видео:Схема установки для производства аммиакаСкачать
Описание
Аммиачная вода (синонимы: гидрат аммиака, гидроокись аммония) представляет собой водный раствор аммиака, в котором он присутствует в основном в виде гидроксида аммония. Концентрация аммиака обычно составляет 22 или 25 %.
Химическая формула аммиачной воды такая: NH3H2O.
По внешнему виду вещество представляет собой бесцветную или светло-желтую жидкость с резким запахом нашатырного спирта. Раствор хранят герметично укупоренным в помещениях, защищенных от воздействия атмосферы. Следует избегать контакта тары с источниками тепла и прямыми солнечными лучами.
В зависимости от целей использования это вещество выпускают двух марок:
- А — для применения в различных отраслях. Изготовление раствора производится с помощью парового конденсата или химически очищенной воды.
- Б — для нужд сельского хозяйства (более низкой степени чистоты).
Требования к техническому аммиаку марки А изложены в ГОСТ 9-92. Существует также государственный стандарт, регламентирующий характеристики этого вещества, применяемого в химии в качестве реактивов (ГОСТ 3760-79). Согласно этому документу выделяют 3 степени чистоты раствора: х. ч. (химически чистый), ч. д. а. (чистый для анализов), ч. (чистый).
Видео:Опыты по химии. Растворение аммиака в водеСкачать

Получение
Получение аммиачной воды производится несколькими способами:
- Испарением жидкого аммиака и поглощением его паров в абсорбере с жидкостным рециклом. Перед подачей в хранилище готовый продукт охлаждается низкотемпературным хладоносителем.
- Смешиванием сжиженного аммиака с водой (без его испарения) под давлением. Оба вещества подаются в смеситель при помощи насосов.
- Впрыскиванием концентрированного жидкого аммиака в реактор со скоростью до 12,5 м/с и подачей воды со скоростью до 6 м/с. Такая технология позволяет непрерывно получать гидроксид аммония.
Первый способ является наиболее распространенным. Применяемый при этом аммиак может быть получен синтетическим путем или при коксовании каменного угля в печах. Реакция синтеза обратима. В ходе образования продукта выделяется тепло, для устранения которого используют холодильники, охлаждаемые оборотной водой. В растворах гидроксид аммония находится в равновесии с аммиаком. По этой причине жидкость имеет характерный аммиачный запах.
Видео:Аммиак. 9 класс.Скачать

Физические свойства
Основными физическими характеристиками этого вещества являются следующие:
- плотность аммиачной воды (25 % раствор, температура +15 ˚С) — 910-930 кг/м 3 ;
- молярная масса — 35,046 г/моль;
- давление паров аммиака (при температуре +40 ˚С) — 1 атм.;
- плотность паров — 0,59 г/см 3 ;
- температура, при которой происходит выпадение твердой фазы — -31…-53,9 ˚С;
- температура самовоспламенения — 651 ˚С.
При транспортировке и хранении аммиак способен улетучиваться, в результате наблюдается потеря азота в составе соединения.
Чугун и черные металлы, резина и алюминий устойчивы к воздействию гидроксида аммония. Цветные металлы и их сплавы при контакте с ним корродируют.
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Химические свойства
К основным химическим параметрам вещества относятся:
- слабые основные свойства вследствие диссоциации в воде на катионы аммония и анионы гидроксида (-ОН);
- окраска индикаторов: лакмусовая бумага — синий, фенолфталеин — малиновый;
- раствор бурно реагирует при контакте с концентрированными кислотами, сильными окислителями, альдегидом акриловой кислоты, галогенами, диметилсульфатом (со взрывом), азотнокислым серебром, ртутью.
В нормальных условиях продукт химически стабилен. При взаимодействии с кислотами аммиачная вода образует соответствующие соли аммония.
Видео:Аммиак и соли аммония. 11 класс.Скачать

Техника безопасности при работе с веществом
Сам по себе водный раствор аммиака является негорючей и невзрывоопасной жидкостью, но при выделении паров аммиака в помещениях могут скапливаться взрывоопасные концентрации. Даже в малых концентрациях они вызывают следующие негативные реакции со стороны организма человека:
- обильное слезотечение;
- сильный кашель;
- удушье;
- ринит;
- головокружение;
- разъедание желудочно-кишечного тракта при проглатывании;
- ожог слизистых оболочек;
- отек легких при накоплении в них паров (в результате длительного вдыхания в течение 48 часов), что в конечном итоге может привести к смерти.
Поэтому при работе с этим веществом соблюдают следующие меры предосторожности:
- использование вытяжного шкафа;
- герметизация технологического оборудования и тары;
- использование средств индивидуальной защиты: резиновых перчаток, спецодежды, противогазов и защитных очков.
Это соединение является также токсичным для флоры и фауны водоемов.
Видео:Получение аммиака и изучение его свойствСкачать

Где используется водный раствор аммиака?
10 % аммиачный раствор в воде — это всем известная «нашатырка», или нашатырный спирт. В медицине его традиционно использовали при обмороках. В быту это соединение применяют в следующих целях:
- чистка ювелирных изделий из серебра;
- мойка окон и других глянцевых, зеркальных поверхностей (для устранения разводов);
- удаление пятен на тканях;
- устранение неприятных запахов в холодильнике.
Существуют также другие области использования этого соединения:
- химическая промышленность — производство соды, марганца, азотной кислоты, ферросплавов, полимерных материалов и красителей;
- военная промышленность — изготовление взрывчатых веществ;
- пищевая промышленность — добавка Е527 (эмульгатор);
- текстильная промышленность — крашение тканей;
- производство холодильной техники — хладагент;
- строительство — противоморозная и антикоррозионная добавка в железобетонных конструкциях;
- другие отрасли — серебрение зеркал, изготовление светокопировальных материалов.
Видео:Галилео. Эксперимент. Растворение аммиакаСкачать

Применение аммиачной воды в сельском хозяйстве
Гидрат аммиака — дешевый и эффективный источник азота для сельскохозяйственных культур, особенно необходимый в период их вегетативного роста. Растения лучше всего усваивают этот элемент в виде солей азотной кислоты и солей аммония. При поглощении аммиака частицами почвы он диссоциирует на катионы аммония и ионы нитратов. Аммиачный азот имеет высокую степень подвижности в грунте и легко мигрирует с его жидкой фазой.
Существуют следующие особенности использования аммиачной воды в качестве удобрения:
- Период внесения в почву — осенью под перепашку земли (сентябрь), весной — под предпосевное рыхление (апрель), подкормка культур с большими площадями питания в течение всего лета (кукуруза, свекла и другие).
- Применение возможно на всех видах почв. Особенно эффективно использование удобрения на грунтах с тяжелым механическим составом, так из легкой почвы аммиак быстро улетучивается.
- Не рекомендуется применять гидрат аммония на одном и том же месте подряд в течение нескольких лет, поскольку он повышает минерализацию почвы. Это способствует уменьшению содержания органики в ней.
- На легких почвах удобрение лучше вносить весной. Земля должна прогреться до температуры не менее +10 ˚С.
- Водный аммиак необходимо заделывать глубоко в почву (на 10 и 15 см в тяжелую и легкую соответственно). Поверхностное внесение недопустимо, чтобы предотвратить испарение аммиака. Для этого в сельском хозяйстве используют специальные машины. Можно эту процедуру проводить также одновременно с поливом в прохладную погоду.
Такое удобрение позволяет получить высокий урожай и сохранить плодородие земли. Его влияние на характеристики почвы также заключается в следующем:
- Аммиачная вода подкисляет почву, поэтому для ее нейтрализации необходимо вносить карбонат кальция CaCO3 (в расчете 0,3 ц на 1 ц гидрата аммония).
- После подкормки в зоне распространения удобрения наблюдается снижение количества микроорганизмов. Через 6-8 недель после того, как аммиак превратится в нитраты, их число увеличивается в результате роста растительных остатков. То же наблюдается с дождевыми червями.
Кроме этого, аммиачную воду в сельском хозяйстве применяют для аммонизации кормов и антисептической обработки помещений.
Видео:Аммиак. Химия 9 классСкачать

Аммиачная вода: получение, формула, применение
Бесцветный газ с резким запахом аммиак NH3 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами H2O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Образование иона аммония
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Видео:Опыты по химии. Получение и собирание аммиакаСкачать

Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа NH3, увеличивается количество менее вредных для живых организмов катионов NH4 +
Видео:Производство аммиака учебный фильм Союза химиковСкачать

Получение гидроксида аммония. Физические свойства
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – NH4OH, но на самом деле одновременно присутствуют ионы
NH4 + , OH – , молекулы NH3 и H2O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Видео:Практическая работа получение аммиакаСкачать

Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота — покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.
Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона NH4 + бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: NH4OH + HCl = NH4Cl + H2O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2 (синий осадок).
Видео:9 класс § 30 "Аммиак. Соли аммония".Скачать

Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.
На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом — 10-процентным раствором аммиака.
Видео:Опыты по химии. Свойства водного раствора аммиакаСкачать

Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
🔥 Видео
Химия. 9 класс. Свойства и получение аммиака /17.02.2021/Скачать

Практическая работа №4 Получение аммиака и изучение его свойствСкачать

Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Промышленное получение аммиака. 11 класс.Скачать

Получение аммиака и сульфата аммонияСкачать