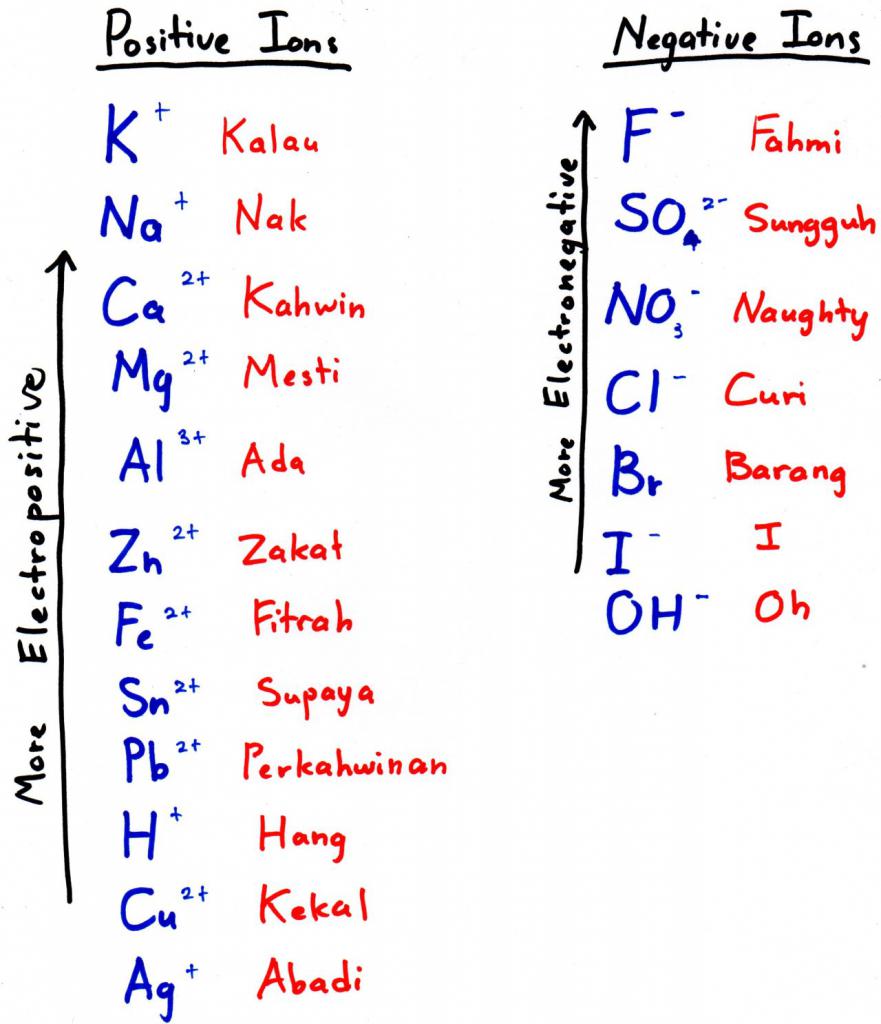
Алюминий обладает свойствами, которые применимы во многих промышленностях: военном деле, строительстве, питании, транспорте и др. Он пластичный, легкий и широко распространен в природе. Многие люди даже не подозревают того, как широко можно использовать алюминий.
Многие сайты и книги описывают этот чудесный металл и его свойства. Информация находится в свободном доступе.
В лаборатории можно производить любые соединения алюминия, но в малых количествах и по высоким ценам.
- История добычи элемента
- Как из оксида алюминия получить алюминий
- Как получить алюминий из оксида алюминия через добавление более электроотрицательного металла
- Промышленный способ
- Получение хлорида алюминия
- Получение гидроксоалюмината натрия
- Про метаалюминаты
- Получение сульфата алюминия
- Бокситы
- Получение оксида алюминия
- Соли: комплексные и не очень
- Использование солей
- Эпилог
- Алюминий
- Алюминий. Химия алюминия и его соединений
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- 🎬 Видео
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

История добычи элемента
Вплоть до середины девятнадцатого века ни об алюминии, ни о восстановлении его оксида речи не шло. Первая попытка получения алюминия была предпринята химиком Х. К. Эрстедом и закончилась успешно. Чтобы восстановить металл из его оксида, он использовал амальгамированный калий. Но никто не понял, что получилось в итоге.
Прошло несколько лет, и алюминий снова был получен химиком Велером, который нагрел безводный хлорид алюминия с калием. Ученый упорно трудился 20 лет и, наконец, сумел создать гранулированный металл. По цвету он напоминал серебро, но был легче него в несколько раз. Длительное время до начала двадцатого века алюминий ценился больше золота и выставлялся в музеях как экспонат.
Где-то в начале XIX века английский химик Дэви провел электролиз оксида алюминия и получил металл, названный «алюмиум» или «алюминум», что можно переводить как «квасцы».
Алюминий очень трудно отделить от других веществ — это одна из причин его дороговизны в то время. Ученое собрание и промышленники быстро узнали о потрясающих свойствах нового металла и продолжили попытки его добычи.
В больших количествах алюминий стали получать уже в конце того же девятнадцатого века. Ученый Ч. М. Холлом предложил растворять оксид алюминия в расплаве криолита и пропускать эту смесь через электрический ток. Через какое-то время в сосуде появлялся чистый алюминий. В промышленности и сейчас производят металл этим методом, но об этом позже
Для производств нужна прочность, которой, как выяснилось чуть позднее, у алюминия не было. Тогда металл стали сплавлять с иными элементами: магнием, кремнием и т. д. Сплавы были намного прочнее обычного алюминия — именно из них стали выплавлять самолеты и военную технику. А придумали слить алюминий и другие металлы в единое целое в Германии. Там же, в Дюрене, сплав, названный дюралюминием, поставили на производство.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Как из оксида алюминия получить алюминий
В рамках школьной программы по химии проходят тему «Как из оксида металла получить чистый металл».
К этому методу мы можем отнести и наш вопрос, как из оксида алюминия получить алюминий.
Чтобы образовать металл из его оксида, нужно добавить восстановитель — водород. Пойдет реакция замещения с образованием воды и металла: МеО + Н2 = Ме + Н2О (где Ме — металл, а Н2 — водород).
На практике такой прием позволяет получать чистые активные металлы, которые не восстанавливаются оксидом углерода. Метод подходит для очистки небольшого количества алюминия и довольно-таки дорого стоит.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как получить алюминий из оксида алюминия через добавление более электроотрицательного металла
Чтобы получить алюминий этим способом, нужно подобрать более электроотрицательный металл и добавить его к оксиду — он вытеснит наш элемент из кислородного соединения. Более электроотрицательный металл — это тот, что стоит левее в электрохимическом ряду (на фото к подзаголовку — выше).
Примеры: 3Mg + Al2О3 = 2Al + 3MgO
Но как получить алюминий из оксида алюминия в условиях широкой промышленности?
Видео:Оксид алюминияСкачать

Промышленный способ
Большинство производств для добычи элемента используют руды, которые называют бокситами. Сначала из них выделяют оксид, потом растворяют его в расплаве криолита, а затем получают чистый алюминий путем электрохимической реакции.
Это обходится дешевле всего и не требует дополнительных операций.
Кроме того, можно получить хлорид алюминия из оксида алюминия. Как это сделать?
Видео:Химия 9 класс (Урок№25 - Алюминий. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.)Скачать

Получение хлорида алюминия
Хлоридом алюминия называют среднюю (нормальную) соль из соляной кислоты и алюминия. Формула: AlCl3.
Для получения нужно добавить кислоту.
Уравнение реакции выглядит следующим образом — Al2О3 + 6HCl = 2AlCl3 + 3Н2О.
Как получить хлорид алюминия из оксида алюминия, не добавляя кислот?
Для этого надо прокалить спрессованную смесь оксида алюминия и углерода (сажа) в токе хлора при 600-800 гр. Хлорид должен отогнаться.
Эту соль применяют в качестве катализатора многих реакций. Ее главная роль — образование продуктов присоединения с разными веществами. Хлоридом алюминия протравливают шерсть, и его добавляют в антиперспиранты. Также соединение играет не последнюю роль в переработке нефти.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение гидроксоалюмината натрия
Как из оксида алюминия получить гидроксоалюминат натрия?
Чтобы получить это сложное вещество, можно продолжить цепочку превращений и сначала получить из оксида хлорид, а потом добавить гидроксид натрия.
Хлорид алюминия — AlCl3, гидроксид натрия — NaOH.
AlCl3 + 4NaOH (концентрированный) = Na[Al(OH)4] + 3NaCl5
Но как из оксида алюминия получить тетрагидроксоалюминат натрия, избегая превращения в хлорид?
Чтобы из оксида алюминия получить алюминат натрия, нужно создать гидроксид алюминия и добавить к нему щелочь.
Следует напомнить, что щелочь — это основание, растворимое в воде. Сюда относят гидроксиды щелочных и щелочноземельных металлов (I и II группа таблицы Менделеева).
Из оксидов металлов средней активности, к которым относится алюминий, нельзя получать гидроксиды. Поэтому сначала мы восстановим чистый металл, например, через водород:
А потом получим гидроксид.
Чтобы получить гидроксид, надо растворить алюминий в кислоте (для примера, во фтороводородной): 2Al + 6HF = 2AlF3 + 3Н2. А затем прогидролизовать полученную соль с добавлением равного количества щелочи в разбавленном растворе: AlF3 +3NaOH = Al(ОН)3 + 3NaF.
(Al(ОН)3 — амфотерное соединение, которое может взаимодействовать и с кислотами, и с щелочами).
Тетрагидроксоалюминат натрия отлично растворяется в воде, а еще это вещество широко применяют в оформлении и добавляют в бетон, чтобы ускорить отвердевание.
Видео:ПОЛУЧЕНИЕ AlCl3 | ГИДРОКСИД АЛЮМИНИЯ И ЕГО РАСТВОРЕНИЕСкачать

Про метаалюминаты
Начинающие производители глинозема, наверное, задавались вопросом: «Как из оксида алюминия получить метаалюминат натрия?»
Алюминаты используются в широком производстве для ускорения некоторых реакций, окрашивания тканей и получения глинозема.
Лирическое отступление: глинозем — это, по сути, и есть оксид алюминия Al2О3.
Обычно оксид добывают из метаалюминатов, но здесь будет рассмотрен «обратный» способ.
Итак, чтобы получить наш алюминат, нужно просто смешать оксид натрия с оксидом алюминия при очень высокой температуре.
Случится реакция соединения — Al2О3 + Na2О = 2NaAlO2
Для нормального протекания требуется температура в 1200°C.
Можно проследить за изменением энергии Гиббса в реакции:
Еще одно лирическое отступление:
Энергия Гиббса (или «свободная энергия Гиббса») — это зависимость, которая существует между энтальпией (энергией, доступной для преобразований) и энтропией (мерой «хаоса», беспорядка в системе). Абсолютное значение измерить невозможно, поэтому измеряются изменения во время протекания процесса. Формула: G (энергия Гиббса) = Н (изменение энтальпии между продуктами и исходными веществами реакции) — Т (температура) * S (изменение энтропии между продуктами и исходниками). Измеряется в Джоулях.
Как из оксида алюминия получить алюминат?
Для этого подойдет и тот способ, который был рассмотрен выше — с глиноземом и натрием.
Оксид алюминия, смешанный с оксидом другого металла при высоких температурах, и дает метаалюминат.
Но еще можно сплавить гидроксид алюминия со щелочью в присутствии оксида углерода СО:
- Al2О3 + 2КОН = 2KAlO2 + Н2О (здесь глинозем растворяется в едкой щелочи калия) — алюминат калия;
- Al2О3 + Li2О = 2LiAlO2 — алюминат лития;
- Al2О3 + СаО = СаО × Al2О3 — сплавление оксида кальция с окисью алюминия.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение сульфата алюминия
Как получить сульфат алюминия из оксида алюминия?
Способ включен в школьную программу восьмых и девятых классов.
Сульфат алюминия — это соль вида Al2(SO4)3. Представлена может быть в виде пластинок или порошка.
Это вещество может разлагаться на оксиды алюминия и серы при температуре от 580 градусов. Сульфат используется для очистки воды от мельчайших частиц, очень полезен в пищевой, бумажной, тканевой и других отраслях производства. Он широко доступен благодаря своей низкой цене. Очистка воды происходит из-за некоторых особенностей сульфата.
Дело в том, что загрязняющие частицы имеют вокруг себя двойной электрический слой, а рассматриваемый реагент является коагулянтом, который, при проникновении в электрическое поле частиц, вызывает сжатие слоев и нейтрализует заряд частиц.
Теперь о самом методе. Чтобы получить сульфат, нужно смешать оксид и серную (не сернистую) кислоту.
Выходит реакция взаимодействия глинозема с кислотой:
Вместо оксида можно добавить сам алюминий или его гидроксид.
В промышленности для получения сульфата используют уже известную из третьей части этой статьи руду — боксит. Ее обрабатывают серной кислотой и получают «загрязненный» сульфат алюминия. В боксите содержится гидроксид, а реакция в упрощенном виде выглядит так:
Видео:Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать

Бокситы
Боксит — это руда, состоящая сразу из нескольких минералов: железа, бемита, гиббсита и диаспора. Является главным источником добычи алюминия, образуется путем выветривания. Крупнейшие месторождения бокситов находятся в России (на Урале), США, Венесуэле (река Ориноко, штат Боливар), Австралии, Гвинее и Казахстане. Эти руды бывают моногидратными, тригидратными и смешанными.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Получение оксида алюминия
Про глинозем выше сказано много, но до сих пор не описано, как получить оксид алюминия. Формула — Al2О3.
А нужно всего-навсего сжечь алюминий в кислороде. Горение — процесс взаимодействия О2 и другого вещества.
Простейшее уравнение реакции выглядит следующим образом:
Оксид не растворяется в воде, но он хорошо растворим в криолите при высокой температуре.
Свои химические свойства оксид проявляет при температуре от 1000°С. Именно тогда он начинает взаимодействовать с кислотами и щелочами.
В естественных условиях корунд является единственный устойчивой вариацией вещества. Корунд очень твердый, с плотностью примерно 4000 г/м 3 . Твердость этого минерала по шкале Мооса — 9.
Оксид алюминия — амфотерный оксид. Легко преобразовывается в гидроксид (см. выше), а превратившись, сохраняет все свойства своей группы с преобладанием основных.
Амфотерные оксиды — это оксиды, которые могут проявлять как основные (свойства оксидов металлов), так и кислотные (оксидов неметаллов) свойства в зависимости от условий.
К амфотерным оксидам, исключая оксид алюминия, относятся: оксид цинка (ZnO), оксид бериллия (ВеО), оксид свинца (PbO), оксид олова (SnO), оксид хрома (Cr2О3), оксид железа (Fe2О3) и оксид ванадия (V2О5).
Видео:8 класс. Составление уравнений химических реакций.Скачать

Соли: комплексные и не очень
Бывают средние (нормальные), кислые, основные и комплексные.
Средние соли состоят из самого металла и кислотного остатка и имеют вид AlCl3 (хлорид алюминия), Na2SO4 (сульфат натрия), Al(NO3)3 (нитрат алюминия) или MgPO4.
Кислые соли — это соли из металла, водорода и кислотного остатка. Их примеры: NaHSO4, CaHPO4.
Основные соли так же, как и кислые, состоят из кислотного остатка и металла, но вместо Н там ОН. Примеры: (FeOH)2SO4, Ca(OH)Cl.
И, наконец, комплексные соли — это вещества из ионов разных металлов и кислотного остатка многоосновной кислоты (соли, содержащие сложный ион): Na3[Co(NO2)6], Zn[(UO2)3(CH3COO)8].
Речь пойдет о том, как из оксида алюминия получить комплексную соль.
Условием превращения оксида в это вещество является его амфотерность. Глинозем отлично подходит для метода. Чтобы получить комплексную соль из оксида алюминия, нужно смешать этот оксид с раствором щелочи:
Этот род веществ также образуется при воздействии растворов щелочей на амфотерные гидроксиды.
Раствор гидроксида калия взаимодействует с основанием цинка с получением тетрагидроксоцинката калия:
Раствор щелочи натрия реагирует, например, с гидроксидом берилия с образованием тетрагидроксобериллата натрия:
Видео:Решение упражнений по теме Алюминий и его соединенияСкачать

Использование солей
Комплексные соли алюминия часто используют в фармацевтике, производстве витаминов и биологически активных веществ. Препараты, созданные на основе этих веществ, помогают в борьбе с похмельем, улучшают состояние желудка и общее самочувствие организма человека. Очень полезные соединения, как можно заметить.
Реактивы дешевле покупать в интернет-магазинах. Там большой выбор веществ, но сайты лучше выбирать надежные и проверенные временем. Если покупать что-то на «однодневках», то риск потерять деньги увеличивается.
При работе с химическими элементами нужно соблюдать правила безопасности: обязательно наличие перчаток, защитного стекла, специализированной посуды и приборов.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Эпилог
Химия – несомненно, сложная для понимания наука, но иногда полезно в ней разобраться. Проще всего это сделать через интересные статьи, простой слог и понятные примеры. Не лишним будет прочитать пару книг по теме и освежить в памяти курс школьной программы по химии.
Здесь было разобрано большинство тем химии, связанных с преобразованиями алюминия и его оксидов, в том числе, как из оксида алюминия получить тетрагидроксоалюминат, и еще множество интересных фактов. Оказалось, что у алюминия есть много самых необычных сфер применения в производстве и в быту, да и история получения металла весьма незаурядна. Химические формулы соединений алюминия тоже заслуживают внимания и подробного разбора, что и было освящено в этой статье.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения
Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей.
Химические свойства
- Реакции с неметаллами
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется — вместо них образуются (в рамках ЕГЭ) средние соли — алюминаты (академически — сложные окиселы):
Реакция с водой
При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет.
Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития)
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
🎬 Видео
Получение Алюмината Натрия - NaAlO2.Реакция Расплава Гидроксида Натрия и Алюминия. Реакция Al и NaOHСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Алюминий из глины в домашних условиях. Реально ли?Скачать

Проклятая химическая реакция 😜 #shortsСкачать