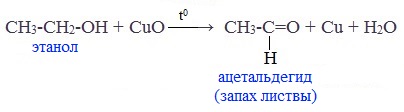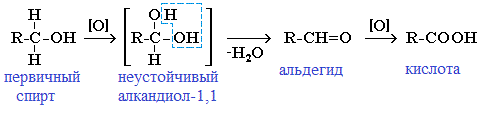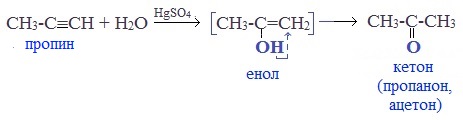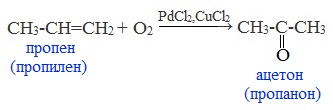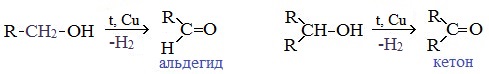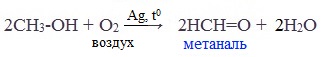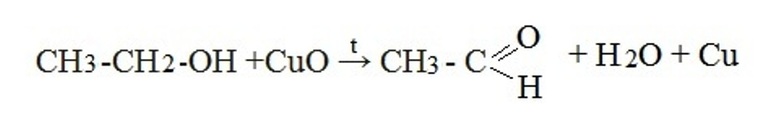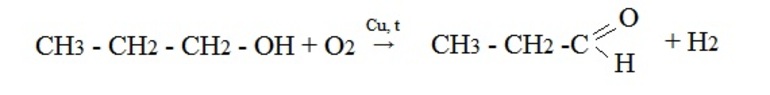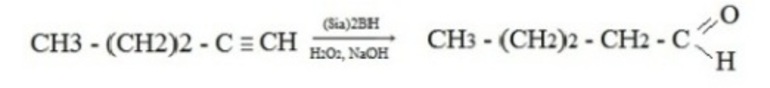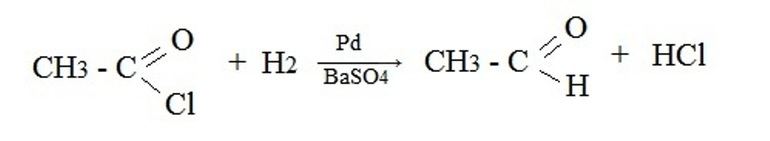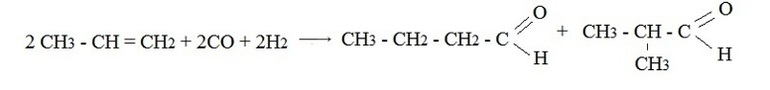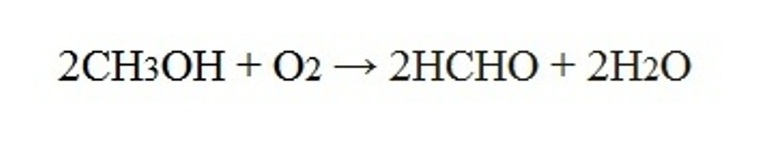1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
При окислении первичных спиртов образуются альдегиды:
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
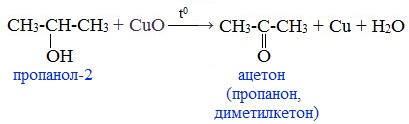
При окислении вторичных спиртов образуются кетоны:
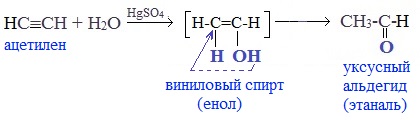
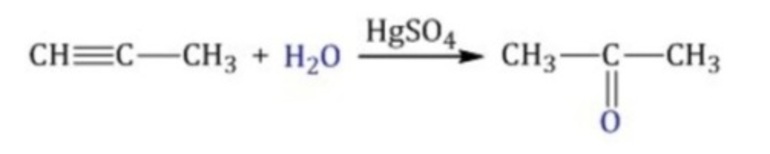
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
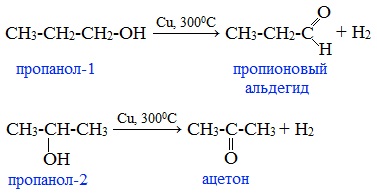
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. al conol dehyd rogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
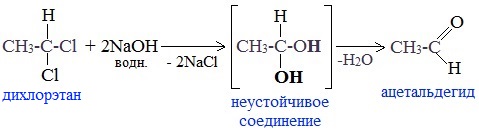
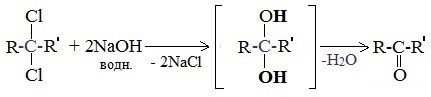
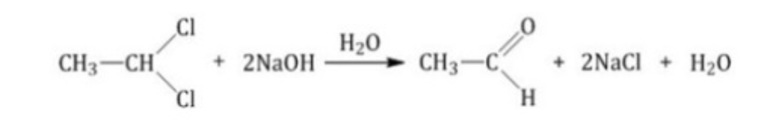
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Это лабораторный способ получения карбонильных соединений.
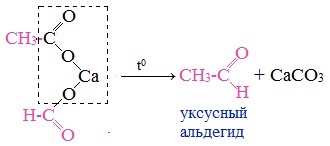
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
Это лабораторный способ получения карбонильных соединений.
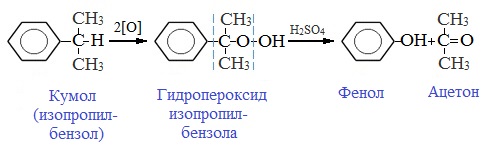
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
- Получение формальдегида
- 1с Напишите уравнения двух реакций получения уксусного альдегида: из этилового спирта и из ацетилена.
- Получение альдегидов — уравнения химических реакций
- Получение альдегидов в лаборатории
- Окислительные методы
- Восстановительные методы
- Ароматические альдегиды
- Промышленные способы
- 📸 Видео
Получение формальдегида
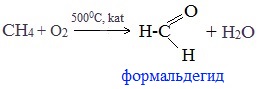
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Видео:Получение альдегидов и кетонов. 11 класс.Скачать

1с Напишите уравнения двух реакций получения уксусного альдегида: из этилового спирта и из ацетилена.

задача №1
к главе «Глава 5. Органические вещества. § 37(c). Альдегиды».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химииСкачать

Получение альдегидов — уравнения химических реакций
Видео:Опыты по химии. Окисление спирта в альдегидСкачать

Получение альдегидов в лаборатории
Все свойства химических веществ зависят от электронного строения их молекул. В карбонильной группе атом кислорода, как более электроотрицательный по сравнению с атомом углерода, перетягивает на себя электронную плотность двойной связи. Это ведет к поляризации связи и появлению частичных зарядов — положительного заряда у углерода и отрицательного у кислорода.
В карбоксильной группе степень окисления углерода равна +1, это промежуточный заряд, который можно достигнуть с помощью окисления или восстановления различных углеродсодержащих веществ. Ряд кислородсодержащих органических соединений с повышением степени окисления углерода, связанного с функциональной группой, выглядит следующим образом:
Спирты → Альдегиды → Карбоновые кислоты.
Таким образом, все лабораторные методы получения карбонильных соединений можно условно разделить на 3 группы:
- Окислительные методы.
- Восстановительные методы.
- Получение ароматических альдегидов.
Синтез ароматических соединений вынесен отдельно только для тех химических взаимодействий, в которых принимает участие бензольное кольцо.
Окислительные методы
В качестве исходных веществ в реакциях окисления используют первичные спирты, дигалогенпроизводные алканов и алкины. При окислении вторичных спиртов получаются кетоны, таким образом, получение альдегидов и кетонов имеет схожий механизм.
Рассмотрим примеры химических уравнений.
- Окисление первичных спиртов оксидом меди или реакция дегидратации (отщепление воды):
- Окисление спиртов кислородом на медной сетке или дегидрирование (отщепление водорода):
- Реакция Кучерова, или окисление алкинов путем присоединения воды в присутствии солей ртути. При гидратации ацетилена образуется ацетальдегид, при гидратации других алкинов в этих условиях образуются кетоны:
- Гидроборирование алкинов в присутствии щелочного раствора перекиси водорода, в этом случае присоединение происходит против правила Марковникова:
- Гидролиз дигалогеналканов в присутствии раствора щелочи:
В результате обратной реакции восстановления карбонильных соединений получаются исходные вещества, которые были взяты для их получения.
Например, в результате гидрирования (присоединения водорода) ацетальдегида образуется этиловый спирт.
Восстановительные методы
В качестве исходных реагентов используют производные карбоновых кислот: хлорангидриды, сложные эфиры, амиды и т.п. Например, восстановление водородом хлорангидрида уксусной кислоты на палладиевом катализаторе:
Ароматические альдегиды
Ароматические альдегиды можно получить в лаборатории теми же способами, что и альдегиды жирного ряда. Это могут быть реакции дегидратации и дегидрирования ароматических спиртов, гидролиз дигалогенпроизводных углеводородов ароматического ряда, восстановление производных карбоновых кислот. Уравнения этих взаимодействий будут аналогичны тем, которые были рассмотрены выше.
Специфической реакцией лабораторного синтеза ароматических альдегидов является введение в ароматическое ядро карбоксильной группы – формилирование. Исходные вещества – любой ароматический углеводород, угарный газ плюс хлористый водород, катализатор — смесь хлористого алюминия с монохлоридом меди.
Видео:10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

Промышленные способы
В настоящее время известен целый ряд электросинтезов альдегидов, которые перспективны в промышленном производстве лекарственных, парфюмерных, реактивных и других препаратов. Один из наиболее распространенных способов – оксосинтез. Этим способом можно получить карбонильные соединения, содержащие в своем составе три атома углерода и более. В основе реакции лежит гидроформилирование алкенов синтез-газом (смесь угарного газа с водородом).
Продуктами оксосинтеза является смесь альдегидов, соотношение которых можно изменять в результате подбора соответствующих катализаторов.
Дегидрирование первичных спиртов используется в промышленности только для получения уксусного альдегида. В качестве сырья выступает этиловый спирт, важным условием реакции является наличие катализатора (медь, активированная церием) и высоких температур в пределах 270-300˚С. За один цикл в реакцию вступает 25-50% этанола, выход продукта составляет 90-95%. В виде побочных продуктов реакции образуются этилен, этилацетат и высшие спирты.
При производстве формальдегида (метаналя) используется процесс окисления муравьиного спирта при температуре 400-450˚С, одно из условий – избыток кислорода. В качестве катализатора выступают оксиды железа и молибдена.
Получение ацетальдегида в результате гидратации ацетилена потеряло свое промышленное значение. Причиной является высокая токсичность катализатора реакции – ртути сернокислой. Ацетальдегид и акролеин в промышленности получают в результате окисления алкенов. Реакция проходит в присутствии смеси хлоридов палладия и меди. В качестве сырья для получения уксусного альдегида используют этилен, для получения акролеина – пропилен.
Основным сырьем для получения различных ароматических карбонильных соединений является бензальдегид. Промышленное получение бензальдегида основывается на реакции гидролиза бензальхлорида. В качестве гидролизующих агентов используют углекислые соли натрия или кальция, гидроксиды натрия или кальция, а также кислоты с добавлением соответствующих солей металлов.
Использование тех или иных методов получения альдегидов обусловлено процентом выхода продукта химической реакции, доступностью исходного сырья и возможностью соблюдения условий синтеза.
📸 Видео
Получение и применение альдегидов | Химия 10 класс #29 | ИнфоурокСкачать

Получение альдегидов и кетоновСкачать

Получение уксусного альдегидаСкачать

Окисление этанола оксидом меди (II). Опыт 3Скачать

Качественная реакция на альдегиды с гидроксидом медиСкачать

ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Химические свойства альдегидов и кетонов. 11 класс.Скачать

А32 ДРТ 19-20. Получение альдегидов. Тесты по химииСкачать

Получение альдегида окислением спиртаСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Окисление этилового спирта оксидом меди(II)Скачать

Химия 10 класс (Урок№8 - Альдегиды и кетоны.)Скачать

Тесты по химии. Получение альдегидов. А34 ЦТ 2016Скачать

70. Получение альдегидовСкачать

Химия. 11 класс. Свойства и применение альдегидов и кетонов /15.01.2021/Скачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать