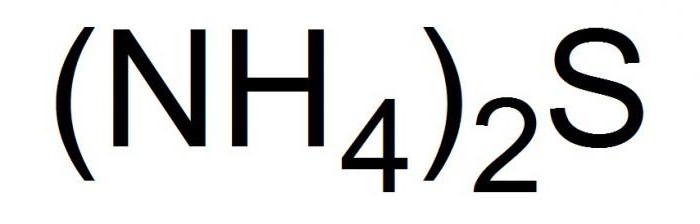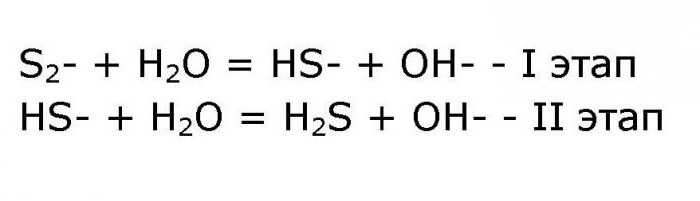Вопрос по химии:
Составьте молекулярное полное и сокращенное ионное уравнение реакции гидролиза(NH4)2S
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Сульфид аммония — соль, образованная двумя слабыми электролитами — гидроксидом аммония NH4OHи сероводородом H2S, поэтому гидролиз одновременно протекает и по катиону, и по аниону:
Уравнение диссоциации соли:
(NH4)2S = 2NH(4+) + S(2-)
Уравнения гидролиза:
Гидролиз по катиону (ионное уравнение)
NH(4+) + H2O = NH3*H2O + (H+)
Гидролиз по аниону (ионное уравнение)
S(2-) + H2O = HS(-) + OH(-) — I ступень
HS(-) + H2O = H2S + OH(-) — II ступень.
Без нагревания гидролиз идет, в основном, по I ступени.
Суммарное ионное уравнение гидролиза:
NH4(+) +S(2-) + 2H2O = NH3*H2O + HS(-) + H(+) + OH(-)
Молекулярное уравнение:
(NH4)2S + 2H2O = NH3*H2O + NH4HS + H2O
или (NH4)2S + H2O = NH3*H2O + NH4HS (образуется гидросульфид аммония)
При нагревании гидролиз сульфида аммония идет до конца (т. е. необратим) , так как в результате испарения воды образуются 2 вещества, уходящих из сферы реакции, — газообразные аммиак и сероводород.
Суммарные уравнения (ионное и молекулярное) выглядят так:
2NH4(+) +S(2-) + 4H2O = 2NH3*H2O + H2S +2H2O
(NH4)2S + 2H2O = 2NH3*H2O + H2S = 2NH3 + H2S + 2H2O
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Сульфид аммония: получение, гидролиз, применение
Азот — один из важнейших элементов органической химии. В виде сложных соединений элемент N является важной частью белков, из которых состоят все живые организмы на нашей планете. Этот достаточно активный химический элемент образует множество соединений, одним из которых является соединение аммония.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Что это такое
В молекуле аммиака азот охватывает своими ковалентными связями три атома водорода, причем последняя электронная связь остается свободной. Таким образом, аммоний может выступать донором различных химических реакций, образовывая четвертую – незатраченную ковалентную связь с другими веществами и соединениями. Если такое соединение происходит с атомом водорода, образуется молекула NH4. Полученный элемент может реагировать с различными кислотами, которые находятся в растворенном или концентрированном виде. При взаимодействии аммиак их нейтрализует. В итоге реакции получаются соли аммония — термически неустойчивые соединения. Если соль аммония нагревать, она быстро разлагается на составляющие вещества. При повышении температуры образуется аммиак с кислотой. Возможен и обратный процесс. Например, при взаимодействии с сероводородной кислотой можно получить сульфид аммония.
Видео:Гидролиз солей. 9 класс.Скачать

Формула
Это соединение записывается в химических уравнениях в видеследующей формулы.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Распространенные химические реакции
Гидролиз сульфида аммония отличается от других реакций подобных солей тем, что в ней принимают участие и катионы, и анионы одного и того же вещества. Процесс реакции зависит от температуры. Гидролиз сульфида аммония может быть записан следующим образом:
- ионное уравнение гидролиза по катиону:
NH4 + +H2O = NH3*H2O + H+; - уравнение гидролиза по аниону проходит в два этапа:
Итоговое ионное уравнение реакции выглядит следующим образом:
- NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-.
Стандартная запись этой химической реакции выглядит так:
Без нагревания реакция может быть обратима и происходит по первой ступени. Но если вещество подогреть, реакция станет необратимой – конечные вещества аммиак и сероводород просто покидают поле взаимодействия и улетучиваются.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Получение сульфида аммония
Сульфид аммония чаще всего получают при взаимодействии сероводорода с избытком аммиака:
Одной из наиболее характерных особенностей этого соединения является полное разложение соединения в воде. Цепь химической реакции выгладит следующим образом:
Сульфид аммиака в воде распадается на аммиак и сероводород.
Дальнейшее разложение сопровождается выделением водорода и появлением растворенного в воде аммиака и слабого аниона HS — . Поэтому в таблицах, поясняющих раствормость химических элементов, сульфид аммония помечен пропуском.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Практическое применение
В промышленности практическое применение разработано для паров сульфида аммония. Жидкая форма этого соединения используется при транспортировке. Хранят его в закрытых, химически инертных емкостях.
Это вещество хорошо знакомо фотографам и текстильщикам. В фотографии это соединение используется для обработки пленки. При взаимодействии с сильными основаниями происходит химическая реакция, сопровождающаяся выделением вредных веществ. В текстильной промышленности сульфид аммония используется как компонент отбеливающих смесей. Металлурги и реставраторы успешно пользуются им для превращения патины в бронзу. Сульфид аммония непременно используется при производстве мочевины, как важного удобрения, а также при производстве соды.
Возможно, применение этого вещества в хозяйственной деятельности было бы более распространенным. Но из-за чрезвычайной летучести этого соединения оно довольно быстро вступает в химическую реакцию с водяным паром, содержащимся в воздухе. Конечным продуктом этого взаимодействия является сероводород, который славится своим резким и очень неприятным запахом. Именно эта особенность сульфида аммония стала причиной его использования в производстве продукции для розыгрышей, включая «вонючие бомбы» и прочее.
Видео:Химия. Молекулярные и ионные уравненияСкачать

Общая химия
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Гидролиз солей
В общем случае гидролиз – это реакция обменного разложения вещества водой. Гидролизу подвержены соединения различных классов.
Гидролиз солей – процесс взаимодействия ионов, образовавшихся при диссоциации соли, с молекулами воды, сопровождающийся образованием слабых электролитов и изменением рН среды.
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются
Растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию. Например при растворении в воде цианида калия он полностью диссоциирует (все соли сильные электролиты):
Образующиеся в результате диссоциации ионы калия соответствуют сильному электролиту КОН, а цианид-ионы — слабой циановодородной кислоте HCN. Ионы водорода, образовавшиеся в результате диссоциации молекул воды, связываются цианид-ионами в молекулы HCN, в результате в растворе накапливаются ионы гидроксила:
Обычно эти два процесса при записи объединяют, получая сокращенное ионное уравнение гидролиза:
рН этого раствора больше 7. Такой гидролиз называется гидролизом по аниону. Для него можно записать полное ионное:
K + + CN — + H2O =K + + HCN + OH —
и молекулярное уравнение:
Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию. Аналогично предыдущему примеру гидролиз хлорида аммония NH4Cl:
Диссоциация при растворении соли:
Слабому основанию — аммиаку — соответствует ион аммония NH4 + , он и будет взаимодействовать с молекулами воды образуя слабый электролит:
В растворе накапливаются ионы водорода, среда кислая, рН раствора меньше 7. Такой гидролиз называется гидролизом по катиону. Полное ионное уравнение:
Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. В этом случае происходит гидролиз по катиону и аниону. Пример — гидролиз сульфида аммония. Соль при растворении в воде диссоциирует:
Оба иона, образовавшиеся при диссоциации, соответствуют слабым элетролитам, поэтому протекает гидролиз по катиону:
Ионы водорода и гидроксила дают молекулы воды — среда не может быть одновременно кислотй и щелочной:
однако среда не будет нейтральной. Реакция среды будет определяться соотношением констант диссоциации кислоты и основания. Если больше константа диссоциации основания (основание сильнее кислоты), среда будет щелочной, если больше константа диссоциации кислоты (кислота сильнее основаниия) — кислой. В приведенном примере аммиак — более сильный электролит по сравнению с сероводородной кислотой, поэтому среда будет слабощелочной, рН > 7.
В редких случаях, когда константы диссоциации кислоты и основания практически одинаковы, например, при гидролизе ацетата аммония CH3COONH4, среда будет почти нейтральная.
Если соль образована многокислотным основанием или многоосновной кислотой, гидролиз протекает ступенчато. Пример — гидролиз хлорида железа(III). Диссоциация соли при растворении:
Ион Fe 3+ соответствует слабому трехкислотному основанию Fe(OH)3, он и подвергается ступенчатому гидролизу. I-я ступень:
Гидролиз по первой ступени всегда протекает в значительно большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в рассмотренном примере — ионы H + ), способствуют смещению равновесия второйступени влево, т. е. также подавляют гидролиз по второй ступени. Поэтому в обычных условиях (комнатная температура, атмосферное давление) гидролизом по второй и последующим ступеням можно пренебречь.
Следующий пример — гидролиз карбоната натрия Na3CO3. Диссоциация:
Ион соответствует слабой двухосновной угольной кислоте, именно он и подвергается гидролизу. I-я ступень:
И опять в обычных условиях существенна только первая ступень гидролиза.
🌟 Видео
Электролиз. 10 класс.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Получение и гидролиз сульфида алюминия / Synthesis and hydrolysis of aluminium sulfideСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

(NH4)2SO3 + Cl2 + H2O Сульфит аммония Хлорная вода ОВР Химия 9 класс ФИПИ Подготовка к ЕГЭ и ОГЭСкачать

Гидролиз сульфата алюминия | ЕГЭ по химииСкачать

Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

ХимияСкачать

Гидролиз солей.ПримерыСкачать

Гидролиз солейСкачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Степень гидролиза и как её рассчитатьСкачать