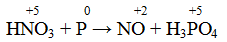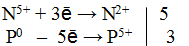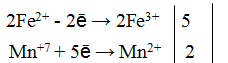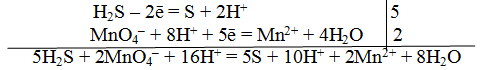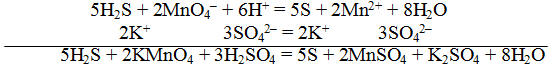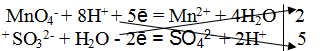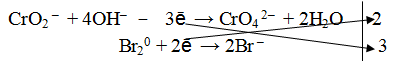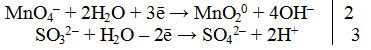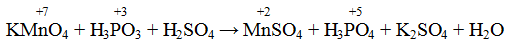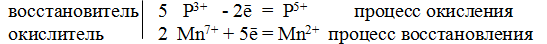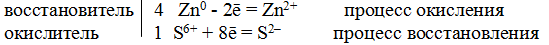Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
- Метод электронного баланса
- Ионно-электронный метод (метод полуреакций)
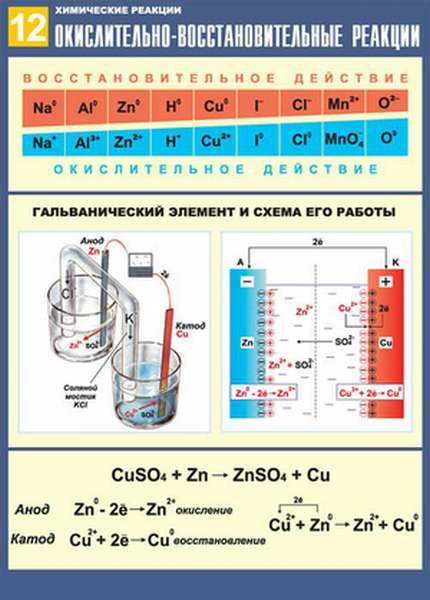
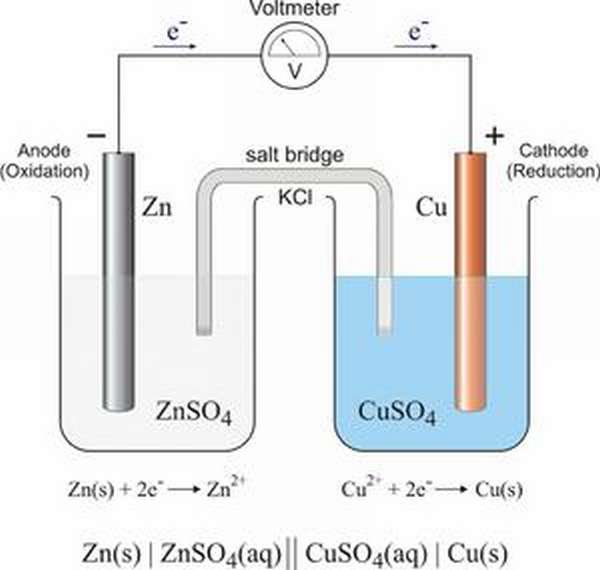
- Окислительно-восстановительные реакции
- Окислители и восстановители: характеристика
- Вещества с двойственной природой
- Классификация ОВР: примеры
- Токовые и бестоковые ОВР
- Метод электронного баланса ОВР в химии
- Примеры заданий на составление электронного баланса
- Влияние реакционной среды
- Составление уравнений окислительно-восстановительных реакций
- 🎥 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Окислительно-восстановительные реакции

Процессы, протекающие в природе и осуществляемые человеком, в большинстве своём представляют ОВР. Такие важнейшие процессы, как дыхание, обмен веществ, фотосинтез (6CO2+H2O = C6H12O6 + 6O2), — всё это ОВР.
В промышленности с помощью ОВР получают аммиак, серную, соляную кислоты и многое другое.
Восстановление металлов из руд — фактически основа всей металлургической промышленности — тоже окислительно-восстановительные процессы. Например, реакция получения железа из гематита: 2Fe2O3 + 3С = 4Fe+3CO2.
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Окислители и восстановители: характеристика

Говорят, что окислители, принимая электроны, восстанавливаются, а восстановители — окисляются в процессе отдачи электронов.
Важнейшие представители окислителей и восстановителей представлены в следующей таблице:
| Типичные окислители | Типичные восстановители |
| Простые вещества, состоящие из элементов с высокой электроотрицательностью (неметаллы): йод, фтор, хлор, бром, кислород, озон, сера и т. п. | Простые вещества, состоящие из атомов элементов с низкой электроотрицательностью (металлы или неметаллы): водород H2, углерод C (графит), цинк Zn, алюминий Al, кальций Ca, барий Ba, железо Fe, хром Cr и так далее. |
Молекулы или ионы, содержащие в составе атомы металлов или неметаллов с высокими степенями окисления:
| Молекулы или ионы, имеющие в своём составе атомы металлов или неметаллов с низкими степенями окисления:
|
| Ионные соединения, содержащие катионы некоторых металлов с высокими СО: Pb3+, Au3+, Ag+, Fe3+ и другие. | Органические соединения: спирты, кислоты, альдегиды, сахара. |

Как определить, является атом окислителем или восстановителем: достаточно записать СО и понять, какие атомы её увеличили впроцессе реакции (восстановители), а какие уменьшили (окислители).
Вещества с двойственной природой
Примером может быть пероксид водорода. Содержащийся в его составе кислород в СО -1 может как принять электрон, так и отдать его.
При взаимодействии с восстановителем пероксид проявляет окислительные свойства, а с окислителем — восстановительные.
Рассмотреть подробнее можно при помощи следующих примеров:
- восстановление (пероксид выступает как окислитель) при взаимодействии с восстановителем,
SO2 + H2O2 = H2SO4
- окисление (пероксид является в этом случае восстановителем) при взаимодействии с окислителем.
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5О2 + K2SO4 + 8H2O
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Классификация ОВР: примеры
Различают следующие типы окислительно-восстановительных реакций:
- межмолекулярное окисление-восстановление (окислитель и восстановитель находятся в составе разных молекул),
- внутримолекулярное окисление-восстановление (окислитель находится в составе той же молекулы, что и восстановитель),
- диспропорционирование (окислителем и восстановителем является атом одного и того же элемента),
- репропорционирование (окислитель и восстановитель образуют в результате реакции один продукт).
Примеры химических превращений, относящихся к различным типам ОВР:
- Внутримолекулярные ОВР — это чаще всего реакции термического разложения вещества:
2KCLO3 = 2KCl + 3O2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
2NaNO3 = 2NaNO2 + O2
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2Al + Fe2O3 = Al2O3 + 2Fe
3Br2 + 6KOH = 5KBr + KBrO3 + 6H2O
3HNO2 = HNO3 + 2NO + H2O
2NO2 + H2O = HNO3 + HNO2
4KClO3 = KCl + 3KClO4
2H2S + SO2 = 3S + 2H2O
HOCl + HCl = H2O + Cl2
Токовые и бестоковые ОВР

Первый случай — это получение электрической энергии за счёт химической реакции (такие источники энергии могут использоваться в двигателях машин, в радиотехнических устройствах, приборах управления), либо электролиз, то есть химическая реакция, наоборот, возникает за счёт электроэнергии (с помощью электролиза можно получать различные вещества, обрабатывать поверхности металлов и изделий из них).
Примерами бестоковых ОВР можно назвать процессы горения, коррозии металлов, дыхания и фотосинтеза и т.д.
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Метод электронного баланса ОВР в химии
Основывается метод на том, что сумма принимаемых окислителем электронов и количество отдаваемых восстановителем приводится к равновесию.
Метод складывается из нескольких этапов:
- Записывается уравнение реакции.
- Определяются СО элементов.
- Определяются элементы, которые в результате реакции изменили свои степени окисления. Отдельно записываются полуреакции окисления и восстановления.
- Подбираются множители для уравнений полуреакций так, чтобы уравнять принятые в полуреакции восстановления и отданные в полуреакции окисления электроны.
- Подобранные коэффициенты проставляются в уравнение реакции.
- Подбираются остальные коэффициенты реакции.
На простом примере взаимодействия алюминия с кислородом удобно написать уравнивание поэтапно:
- Уравнение: Al + O2 = Al2О3
- СО у атомов в простых веществах алюминия и кислорода равны 0.
Al0 + O20 = Al+32O-23
- Подбираем коэффициенты, при умножении на которые сравняется количество принятых и количество отданных электронов будет одинаковым:
Al0 -3е = Al+3 коэффициент 4,
O20 +4e = 2O-2 коэффициент 3.
- Проставляем коэффициенты в схему реакции:
4Al + 3O2 = Al2O3
- Видно, что для уравнивания всей реакции достаточно поставить коэффициент перед продуктом реакции:
4Al + 3O2 = 2Al2O3
Примеры заданий на составление электронного баланса
Могут встречаться следующие задания на уравнивания ОВР:
- Взаимодействие перманганата калия с хлоридом калия в кислой среде с выделением газообразного хлора.
KCl + KMnO4 + H2SO4 = Cl2 + MnSO4 + K2SO4 + H2O
K+1Cl-1 + K+1Mn+7O4-2 + H2+1S+6O4-2 = Cl20 + Mn+2S+6O4-2 + K2+1S+6O4-2 + H2+1O-2
Как видно после расстановки СО, атомы хлора отдают электроны, повышая свою СО до 0, а атомы марганца электроны принимают:
Mn+7 +5е = Mn+2 множитель два,
2Cl-1 -2е = Cl20 множитель пять.
Проставляем в уравнение коэффициенты в соответствии с подобранными множителями:
10K+1Cl-1 + 2K+1Mn+7O4-2 +H2SO4 = 5Cl20 + 2Mn+2S+6O4-2 + K2SO4 + H2O
Уравниваем количество остальных элементов:
10KCl + 2KMnO4 + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
- Взаимодействие меди (Cu) с концентрированной азотной кислотой(HNO3) с выделением газообразного оксида азота (NO2):
Cu + HNO3(конц.) = NO2 + Cu(NO3)2 + 2H2O
Cu0 + H+1N+5O3-2 = N+4O2 + Cu+2(N+5O3-2)2 + H2+1O-2
Как видно, атомы меди повышают свою СО с нуля до двух, а атомы азота — снижают с +5 до +4
Cu0 -2е = Cu+2 множитель один,
N+5 +1е = N+4 множитель два.
Проставляем в уравнение коэффициенты:
Cu0 + 4H+1N+5O3-2 = 2N+4O2 + Cu+2(N+5O3-2)2 + H2+1O-2
Уравниваем остальные элементы:
Cu + 4HNO3(конц.) = 2NO2 + Cu (NO3)2 + 2H2O
- Взаимодействие дихромата калия с Н2S в кислой среде:
Запишем схему реакции, расставим СО:
К2+1Сr2+6О7-2 + Н2+1S-2 + Н2+1S+6O4-2 = S0 + Сr2+3(S+6O4-2)3 + K2+1S+6O4-2 + H2O
S-2 –2e = S0 коэффициент 3,
2Cr+6 +6e = 2Cr+3 коэффициент 1.
К2Сr2О7 + 3Н2S + Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + Н2О
Уравниваем остальные элементы:
К2Сr2О7 + 3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + 7Н2О
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Влияние реакционной среды
Характер среды влияет на протекание тех или иных ОВР. Роль реакционной среды можно проследить на примере взаимодействия перманганата калия (KMnO4) и сульфита натрия (Na2SO3) при различных значениях рН:
- Na2SO3 + KMnO4 = Na2SO4 + MnSO4 + K2SO4 (pH <,7 кислая среда),
- Na2SO3 + KMnO4 = Na2SO4 + MnO2 + KOH (pH =7 нейтральная среда),
- Na2SO3 + KMnO4 = Na2SO4 + K2MnO4 + H2O (pH >,7 щелочная среда).
Видно, что изменение кислотности среды приводит к образованию разных продуктов взаимодействия одних и тех же веществ. При изменении кислотности среды они происходят и для других реагентов, вступающих в ОВР. Аналогично показанным выше примерам реакции с участием дихромат-иона Cr2O72- будут проходить с образованием разных продуктов реакции в различных средах:
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Составление уравнений окислительно-восстановительных реакций
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Составление уравнений окислительно-восстановительных реакций.
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает характер химической связи в молекуле и наличие тех ионов, которые в действительности существуют в растворе, например, MnO4 – , SO4 2- , Cr2O7 2- . При реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, поэтому число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. При составлении уравнений окислительно-восстановительных реакций для того, чтобы правильно написать продукты реакции, необходимо знать свойства реагирующих веществ.
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
Следовательно, молекулярное уравнение реакции имеет следующий вид:
2) Определить величину и знак степени окисления элементов до реакции и после реакции.
3) Составить электронный баланс
4) Подставить найденные коэффициенты в уравнение реакции.
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
Составляем уравнения электронного баланса
Подставляем найденные коэффициенты в уравнение реакции. Подсчитываем количество групп в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие -группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства.
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
8.3.2. Ионно-электронный метод.
При составлении электронно-ионных уравнений следует исходить не из изменения степени окисления элементов в реагирующих веществах, а нужно учитывать действительно существующие ионы в водном растворе с точки зрения теории электролитической диссоциации. Например, если реакция происходит с участием перманганата калия, то в реакции окислителем будут ионы MnO4 – , а не ионы Mn 7+ , так как перманганат калия в водном растворе диссоциирует KMnO4↔K + +MnO4 – . При этом вещества неионного характера и недиссоциирующие изображаются в электронных уравнениях в виде молекул: NH3, CO, NO2, SiO2, P.
В окислительно-восстановительных реакциях могут получаться различные продукты реакции в зависимости от характера среды – кислой, щелочной, нейтральной. Для таких реакций в молекулярной схеме необходимо указывать окислитель, восстановитель и вещество, характеризующее реакцию среды (кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо руководствоваться правилами стяжения, указывать ионы, характеризующие реакцию среды: H + , OH – , H2O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O +2 образует с ионами H + молекулы воды:
2. В нейтральной или щелочной среде избыток ионов O 2- образует с молекулами воды гидроксид – ионы:
3. В щелочной среде недостаток ионов O 2– компенсируется двумя ионами OH – , одновременно образуется одна молекула воды:
| Реакция среды | Избыток ионов О 2– | Недостаток ионов О 2– |
| окислитель | восстановитель | |
| Кислая | Н + Н2О | Н2O 2Н + |
| изб. O 2– + 2H + = Н2О | Н2О 2Н + + O 2– | |
| Нейтральная | H2O OH – | Н2O 2Н + |
| изб. О 2– + Н2О 2OН – | Н2О 2Н + + О 2– | |
| Щелочная | Н2O ОН – | 2OН – Н2О |
| изб. О 2– + Н2O 2OН – | 2OН – Н2О + О 2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО – 4 (он имеет малиновую окраску) в ион Mn 2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO – 4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO – 4 + 8H + +5e – = Mn 2+ +4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO – 4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:
Сократив на 10 Н + , окончательно получим
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая
1. Составить схему реакции
Из опытных данных знаем, что окислителем является КМnO4. Ион MnO4 – восстанавливается в кислой среде до Мn 2+ (фиолетово-малиновая окраска иона MnO4 – становится бесцветной, переходя в Мn 2+ – ион), следовательно, ион SO3 2 – будет являться восстановителем, переходя в ион SO4 2- .
2. Составить электронно-ионные уравнения
а) для окислителя
Из ионной схемы видно, что, ион MnO4 – – превращается в ион Мn 2+ , при этом освобождаются ионы О 2- , которые по правилу стяжения в кислой среде связываются ионами Н + , образуя молекулы Н2O.
б) для восстановителя
Из ионной схемы видно, что ион SO3 2- превращается в ион SO4 2- . Для этого превращения необходимо добавить ион О 2- , который берется из молекулы H2O (реакция протекает в водной среде), при этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4 – + 8H + + 5ē = Mn 2+ + 4H2O
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
6. Сократить в левой и правой части уравнения 10 Н + и 5Н2O. Получается ионное уравнение:
7. По ионному уравнению составить молекулярное уравнение реакции:
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
Окислителем в данной реакции является молекула брома, следовательно, восстановителем будет являться метахромит калия, а именно ион СrO2 – .
2. Составить электронно-ионное уравнение
а) для окислителя
б) для восстановителя
Из ионной схемы видно, что ион CrO2 – превращается в ион СгО4 2– . Каждый недостающий ион О 2– берется по правилу стяжения из двух гидроксильных ионов (среда щелочная ОН – ), при этом одновременно образуется одна молекула воды.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
Окислителем является КМnO4, так как ион элемента в своей высшей степени окисления не способен более отдавать электроны (Мn +7 ). Восстановителем является сульфит калия K2SO3.
2. Составить электронно-ионное уравнение
а) для окислителя
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
Из ионной схемы видно, что ион SО3 2- превращается в ион SO4 2- , для этого необходимо добавить один ион О 2- , который берется из молекулы Н2O (реакция протекает в водной среде). При этом освобождаются два иона Н + .
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S), соответственно, равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn), соответственно, равна: + 4 (промежуточная), +7 (высшая). Отсюда: NН3, H2S — только восстановители; HNO3, H2SO4, КMnО4 — только окислители; НNО2, Н2SО3, MnO2 — окислители и восстановители.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
а) Степень окисления в Н2S n(S) = -2; в HI n(I) = -1. Так как и сера и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная).
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
в) в Н2SO3 n(s) = +4 (промежуточная); в НС1O4 n(Сl) = +7 (высшая). Взятые вещества могут взаимодействовать, Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
Составляем уравнение реакции:
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn 2+ .
🎥 Видео
Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать

Как расставлять коэффициенты в химических реакциях | ОВР | Метод электронного баланса, Химия ЕГЭ, ЦТСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Учимся составлять электронный баланс/овр/8классСкачать

ОВР (Часть 1) | Метод электронного баланса | Как расставить коэффициенты в уравнении реакцииСкачать

Решение ОВР методом полуреакцийСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Быстрый способ расстановки коэффициентов в уравнениях ОВР.Скачать