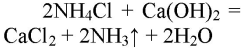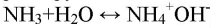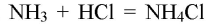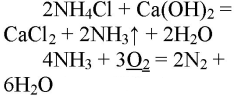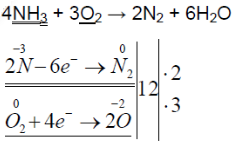Овчинникова Марина Альбертовна, учитель химии МАОУ «СОШ № 29», г. Ревда
Весной, когда всех школьников перевели на дистанционное обучение, передо мной встал вопрос : «Можно ли какие-нибудь лабораторные или практические работы провести в домашних условиях?»
Для этого как нельзя лучше подошла работа «Изучение свойств мыла». Обычно я провожу ее в 10 классе при изучении моющих средств, но, подумав и немного изменив текст работы, я предложила ее ребятам для домашнего эксперимента.
Оборудование: возьмите вместо пробирок небольшие прозрачные стаканчики.
Опыт 1: «Гидролиз мыла». Приготовьте индикатор из замороженных ягод, компота или варенья (черная смородина, черника, черноплодная рябина). Для этого разморозьте ягоды, разбавьте водой варенье или возьмите готовый компот. В стаканчик с раствором хозяйственного мыла добавьте несколько капель этого индикатора. Как поменялась окраска индикатора? Почему? Что произошло? Дайте объяснения наблюдаемому явлению. Напишите уравнение гидролиза стеарата натрия (найдите информацию).
Оказалось, что для приготовления индикатора лучше подходят замороженные ягоды чем варенье. Очень хорошо видно, как самодельный индикатор меняет окраску в растворе хозяйственного мыла. Гидролиз растворов солей ученики 10 класса еще не изучали, но в этом году, при изучении этой темы я напомнила детям, как идет гидролиз стеарата натрия и почему окраска индикатора изменилась с розовой на синюю.
Опыт 2. «Отношение мыла к кислотам». Налейте в стаканчик 2 мл водного раствора обыкновенного хозяйственного мыла. Прибавьте туда несколько капель раствора уксусной кислоты (6 или 9%) до образования хлопьев.
Какое вещество выпадает в виде хлопьевидного осадка? Объясните это явление. Осталась ли мыльная пена? Составьте уравнение реакции в молекулярном виде. Почему мыло теряет моющие свойства в кислой среде?
В пробирке наблюдается образование белого аморфного осадка.
Ученики делают вывод: Уксусная кислота сильнее стеариновой кислоты, т.к. вытесняет ее в осадок.
Опыт 3. «Получение нерастворимых солей». В стаканчик налейте 1 мл раствора мыла, затем раствор сульфата меди (II) (Если есть дома медный купорос). Объясните изменения. Почему выпал осадок? Составьте уравнение реакции в молекулярном и ионном виде.
Медный купорос оказался только у нескольких учеников, но те, кто проделал этот опыт, увидели, что выпадает голубой осадок (все соли меди голубого цвета), значит, идет реакция обмена с образованием нерастворимого стеарата меди.
Опыт 4. «Сравнение свойств мыла и синтетических моющих средств».
Жесткая вода содержит соли Са 2+ и Мg 2+ . Дома соль Са 2+ можно получить при действии уксусной кислоты на яичную скорлупу (CaCO3). Реакция идет не сразу, подождите минут 30 или даже больше.
В 2 стаканчика с растворами мыла и синтетического моющего средства добавьте по 1-2 мл жесткой воды (соль кальция). Что вы наблюдаете? Составьте уравнение взаимодействия CaCO3 с уксусной кислотой и хлорида кальция с мылом (стеарат натрия) в молекулярном и ионном виде. Какой раствор не утрачивает моющего действия в жёсткой воде? Почему?
Раствор СМС продолжает пениться, т.е. не теряет моющее действие.
Раствор мыла не пенится, т.е. теряет моющее действие.
Вывод: В жесткой воде хозяйственное мыло теряет моющее действие и образуется осадок, а СМС не теряет моющее действие.
Опыт 5: «Способность мыла эмульгировать жиры».
Поместите по 1 капле подсолнечного масла в 3 стаканчики с водой. Добавьте в одну из них раствор СМС, в другую — раствор мыла и энергично встряхните обе пробирки. Сравните с той пробиркой, где нет мыла и СМС. Что наблюдаете? Объясните происходящие явления. Почему раствор СМС и мыла способен уничтожать жир?
В 1-ой пробирке с мылом не осталось масла и образовалось мало пены. Во 2-ой пробирке с СМС не осталось масла и образовалось много пены. В 3-ей пробирке с обычной водой масло всплыло на поверхность.
Вывод: Моющий эффект СМС и хозяйственного мыла проявляется в эмульгировании масла с загрязненной и замасленной одежды, т.к. капля масла пропадает в растворе мыла и СМС, а в воде масло всплывает на поверхность.
Предложила оформить отчет о работе на двойном листочке по форме
- Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 25. Получение аммиака и изучение его свойств
- 1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
- 2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
- 3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
- Химия. 10 класс. О.С.Габриелян. Лабораторный опыт №11. Ответить на вопросы.
- 📹 Видео
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Что будет, если натрий бросить кусок натрия в воду?Скачать

§ 25. Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2.
Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке.
Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту.
При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта
Газ хорошо растворяется в воде и немного в с ней взаимодействует:
Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится:
Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды).
С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся
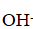
ионы).
Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой).
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ.
В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта:
При горящей лучинке аммиак горит жёлто-зелёным пламенем:
При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства.
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты.
Наблюдается появление белого дыма, характерного для соли аммония:
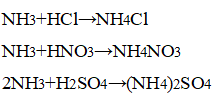
Конец газоотводной трубки можно только приближать к кислоте, а не погружать в неё, чтобы кислоту не засосало в смесь.
При взаимодействии аммиака с концентрированными кислотами образуются соли аммония.
Видео:Скоро Люди перестанут пить водуСкачать

Химия. 10 класс. О.С.Габриелян. Лабораторный опыт №11. Ответить на вопросы.
Приветик))) Помогите, пожалуйста, ответит н авопросы по опыту)))
1. К 1—2 мл растворов мыла и стирального порошка в отдельных пробирках добавьте по 2—3 капли раствора фенолфталеина. Отметьте окраску раствора. Сделайте вывод, какое из моющих средств лучше использовать для стирки тканей, чувствительных к щелочи (напри-
мер, шерстяных).
2. В две пробирки налейте по 3—4 мл жесткой воды (раствора солей кальция, например хлорида кальция СаСl2). В одну пробирку добавьте по каплям раствор мыла, а в другую — раствор стирального порошка. После внесения каждой капли содержимое пробирок взбалты-
вайте.
В каком случае приходится прибавлять больше рас твора для образования устойчивой пены? Какой препарат не утрачивает своей моющей способности в жесткой воде? Почему?
Приветик. Помощь уже здесь) И отвечать нужно вот так.
1. Приготовили растворы стирального порошка и мыла. В две пробирки налили по 1-2 мл этих растворов, в каждую пробирку добавили по 2-3 капли раствора фенолфталеина. Наблюдаем окрашивание растворов в обеих пробирках в малиновый цвет. Однако окраска раствора в пробирке с раствором стирального порошка имеет более интенсивный цвет, что свидетельствует о более щелочной реакции среды. Поэтому ткани, чувствительные к щелочи (например, шерсть), следует стирать в мыльном растворе.
2. В две пробирки налили по 3-4 мл жесткой воды (раствора хлорида кальция). В одну пробирку по каплям добавили раствор стирального порошка, полученную смесь взболтали. Наблюдаем образование устойчивой пены. Во вторую пробирку по каплям добавили раствор мыла, полученную смесь взболтали. Наблюдаем выпадение хлопьев осадка. Для получения устойчивой пены требуется добавление большего количества мыльного раствора. Раствор стирального порошка не утрачивает своей моющей способности даже в жесткой воде, т.к. в отличие от мыльного раствора не образует нерастворимых солей кальция.
📹 Видео
Опыт: раскаленное масло и водаСкачать

У Эмбер и Уэйда из Элементарно появились ДЕТИ! Огонь vs Вода: Родительские Лайфхаки!Скачать

СКОЛЬКО СОЛИ В МОРСКОЙ ВОДЕ? Скачать

Льем воду в кислоту. Шок контент. Химия – ПростоСкачать

Что произойдет, если пить морскую воду?Скачать

Химические свойства воды/часть 2/химия 8Скачать

ТИК ТОК ЗАСТАВИЛ МЕНЯ ПОВТОРИТЬ ЭТО … НЕНЬЮТОНОВСКАЯ ЖИДКОСТЬ #shortsСкачать

Вода, марганцовка, жидкое мыло, перекись водородаСкачать

Надеждин откажется от подписей из-за рубежа. Силовики давят на жен мобилизованных. Митинг в УфеСкачать

Опыт с уксусом и содойСкачать

Когда отец не знает, что такое тампон..😂 #тампоны #месячные #батяСкачать

Не спите в линзах))) ослепните😍🙂Скачать

ЧТО ПРОИЗОЙДЕТ, ЕСЛИ ВЫПИТЬ МНОГО МОРСКОЙ ВОДЫСкачать

🔥 САМЫЙ ЗАПРЕЩЕННЫЙ ЭКСПЕРИМЕНТ. Почему нельзя лить воду в кислоту?Скачать

Что, если бы вы не пользовались мылом в течение целого месяцаСкачать

Почему горящее масло не стоит тушить водой?Скачать

БАССЕЙН С СОЛЬЮ В КОТОРОМ НЕВОЗМОЖНО УТОНУТЬСкачать