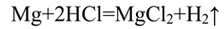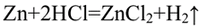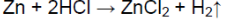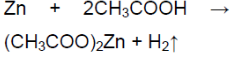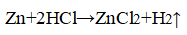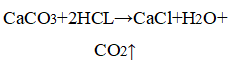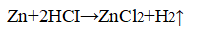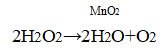- 1. В какую сторону сместится химическое равновесие в реакции, уравнение которой 2CO + O2 2CO2 + Q, в случае: А. Повышения температуры? Б. Повышения давления?
- Контрольная работа по химии (11 класс) Скорость химических реакций. Химическое равновесие
- Вопросы к параграфу 4 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 4. Практическая работа №1.
- Изучение влияния условий проведения химической реакции на её скорость
- 1. Влияние природы реагирующих веществ. 1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее? 2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
- 2. Влияние концентрации реагирующих веществ. В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30%-ной соляной кислоты, в другую — 1 мл 10%-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
- 3. Влияние поверхности соприкосновения реагентов. В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
- 4. Влияние температуры. В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
- 5. Влияние катализатора. В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку. не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца(IV) МnO2, и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет МnO2?
- 6. Отчет о работе составьте в произвольной форме и сделайте общий вывод.
- 🎦 Видео
Видео:Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

1. В какую сторону сместится химическое равновесие в реакции, уравнение которой 2CO + O2 2CO2 + Q, в случае: А. Повышения температуры? Б. Повышения давления?
В. Увеличения концентрации О2? Г. Применения катализатора? Дайте обоснованный ответ.
2. Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k . C2А.
3. Почему реакция между кислотой и гладкой гранулой цинка идёт медленнее, чем с той же кислотой и шероховатой гранулой
4. Составьте термохимическое уравнение реакции синтеза аммиака, если в реакцию вступило 44,8 л водорода и при этом выделилось 60 кДж теплоты.
Видео:Реакция цинка с соляной кислотой. Химический опытСкачать

Контрольная работа по химии (11 класс) Скорость химических реакций. Химическое равновесие
Контрольная работа по химии (11 класс)
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
(2 балла). Фактор, не влияющий на скорость химической реакции: А. Место проведения реакции. Б. Концентрации реагирующих веществ. В. Природа реагирующих веществ. Г. Температура. (2 балла). Фактор, влияющий на смещение химического равновесия: А Катализатор.. Б. Концентрация реагирующих веществ. В. Природа реагирующих веществ. Г. Тип кристаллической решётки реагирующих веществ. (2 балла). С увеличением концентрации кислорода в 2 раза скорость химической реакции, уравнение которой СН4 + 2O2 = СО2 + Н2О: А. Не изменится. Б. Увеличится в 2 раза. В. Увеличится в 4 раза. Г. Уменьшится в 4 раза. 





ЧАСТЬ Б. Задания со свободным ответом

В. Увеличения концентрации О2? Г. Применения катализатора? Дайте обоснованный ответ.
баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k. C 2А.
балла). Почему реакция между кислотой и гладкой гранулой цинка идёт медленнее, чем с той же кислотой и шероховатой гранулой
баллов). Составьте термохимическое уравнение реакции синтеза аммиака, если в реакцию вступило 44,8 л водорода и при этом выделилось 60 кДж теплоты.
Контрольная работа по химии (11 класс)
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
(2 балла). Фактор, не влияющий на скорость химической реакции: А. Давление. Б. Катализатор. В. Способ получения реагентов. Г. Температура. (2 балла). Фактор, не влияющий на смещение химического равновесия: А. Давление. Б. Концентрация реагирующих веществ. В. Температура. Г. Природа реагирующих веществ. (2 балла). С увеличением концентрации хлора в 2 раза скорость химической реакции, уравнение которой СО + Cl2 = CCl2O: А. Не изменится. Б. Увеличится в 2 раза. В. Увеличится в 4 раза. Г. Уменьшится в 4 раза. 



 |  |


 |  |


ЧАСТЬ Б. Задания со свободным ответом

баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k. C 2А CВ .
балла). Приведите примеры химических реакций, иллюстрирующих влияние катализатора на направление химического процесса: а) для неорганических веществ; б) для органических соединений. Запишите уравнения этих реакций.
баллов). Составьте термохимическое уравнение реакции разложения нитрата калия, если для образования 5,6 л кислорода потребовалось 63,7 кДж теплоты.
Контрольная работа по химии (11 класс)
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
(2 балла). Фактор, не влияющий на скорость химической реакции: А. Давление. Б. Катализатор. В. Концентрации реагирующих веществ. Г. Форма сосуда, в котором протекает реакция. (2 балла). Фактор, влияющий на смещение химического равновесия: А. Вид химической связи. Б. Катализатор. В. Природа реагирующих веществ. Г. Температура. 




 |  |


 |  |
 |
(2 балла). Скорость химической реакции, уравнение которой Mg + 2HCl = MgCl2 + H2 , при уменьшении концентрации кислоты за каждые 10 с на 0,04 моль / л равна: А. 0,00004моль/(л, с) Б. 0,0004 моль/(л, с) В. 0,004 моль/(л, с) Г. 0,04моль/(л, с) (8 баллов). Установите соответствие. Уравнение реакции: 1. С+О2=СО2 2. С+СО2=2СО. Формула для определения скорости реакции: А. v = k. Co2. Б. v = k. Cc. Cco2 . В. v = k. Co2. Cc . Г. v = k. Cco2.
ЧАСТЬ Б. Задания со свободным ответом

В. Увеличения концентрации С2Н4? Г. Применения катализатора? Дайте обоснованный ответ.
баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k. CА CВ.
балла). Почему, если смешать твёрдый нитрат свинца (II) и иодид калия, признаки реакции можно наблюдать через несколько часов, а если слить растворы этих солей, признаки реакции появятся сразу. Напишите уравнение реакции в молекулярном и ионном видах.
баллов). Составьте термохимическое уравнение реакции разложения карбоната кальция, если для разложения 25 г карбоната кальция потребовалось 44,5 кДж теплоты.
Контрольная работа по химии (11 класс)
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение.
(2 балла). Фактор, не влияющий на скорость химической реакции: А. Катализатор. Б. Концентрации реагирующих веществ. В. Природа реагирующих веществ. Г. Размер пробирки. (2 балла). Фактор, не влияющий на смещение химического равновесия: А. Давление. Б. Ингибитор. В. Концентрация реагирующих веществ. Г. Температура. 





 |  |


 |  |
 |
(2 балла). Скорость реакции, уравнение которой Zn + 2HCl = ZnCl2 + H2 , при уменьшении концентрации кислоты за каждые 30 с на 0,06 моль / л равна: А. 0,001моль/(л, с) Б. 0,002 моль/(л, с) В. 0,004 моль/(л, с) Г. 0,02моль/(л, с) (8 баллов). Установите соответствие. Уравнение реакции: 1. СaO + CО2 = CaСО3 2. H2 + Сl2 = 2HСl. Формула для определения скорости реакции: А. v = kcao. Cco2. Б. v = k. CH2. CCl2. В. v = k. Cco2 . Г. v = k. C2HCl.
ЧАСТЬ Б. Задания со свободным ответом

баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k. CА CВ.
балла). Почему в местах хранения порожних цистерн, в которых перевозили концентрированную серную кислоту, нельзя зажигать огонь, опасно даже пламя спички.
баллов). Составьте термохимическое уравнение реакции горения оксида углерода (II), если при сгорании 0,4 моль его выделилось 113,76 кДж теплоты.
Видео:Взаимодействие цинка с соляной кислотой I ЕГЭ по химииСкачать

Вопросы к параграфу 4 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Объемные отношения газов при химических реакциях. 8 класс.Скачать

§ 4. Практическая работа №1.
Изучение влияния условий проведения химической реакции на её скорость
1. Влияние природы реагирующих веществ. 1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее? 2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
Уравнение химической реакции
Интенсивное выделение газа
Скорость химической реакции между металлом и кислотой увеличивается, когда применяют более активный металл.
Образование пузырьков газа
Ничего не происходит
Уравнение химической реакции
Скорость химической реакции между цинком и кислотой увеличивается, когда применяют более сильную кислоту.
Образование пузырьков газа
2. Влияние концентрации реагирующих веществ. В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30%-ной соляной кислоты, в другую — 1 мл 10%-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
Уравнение химической реакции
Скорость реакции тем выше, чем выше концентрация кислоты.
Образование пузырьков газа
3. Влияние поверхности соприкосновения реагентов. В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Уравнение химической реакции
Образование пузырьков газа
Если вещество находится в измельчённом виде, газ выделяется интенсивнее, так как увеличивается площадь поверхности соприкосновения веществ.
4. Влияние температуры. В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
Уравнение химической реакции
При возрастании температуры среды (при нагревании пробирки с помощью горячей воды) реакция идёт интенсивнее.
Образование пузырьков газа
5. Влияние катализатора. В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку. не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца(IV) МnO2, и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет МnO2?
Уравнение химической реакции
Изменений не наблюдается
При помещении тлеющей лучинки в пробирку с перекисью водорода изменений не наблюдается, потому что кислорода слишком мало. В присутствии MnO2 в качестве катализатора, разложение перекиси водорода ускоряется, кислород выделяется быстрее, лучинка загорается.
Тлеющая лучинка вспыхивает
6. Отчет о работе составьте в произвольной форме и сделайте общий вывод.
На скорость взаимодействия веществ влияют такие факторы, как: природа химических веществ, их концентрация, площадь поверхности контакта, температура и наличие/отсутствие катализатора. Скорость химической реакции увеличивают такие факторы, как: высокая активность взаимодействующих веществ, их высокая концентрация, большая площадь соприкосновения, высокая температура и присутствие катализатора.
🎦 Видео
Химическая реакция цинка и медного купоросаСкачать

Получение осадка гидроксида цинка и растворение его в избытке щёлочиСкачать

25. Схема реакции и химическое уравнениеСкачать

Как понять что вещество выпадает в осадок или образуется газСкачать

Изжога, горечь, кислый вкус во рту. Как избавиться за 1 минутуСкачать

Пониженная кислотность. Как определить кислотность желудка домаСкачать

Что если в соляную кислоту добавить медьСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

цинк + соляная кислотаСкачать

ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

Решение задач на приготовление и смешивание растворов | ХимияСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Как очистить сосуды от холестериновых бляшек?Скачать

Взаимодействие уксусной кислоты с металламиСкачать

Реакции кислот-окислителей со сложными веществами: как понять? | Химия ЕГЭ 2022 | УмскулСкачать

Реакция нейтрализации по типу цветной пробыСкачать