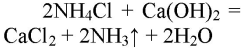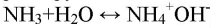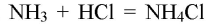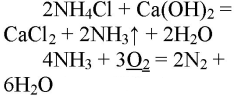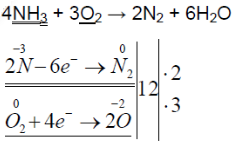16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться в Летнюю Школу’22! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Если вы хотите узнать, почему при добавлении соляной кислоты происходит растворение анилина, смотрите видеоопыт о том, как эти вещества могут взаимодействовать друг с другом.
Анилин (С6Н5NH2) – простейший ароматический амин, представляет собой бесцветную маслянистую жидкость, плохо растворимую в воде.
В видеоопыте продемонстрирована способность анилина вступать в химическую реакцию с соляной кислотой.
Готовится смесь (эмульсия) анилина с водой и добавляется соляная кислота. Мутная эмульсия становится прозрачной — наблюдается растворение анилина. Почему при добавлении соляной кислоты происходит растворение анилина?
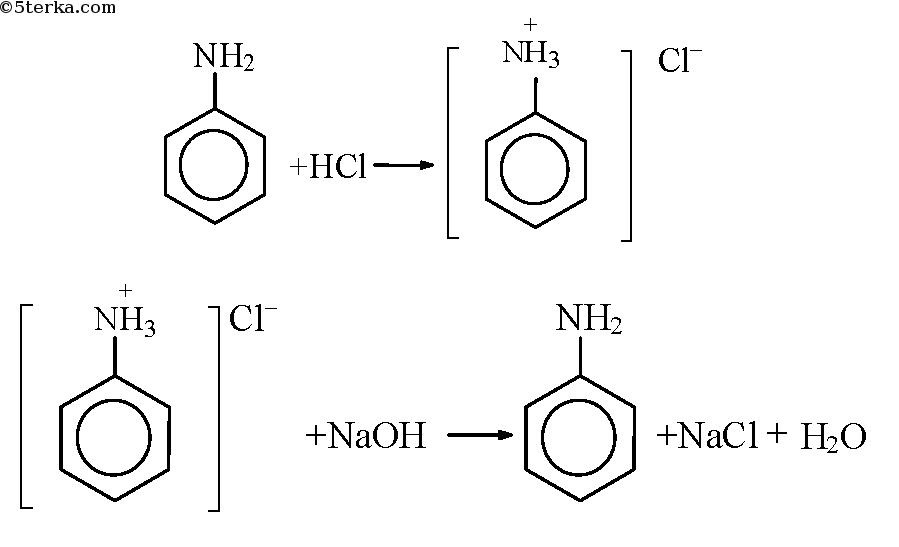
Анилин – слабое основание, так как в состав анилина входит группа ОН — . Гидроксильная группа может связываться с ионами Н + . Поэтому анилин может взаимодействовать с сильными кислотами с образованием солей. Также анилин вступает в реакции, как по аминогруппе, так и по ароматическому кольцу.
Анилин+соляная кислота= солянокислый анилин (хлорид фениламмония), который растворим в воде. Уравнение этой реакции выглядит так:
Реакция анилин+соляная кислота в результате дает растворение анилина. Поэтому мутная эмульсия воды и анилина превращается в прозрачный раствор воды с солянокислым анилином.
- Практическая работа № 7. Амины. Аминокислоты. Белки
- Опыт 1. Образование солей анилина
- Опыт 2. Бромирование анилина
- Опыт 4. Денатурация белка
- Опыт 6. Цветные реакции белков
- Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 25. Получение аммиака и изучение его свойств
- 1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
- 2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
- 3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
- 🎬 Видео
Видео:Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

Практическая работа № 7. Амины. Аминокислоты. Белки
Опыт 1. Образование солей анилина
В пробирку налили чуть-чуть анилина и добавили немного воды, смесь размешали. Наблюдаем образование эмульсии. Добавили по каплям соляную кислоту до полного растворения анилина в воде. К раствору добавили немного раствора щелочи. Наблюдаем разделение раствора на две фазы.
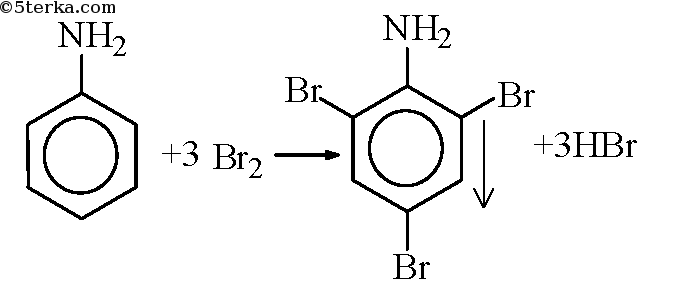
Опыт 2. Бромирование анилина
В пробирку налили чуть-чуть анилина и добавили воду. По каплям прибавляем бромную воду до выпадения белого осадка.
Опыт 3. Получение медной соли глицина
В пробирку налили 2 мл глицина и добавили немного порошка оксида меди (II). Пробирку нагрели. Наблюдаем голубое окрашивание раствора.
Опыт 4. Денатурация белка
Растворили белок куриного яйца в воде. В пробирку налили немного этого раствора и нагрели. Наблюдаем помутнение раствора — произошла денатурация. После охлаждения и разбавления раствор все равно остался мутным, т. к. денатурация — процесс необратимый.
Опыт 5. Осаждение белка солями тяжелых металлов
Опыт 6. Цветные реакции белков
а) Ксантопротеиновая реакция.
В пробирку налили немного раствора белка и прибавили несколько капель концентрированной азотной кислоты. Пробирку нагрели. Наблюдаем образование желтого осадка. Содержимое пробирки охладили и прилили раствор аммиака до щелочной реакции. Наблюдаем изменение цвета осадка на оранжевый.
б) Биуретовая реакция.
В пробирку налили немного раствора белка и добавили немного раствора гидроксида натрия и медного купороса. Наблюдаем окрашивание раствора в сине-фиолетовый цвет.

задача №7
к главе «Химический практикум».
Видео:12.4. Анилин: Строение, химические свойства, способы получения. ЕГЭ по химииСкачать

Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Реакция цинка с соляной кислотой. Химический опытСкачать

§ 25. Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2.
Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке.
Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту.
При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта
Газ хорошо растворяется в воде и немного в с ней взаимодействует:
Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится:
Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды).
С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся
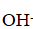
ионы).
Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой).
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ.
В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта:
При горящей лучинке аммиак горит жёлто-зелёным пламенем:
При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства.
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты.
Наблюдается появление белого дыма, характерного для соли аммония:
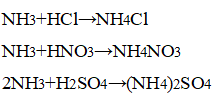
Конец газоотводной трубки можно только приближать к кислоте, а не погружать в неё, чтобы кислоту не засосало в смесь.
При взаимодействии аммиака с концентрированными кислотами образуются соли аммония.
🎬 Видео
Опыты по химии. Растворение цинка в кислотах и щелочахСкачать

12. В-О Получение анилинаСкачать

Реакция между соляной кислотой HCl и алюминиевой фольгой Al В результате реакция образуется хлоридСкачать

Взаимодействие цинка с соляной кислотой I ЕГЭ по химииСкачать

Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Получение гидроксида меди (II) и растворение его в кислотахСкачать

Свойства соляной кислоты. Интересные реакции с ней. [ChemistryToday]Скачать
![Свойства соляной кислоты. Интересные реакции с ней. [ChemistryToday]](https://i.ytimg.com/vi/L3SDNPZz62o/0.jpg)
Анилин. Его свойства и применение | Химия 10 класс #43 | ИнфоурокСкачать

10 класс - Химия - Азотосодержащие органические соединения. Амины. АнилинСкачать

Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать

Разбор Варианта №9 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать

Разбор открытого варианта КИМ ЕГЭ 2023 по химии | Екатерина СтрогановаСкачать

Все качественные реакции органических соединений за 45 минут | Химия 10 класс | УмскулСкачать

Получение соляной кислотыСкачать

Реакция оксида цинка с соляной кислотой. Химический опытСкачать

Химия - 8 класс - Соляная кислота и её солиСкачать

Амины. АнилинСкачать