Многие хозяйки наверняка замечали, что в жесткой воде моющие средства теряют свои типичные свойства – мыло становится неэффективным и как-то не хочет давать пену. Хорошо, если с этим явлением вы познакомились в качестве одноразового опыта, но ведь возможно и такое, что мылящие вещества не работают у вас дома, создавая огромные проблемы в процессе наведения порядка. Наша статья призвана не только помочь понять, почему так происходит, но и решить проблему.
- Особенности жесткой воды
- Почему средства утрачивают моющие свойства?
- Можно ли это исправить?
- Почему в жёсткой воде мыло не мылится?
- Что заставляет мыло пениться?
- Как жёсткая вода влияет на мыло?
- Жёсткая вода. Что делать?
- Домашняя практическая работа «Изучение свойств мыла»
- О мыле и о том, что происходит, когда оно встречается с водой
- Тест «Моющие средства»
- СПРАВОЧНЫЙ МАТЕРИАЛ К УРОКУ Структуры, названия и источники получения некоторых жирных кислот
- 🎬 Видео
Видео:Опыты по химии. Сравнение свойств мыла и синтетических моющих средств: мыло и СМС в жесткой водеСкачать

Особенности жесткой воды
На практике даже не каждый человек понимает, что такое жесткая вода, ведь жидкость довольно редко бывает настолько плотной, чтобы это можно было почувствовать голыми руками. Каждому из нас главная питьевая жидкость Вселенной кажется мягкой, но если вы неоднократно бывали в других регионах или просто пробовали много разной бутилированной воды, то, вероятно, замечали, что не вся вода одинаково мягкая.
Причина этого довольно проста: в водной среде, как известно, могут растворяться многочисленные разновидности солей – мы их не видим, но их твердые частицы в составе воды присутствуют. Хлориды и сульфаты кальция и магния, а также гидрокарбонаты в значительном количестве вполне ощущаются если не на ощупь рукой, то во рту – такая вода не обволакивает мягко, а течет как-то туго, кажется более густой (это правда) и шершавой.
Жесткость – это не просто абстрактный показатель, а весьма важная характеристика той влаги, которую будет использовать человек. Пейте такую воду постоянно, и в почках рано или поздно накопится достаточно материала для образования камней, пищеварительной системе станет сложнее переваривать съеденное, может ухудшиться состояние кожи. Сантехника тоже будет не в восторге – соляные отложения появятся на внутренних стенках труб, а также покроют нагревательные элементы чайника или стиральной машины, выведя оборудование из строя. Ткань в результате стирки жесткой водой потеряет первоначальную нежность, поскольку будет «поцарапана» невидимыми твердыми частицами, станет выглядеть менее красиво. Как вы уже поняли, мыло перестанет мылиться – это далеко не выдумка, а научно доказанный факт.
Понимая вред жесткой воды, человечество придумало шкалу, оценивающую этот показатель. Единица измерения называется градусом жесткости, и чем меньше таких градусов, тем мягче жидкость. Мягкой в России считается та вода, у которой нет и 2-х градусов, а жесткой – вода, чья жесткость превышает 10 градусов. В других странах эти нормативы могут отличаться, но в целом в водопровод принято подавать воду средней жесткости – так влага перестает быть слишком опасной и не требует больших усилий по очистке.
Другое дело, если грунтовую жидкость вы забираете сами – тогда в трубы она будет попадать в том виде, в каком была в природе.
Видео:ОШИБКИ ПРИ РАБОТЕ С МЫЛЬНОЙ ОСНОВОЙ ❗ НЕ ДЕЛАЙТЕ ТАК ❗Скачать

Почему средства утрачивают моющие свойства?
Образование пены в результате контакта мыла с водой – это химическая реакция. Брусок не просто «растворяется» – происходит распад калиевых и натриевых солей высших жирных кислот на натриевые ионы и анионы жирных кислот. Именно последние приводят к тому, что мыло пенится, а если образованную пену еще и потереть о загрязненную поверхность, то в результате взаимодействия большинство молекул условной «грязи» будут связаны с пеной и отмоются.
Если в школе вам была интересна химия, то вы наверняка понимаете, что изменение состава реагентов приводит к изменениям формулы получающихся веществ. Если вода используется без примесей или со сравнительно небольшим их количеством, то при стирке образуется то или иное количество пены, достаточное для эффективного удаления загрязнений. Но когда в дело активно вмешиваются посторонние соли, присутствующие в жидкости, любые действия стирающего средства оказываются бессмысленными – мыло плохо мылится и совершенно не стирает!
Логика происходящего предельно проста: полезные анионы жирных кислот, которые должны были захватывать загрязнения и удалять их с отмываемой поверхности, вместо этого связываются с магниевыми и кальциевыми катионами. Получившееся вещество оказывается весьма устойчивым и его довольно легко заметить невооруженным глазом – оно выглядит как характерные хлопья на поверхности воды, упорно не желающие в ней растворяться. В такой ситуации мыло не дает собственно мыльной пены, а только эти хлопья – соответственно, нечему захватывать жир, пыль, грязь и другие нежелательные вещества. Использование мыла становится непрактичным – оно тратится впустую, не принося никакой пользы.
Понятно, что это не работает по принципу выключателя – некоторая способность мыла пениться остается, просто интенсивность может падать или расти в зависимости от градуса жесткости задействованной влаги. Если вода достаточно жесткая, теоретически можно попытаться решить проблему вовлечением в процесс большего количества мыла, но это непрактично и во многих случаях просто не сработает – всю воду так не очистишь. Однако тем гражданам, кто должен использовать воду из скважины или источника, вне зависимости от своего отношения к уровню ее жесткости, приходится несладко, потому ученые придумали способы умягчения воды.
Собственно, именно благодаря умягчителям в водопроводе течет еще сравнительно нормальная жидкость.
Видео:Опыты по химии. Устранение жесткости воды с помощью ионообменниковСкачать

Можно ли это исправить?
Понятие того, насколько жесткая та или иная вода, весьма относительно – например, российский документ СанПиН называет жесткой влагу с градусом от 10, но на сегодняшний день в мире это уже считается чрезмерно завышенным показателем. Строго говоря, для питья такая влага все еще годится, но вот бытовая техника выйдет из строя из-за накипи довольно быстро. Если хотите сохранить оборудование работоспособным на протяжении длительного времени, лучше использовать воду не жестче 3-х градусов, а это означает, что «нормальная» водопроводная вода тоже не подходит никак.
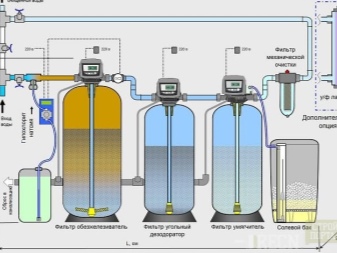
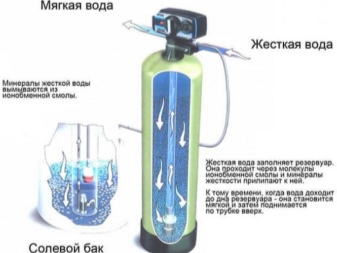
Наиболее простым способом регулировки жесткости в сторону смягчения можно считать установку специальных ионообменных фильтров. Очищающим средством в них служит особая смола в гранулах, которая тоже способна вступать в химическую реакцию с солями магния и кальция. Благодаря такому взаимодействию эти соли изымаются из проточной влаги, заменяясь ионами натрия – уже куда более нейтральными и не «цепляющимися» к мылу. Со временем такая смола, конечно же, теряет первоначальные свойства, поскольку натрий из нее понемногу вымывается, однако восстановить их не так уж сложно – для этого используют соляные таблетки. В некоторых домохозяйствах для таких целей до сих пор используют даже обыкновенную поваренную соль, но вот она показывает не слишком высокую эффективность – для таблеток ее целенаправленно очищают от любых посторонних примесей.
Следует учитывать, что ионообменный фильтр не следует путать с фильтром обыкновенным – тем, что выполняет механическую очистку. Магниевые и кальциевые соли в жидкости растворяются до такой степени, что отдельные частицы невозможно увидеть невооруженным глазом – естественно, никакая сетка не способна их задержать.
В последние годы на рынке появилась альтернатива ионообменным системам – фильтры, функционирующие по принципу обратного осмоса. У них для фильтрования жидкости используется уже не сетка, а специальная мембрана, она кажется целостной и неспособной пропускать что-либо, однако на самом деле она вся покрыта мельчайшими порами, через которые проходит вода.
Тонкость производства таких мембран заключается в том, что поры специально делают того диаметра, который практически идеально равен диаметру молекулы воды – она меньше него совсем чуть-чуть и проходит в отверстие с трудом. У магниевой или кальциевой соли молекулы крупнее, потому в существующие ячейки они просто не могут пройти. Что же касается волокон, из которых составлена фильтрующая мембрана, то они, с одной стороны, довольно прочны, чтобы не рваться даже при серьезном напоре, с другой, не имеют свойства растягиваться, потому ячейки имеют стабильные размеры и гарантированно не пропустят то, чего в воде быть не должно.
Конечно, система обратного осмоса тоже не является вечной, поскольку мембрана, как и любое другое изобретение человечества, имеет собственный срок службы. Со временем ее волокна все-таки рвутся или растягиваются, но процесс увеличения жесткости будет постепенным – мыло не перестанет пениться в один миг. В ситуации, когда владельцы жилья видят, что вода становится все более жесткой и начинает вызывать сомнения относительно своей мягкости, они просто меняют картриджи с мембранами – и влага снова становится приемлемой по качеству!
По понятным причинам система обратного осмоса стоит дороже, потому все еще остается недостаточно распространенной в быту. У нее есть собственные недостатки – например, требование об обязательном напоре не ниже 2,8 атм. Кроме того, высокая плотность мембраны означает, что сквозь нее за минуту не проходит и стакана воды, потому фильтр обычно не продается и не устанавливается без накопительного бака.
Несмотря на некоторые неудобства, за этой системой будущее, поскольку она способна задерживать даже некоторые бактерии и вирусы.
Видео:Почему пенится и не пенится мыло?Скачать

Почему в жёсткой воде мыло не мылится?
Случается, что в воде на вид совершенно прозрачной и чистой мыло не образует пену, а вещи не отстирываются. Можно подумать, что куплены некачественные моющие средства, но скорее всего проблема в жёсткой воде.
Видео:Жесткость воды и соли жесткости. Лекция 7 / Ochistkavodi.ruСкачать

Что заставляет мыло пениться?
В основе мыла содержатся натриевые и калиевые соли высших жирных кислот. В результате взаимодействия с водой они распадаются на ионы натрия, как все соли, и на анионы жирных кислот, что обеспечивает мылкость продукта. В процессе трения происходит захват загрязнений с поверхности (например, кожи) и в результате образуется мыльная пена.
Видео:Почему нельзя умываться только водой?Скачать

Как жёсткая вода влияет на мыло?
Жёсткой называют воду, в которой содержится избыточное количество солей кальция и магния. Соприкасаясь с различными поверхностями, они оставляют белый осадок, который при нагревании превращается в прочные известковые наросты – накипь. В результате трубопровод быстро засоряется отложениями, а бытовые водогрейные и приборы выходят из строя.
При попытке растворить мыло в жёсткой воде, анионы жирных кислот образуют связи с катионами кальция и магния. Эти связи настолько прочные и крупные, что их легко заметить по образованию хлопьев на поверхности воды. Из-за таких нерастворимых новообразований выводятся из раствора ионы жирных кислот, в результате чего мыло и перестаёт давать пену.
Чем выше уровень жёсткости в воде, тем хуже будут справляться со своими задачами моющие средства.
Видео:Усыхает ли мыло из основы Brilliant Hard?/Как мылится?/Остаётся ли аромат?/Плачет?/Мыловарение/SoapСкачать

Жёсткая вода. Что делать?
Проблема жёсткой воды чаще всего затрагивает владельцев природных источников – скважин и колодцев. Однако в ряде регионов возникновение накипи встречается и при использовании водопроводной воды. Дело в том, что российские нормы СанПин по содержанию в воде солей жёсткости (10 мг-экв/л) давно устарели. Конечно, для питья такая вода безопасна, однако главная проблема – накипь, никуда не девается. Известно, что образование известковых наростов начинается уже при содержании солей кальция и магния в воде от 3 мг-экв/л.
Избавиться от избытка солей жёсткости в воде можно с помощью установки ионообменных фильтров умягчителей. Внутри их корпуса находится специальная гранулированная смола. Проходя через слой фильтрующей загрузки, ионы кальция и магния в воде обмениваются на нейтральные ионы натрия. За счёт этого процесса и происходит умягчение жёсткой воды. Промывка фильтрующей загрузки в установке осуществляется раствором обычной поваренной соли, которая подаётся из специального бачка (фидер для соли).
Важно понимать, что соли жёсткости являются легкорастворимыми веществами в воде, поэтому устранить их привычными фильтрами механической очистки с картриджами не удастся.
Специалисты компании «Комплексные решения» проектирует, а также устанавливает надёжные, эффективные и экономичные системы очистки воды любого уровня сложности. Подбор оборудования осуществляется по результатам анализа воды, с учётом технических условий и персональных требований заказчика. Оснащение водоочистных систем выполняется из комплектующих от лучших европейских и отечественных производителей.
Рабочие элементы управляющих клапанов изготавливаются из высокопрочной керамики, которая не боится износа или повреждений от механических частиц в воде.
Как получить бесплатное технико-коммерческое предложение
- Привезите воду для анализа в офис нашей компании
или отправьте результаты анализа воды нам на почту info@kr-company.ru с кратким пояснением, в каких объемах требуется очищенная вода - Позвоните нам по многоканальному телефону 8(800) 222-80-97
и получите консультацию специалиста
Оставьте свой номер телефона
и мы бесплатно перезвоним Вам
Видео:О потении мыла, усушке и сцеплении слоёв. Правила работы с мыльной основой | Выдумщики.руСкачать

Домашняя практическая работа «Изучение свойств мыла»
Овчинникова Марина Альбертовна, учитель химии МАОУ «СОШ № 29», г. Ревда
Весной, когда всех школьников перевели на дистанционное обучение, передо мной встал вопрос : «Можно ли какие-нибудь лабораторные или практические работы провести в домашних условиях?»
Для этого как нельзя лучше подошла работа «Изучение свойств мыла». Обычно я провожу ее в 10 классе при изучении моющих средств, но, подумав и немного изменив текст работы, я предложила ее ребятам для домашнего эксперимента.
Оборудование: возьмите вместо пробирок небольшие прозрачные стаканчики.
Опыт 1: «Гидролиз мыла». Приготовьте индикатор из замороженных ягод, компота или варенья (черная смородина, черника, черноплодная рябина). Для этого разморозьте ягоды, разбавьте водой варенье или возьмите готовый компот. В стаканчик с раствором хозяйственного мыла добавьте несколько капель этого индикатора. Как поменялась окраска индикатора? Почему? Что произошло? Дайте объяснения наблюдаемому явлению. Напишите уравнение гидролиза стеарата натрия (найдите информацию).
Оказалось, что для приготовления индикатора лучше подходят замороженные ягоды чем варенье. Очень хорошо видно, как самодельный индикатор меняет окраску в растворе хозяйственного мыла. Гидролиз растворов солей ученики 10 класса еще не изучали, но в этом году, при изучении этой темы я напомнила детям, как идет гидролиз стеарата натрия и почему окраска индикатора изменилась с розовой на синюю.
Опыт 2. «Отношение мыла к кислотам». Налейте в стаканчик 2 мл водного раствора обыкновенного хозяйственного мыла. Прибавьте туда несколько капель раствора уксусной кислоты (6 или 9%) до образования хлопьев.
Какое вещество выпадает в виде хлопьевидного осадка? Объясните это явление. Осталась ли мыльная пена? Составьте уравнение реакции в молекулярном виде. Почему мыло теряет моющие свойства в кислой среде?
В пробирке наблюдается образование белого аморфного осадка.
Ученики делают вывод: Уксусная кислота сильнее стеариновой кислоты, т.к. вытесняет ее в осадок.
Опыт 3. «Получение нерастворимых солей». В стаканчик налейте 1 мл раствора мыла, затем раствор сульфата меди (II) (Если есть дома медный купорос). Объясните изменения. Почему выпал осадок? Составьте уравнение реакции в молекулярном и ионном виде.
Медный купорос оказался только у нескольких учеников, но те, кто проделал этот опыт, увидели, что выпадает голубой осадок (все соли меди голубого цвета), значит, идет реакция обмена с образованием нерастворимого стеарата меди.
Опыт 4. «Сравнение свойств мыла и синтетических моющих средств».
Жесткая вода содержит соли Са 2+ и Мg 2+ . Дома соль Са 2+ можно получить при действии уксусной кислоты на яичную скорлупу (CaCO3). Реакция идет не сразу, подождите минут 30 или даже больше.
В 2 стаканчика с растворами мыла и синтетического моющего средства добавьте по 1-2 мл жесткой воды (соль кальция). Что вы наблюдаете? Составьте уравнение взаимодействия CaCO3 с уксусной кислотой и хлорида кальция с мылом (стеарат натрия) в молекулярном и ионном виде. Какой раствор не утрачивает моющего действия в жёсткой воде? Почему?
Раствор СМС продолжает пениться, т.е. не теряет моющее действие.
Раствор мыла не пенится, т.е. теряет моющее действие.
Вывод: В жесткой воде хозяйственное мыло теряет моющее действие и образуется осадок, а СМС не теряет моющее действие.
Опыт 5: «Способность мыла эмульгировать жиры».
Поместите по 1 капле подсолнечного масла в 3 стаканчики с водой. Добавьте в одну из них раствор СМС, в другую — раствор мыла и энергично встряхните обе пробирки. Сравните с той пробиркой, где нет мыла и СМС. Что наблюдаете? Объясните происходящие явления. Почему раствор СМС и мыла способен уничтожать жир?
В 1-ой пробирке с мылом не осталось масла и образовалось мало пены. Во 2-ой пробирке с СМС не осталось масла и образовалось много пены. В 3-ей пробирке с обычной водой масло всплыло на поверхность.
Вывод: Моющий эффект СМС и хозяйственного мыла проявляется в эмульгировании масла с загрязненной и замасленной одежды, т.к. капля масла пропадает в растворе мыла и СМС, а в воде масло всплывает на поверхность.
Предложила оформить отчет о работе на двойном листочке по форме
Видео:Регенерация ионообменной смолыСкачать

О мыле и о том, что происходит,
когда оно встречается с водой
Контрольно-обобщающий урок
Форма урока. Комбинированная.
Цель урока. Актуализировать знания и умения учащихся по теме.
Оборудование и реактивы. Таблица «Структуры, названия и источники получения некоторых жирных кислот».

На столах школьников: учебник «Химия-10» Э.Е.Нифантьева и Л.А.Цветкова, пособие Н.П.Гаврусейко «Проверочные работы по органической химии», жесткая и мягкая вода, универсальная лакмусовая бумага, 1%-й раствор мыла, набор упаковок мыла разных сортов.
На отдельном столе: упаковки синтетических моющих средств (СМС), упаковки мыла, шампуни.
Учитель. Необходимо, чтобы при мытье и при стирке вещей грязь перешла с их поверхности в моющий раствор, в воду. Однако многие загрязнения в воде не растворяются. Как же удержать их там и не дать им снова осесть на поверхности вещей?
Это достигается с помощью поверхностно-активных веществ (ПАВ), к числу которых относится и мыло. Эти вещества способны дробить загрязнения на мельчайшие частицы и удерживать их в воде, не давая им снова осесть на очищенную поверхность.
Назовите торговые марки мыла, упаковки которых лежат у вас на партах.
Школьники называют свыше 15 наименований твердого мыла: «Детское», «Абсолют», «Банное», «Хозяйственное», «Земляничное»…
Учитель. Чем они отличаются друг от друга и в чем у них сходство?
Ученик. Основной состав любого твердого мыла одинаков. Это натриевые соли высших карбоновых кислот, обычно получаемых из жиров природного происхождения. Отличия заключаются в добавках, которые вносят в мыло в зависимости от его назначения.
Учитель ставит перед классом задание – написать реакцию получения мыла с помощью таблицы «Структуры, названия и источники получения некоторых жирных кислот»:
Учитель. Решите задачу из сборника Н.П.Гаврусейко на с. 31 следующего содержания.
Задача. Сколько кальцинированной соды (в г) потребуется для реакции со стеариновой кислотой массой 28,4 г и сколько (в г) образуется стеарата натрия при 90%-м выходе?
а) 5,3 и 17,2; б) 7,2 и 27,54;
в) 10,6 и 17,2; г) 5,3 и 27,54.
Решение
Учитель. Почему мыло моет и стирает? Проделаем ОПЫТ 1. Один палец руки испачкаем глиной, второй – сажей, а третий – сажей, растертой в вазелиновом масле. Подставим выпачканную таким образом руку под струю холодной воды. Первый палец окажется чистым, со второго удалится только избыток сажи, а тот ее слой, что прилип к коже, сохранится, тогда как третий палец нисколько не очистится. Попробуем вымыть руку в горячей воде – тоже отрицательный результат.

Почему сажа пачкает так сильно? Вообще-то глина тоже пачкает, но легко отмывается, значит, тут есть какое-то серьезное различие. Оно заключается в том, что частицы глины гидрофильны, т.е. хорошо смачиваются водой, – они и молекулы воды сильно притягиваются друг к другу, причем сильнее, чем частицы глины притягиваются к поверхности кожи, всегда слегка смазанной жировыми выделениями. Именно поэтому частицы глины так легко отрываются от поверхности рук.
Частицы углерода, из которых почти нацело состоит сажа, – гидрофобны, т.е. они не смачиваются водой, потому что молекулы воды притягиваются к ним очень слабо. Но зато они легко «замасливаются». Говорят, что они олеофильны. Именно поэтому сажа так прочно прилипает к коже рук.
Почему сажа, размешанная в масле, пачкает еще сильнее? Потому что тончайшая пленка из молекул минерального масла легко обволакивает частицы сажи (наподобие молекулам воды, окружающим частицы глины). Образуется устойчивая суспензия: мельчайшие сажевые частицы не могут собраться в комки, т. к. масло не подпускает их вплотную друг к другу.
Теперь мы подошли к самой сути проблемы мытья и стирки. Гидрофобная часть молекулы мыла проникает в гидрофобное загрязняющее вещество (жир), в результате чего поверхность каждой частицы или капельки загрязнения оказывается как бы окруженной оболочкой из гидрофильных групп. Гидрофильные группы взаимодействуют с полярными молекулами воды. Благодаря этому молекулы моющего средства вместе с загрязнением отрываются от поверхности ткани и уходят в водную среду. (Рассказ сопровождается показом рисунков из учебника Цветкова, с. 109.) Моющая способность мыла усиливается благодаря тому, что при гидролизе мыла образуется щелочь, которая обладает эмульгирующим свойством.
ОПЫТ 2. Школьники определяют среду раствора мыла с помощью универсальной лакмусовой бумаги и записывают уравнение гидролиза мыла:
Учитель. В жесткой воде моющая способность мыла резко снижается, поскольку растворимые натриевые или калиевые соли высших жирных кислот вступают в обменную реакцию с имеющимися в жесткой воде растворимыми кислыми карбонатами щелочно-земельных металлов, главным образом кальция:
2C15H31COONa + Ca(HCO3)2 

Получающиеся при этом нерастворимые кальциевые соли высших жирных кислот образуют липкие осадки.

Учитель. Мытье рук всегда ассоциируется с обильной пеной, и чем больше пены, тем, как известно, руки моются легче. Пена уносит частицы грязи. Но пена вовсе не обязательна для мытья. Мыло на основе касторового масла вообще не пенится, но моющая способность его прекрасная.
Пена – спутник всякого хорошего мыла, как бы индикатор его присутствия. Интересна область применения мыльных пузырей. Оказывается, с их помощью решаются трудные математические задачи определения минимальных поверхностей. Мыльные пузыри использует служба прогнозов погоды. Пускать мыльные пузыри очень нравится маленьким детям.
ОПЫТ 4. Учитель получает мыльные пузыри, заполненные водородом, которые стремительно поднимаются вверх.
 | ||||||||||||||||||||
| Структура (формула) | Название кислоты | Источник получения |
|---|---|---|
| СН3(СН2)10СООН (С11Н23СООН) | Лауриновая | Кокосовое масло |
| СН3(СН2)12СООН (С13Н27СООН) | Миристиновая | Мускатное масло |
| СН3(СН2)16СООН (С17Н35СООН) | Стеариновая | Животные жиры |
| СН3(СН2)7СН=СН(СН2)7СООН (С17Н33СООН) | Олеиновая | Оливковое масло |
| СН3(СН2)4СН=СНСН2СН=СН(СН2)7СООН (С17Н31СООН) | Линолевая | Конопляное масло |
| СН3СН2СН=СНСН2СН=СНСН2СН=СН(СН2)7СООН (С17Н29СООН) | Линоленовая | Льняное масло |
ЛИТЕРАТУРА
Габриелян О.С., Лысова Г.Г. Химия-11. М.: Блик-плюс, 2000;
Писаренко А.Н., Хавин З.Я. Курс органической химии. М.: Высшая школа, 1985;
Браун Т., Лемей Г.Ю. Химия в центре наук. М.: Мир, 1983;
Юдин А.М., Сучков В.Н. Химия для вас. М.: Химия, 1983.
🎬 Видео
Что, если бы вы не пользовались мылом в течение целого месяцаСкачать

Почему не работает умягчитель? Как настроить умягчитель. Очистка воды.Скачать

Такие ошибки нельзя допускать на водоснабжении дома.Скачать

Жидкое мыло. Не срабатывает дозатор?Скачать

БЫВАЕТ ЛИ МЫЛО ГРЯЗНЫМ?Скачать

Попробовала мыло против пятен, о котором кричат на каждом углу. Результат поражающийСкачать

Почему мыло смывает грязьСкачать

Как сделать так, что бы мыло не раскисало в мыльнице? (Недостаток - слабая присоска, нужен апгрейд)Скачать

Почему мыло потеет? Что делать, если мыло заплакало? Как предотвратить потение мыла? | Выдумщики.руСкачать

Лежит и мокнет.. КАК СПАСТИ МЫЛО от размокания!Скачать

МЫЛО С НУЛЯ НЕ ПОЛУЧИЛОСЬ 😑 ИЩЕМ ПРИЧИНУ 🧐 КУДА ДЕТЬ КИЛОГРАММ ИСПОРЧЕННОГО МЫЛА !?Скачать