Большинство людей думает, что металлы (Me) не горят. Но это не так. Причем воспламенения некоторых Me ликвидировать очень сложно. Ошибка способна привести к взрыву и другим неприятным последствиям. В статье пойдет речь о том, чем тушить магний.
- Классы пожаров
- Пожары класса D – что это
- Как горят металлы
- Характеристика и свойства магния
- Чем его можно тушить
- Чем нельзя и что будет
- Основные правила тушения пожаров класса D
- Нормативные документы
- Выводы
- Магний, уравнение реакции его горения
- Физические свойства магния
- Химические свойства магния
- Почему горящий магний нельзя тушить водой написать уравнения
- 🎬 Видео
Видео:Горение магния - химическая реакция.Скачать

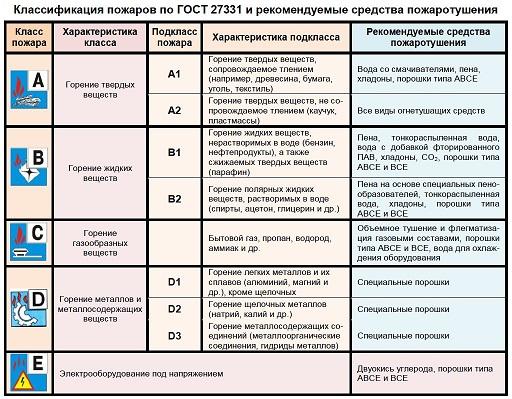
Классы пожаров
Процесс неконтролируемого горения, способного нанести существенный ущерб, принято делить на категории:
- А – воспламенение твердого вещества (уголь, бумага, пластмасса). Может сопровождаться тлением.
- В – горение жидкости.
- С – пожар с участием газообразного вещества.
- Д – воспламенение металла.
- Е – возгорание электроустановки.
- F – горение радиоактивного соединения.
Видео:Почему горящее масло не стоит тушить водой?Скачать

Пожары класса D – что это
К этой категории относят все случаи горения металлов. Пожары класса D делятся на 3 вида:
- Д1 – воспламенение легких металлов (магний, алюминий), условно тяжелых (уран, цирконий);
- Д2 – пожар с участием щелочных Me (калий, натрий);
- Д3 – горение металлоорганических соединений.
Видео:Вот почему нельзя тушить горящий магний водой!Скачать

Как горят металлы
Исходя из характера горения, Me бывают:
- Летучие (магний, калий, натрий, кальций, литий). Для них характерна низкая температура фазового перехода. При 1000 К они начинают плавиться, а при 1500 К – кипеть.
- Нелетучие. Температура фазового перехода плавления у них составляет более 1000 К, а кипения – выше 2500 К. При горении таких металлов формируется оксидная пленка, сцепляющаяся с поверхностью вещества. Из-за этого диффузия паров затрудняется, потому крупные частички бериллия, алюминия и других нелетучих металлов гореть не могут. Воспламенению подвержены стружка и аэрозоли этих Me.
При поднесении к металлу открытого огня на поверхности вещества начинается испарение и окисление. Когда концентрация паров достигает предела, происходит воспламенение Me, возникает цветной огонь. По оттенку можно понять, какой это металл:
- стронций горит бордовым;
- литий – малиновым;
- натрий – ярко-желтым;
- кальций – кирпичным;
- железо – бледно-желтым;
- барий и молибден – зелено-желтым;
- медь – сине-зеленым;
- бор – светло-зеленым;
- селен – голубым;
- мышьяк – светло-синим;
- калий – насыщенным фиолетовым;
- свинец – голубым.
На заметку. Щелочные металлы в виде пудры или порошка, находясь на открытом воздухе, способны к самовоспламенению. Это происходит из-за их окисления, что приводит к повышению температуры.
Видео:Галилео. Эксперимент. Магний в кислородеСкачать

Характеристика и свойства магния
Mg – двухвалентный, пластичный, щелочно-земельный, активный металл серебристого оттенка. Если магний находится на открытом воздухе, на его поверхности появляется пленка окиси. Этот металл довольно активный и растворяется в воде при нагревании. Реагирует со всеми кислотами, за исключением плавиковой.

Магний устойчив к действию минеральных масел, бензина, едкой щелочи, керосина, соды. Благодаря способности соединяться с хлором и кислородом металл применяют для выделения чистых веществ (титана, брома). Чтобы синтезировать органические соединения, используют возможность взаимодействия Mg с галогенами (йод, хлор).
Чем его можно тушить
Главным средством, используемым для ликвидации воспламенения магния, является порошковый огнетушитель. Оптимальный вариант устройства – тот, в состав которого входят хлориды. Это связано с их доступностью и нетоксичностью.
Механизм действия огнетушителя основан на создании препятствия доступа воздуха к месту горения. К другим свойствам работы усройства относят охлаждение поверхности, ингибирование реакции.

Небольшой очаг можно потушить:
- Чугунной стружкой. При этом нужно проследить, чтобы на поверхности стружки отсутствовала ржавчина, способная вступать в химическую реакцию с магнием, усиливая пожар.
- Воздушно-механической пеной.
- Густым минеральным маслом.
Чем нельзя и что будет
Справиться с возгоранием Mg непросто. Почему нельзя потушить горящий магний углекислотным огнетушителем? Потому что такой пожар происходит при участии СО2, а использование углекислотного огнетушителя только усилит горение. Для ликвидации пламени также недопустимо применять воду, так как может произойти взрыв.
Если начала гореть значительная площадь, то засыпание территории песком приведет к выделению большого количества тепла. Не подойдет и такое популярное средство, как фтористая присадка. Это связано с тем, что в результате ее реакции с магнием формируется аммиак, способный вызвать отравление.

Видео:Магний - самый горячий металл на Земле!Скачать

Основные правила тушения пожаров класса D
Горящие металлы затушить практически невозможно. Обычно стратегия борьбы с огнем состоит в том, чтобы дать веществу догореть до конца, сдерживая распространение пожара на большую площадь. Для этого окружающие поверхности заливаются водой или подходящим средством тушения огня.
Данный вид горения происходит при высокой температуре на поверхности металлов. При этом наблюдается искрообразование. Ликвидируя огонь, нужно придерживаться определенных правил:
- Не использовать воду. Вступая в реакцию с магниевыми сплавами, она только повышает горение, а металл способен разбрызгиваться вокруг.
- Песок усиливает пожар, поэтому от его использования нужно отказаться.
- Тушить металлы эффективно сухим порошком. Для каждого случая выбираются оптимальные составы тушащего вещества.
- Когда горят сплавы магния, применяют молотый флюс. Он образует на поверхности жидкую пленку, которая останавливает реакцию.
- Калий и натрий тушатся порошками ПС-1 или ПС-2.
- Возгорания щелочных металлов устраняют азотом, аргоном или поваренной солью.
- Тушение натрия проводят порошковым графитом.
- Горение лития устранить сложно. Для этого специально созданы огнетушители с примесями графита и флюса, которые используют на производствах. Допускается подавление огня аргоном (вытесняет воздух).
- Пожар считается ликвидированным только после того, как поверхности, которые загорелись, полностью остынут.
Видео:Почему горящее масло нельзя тушить водой?Скачать

Нормативные документы
Технический регламент и основные требования пожарной безопасности прописаны в законе №123-ФЗ от 27 декабря 2018 г. Стандарты специализированной техники и порядок использования огнетушителей указаны в ГОСТ 51057-2001.
Видео:Горение магния в углекислом газеСкачать

Выводы
Тушение магния – непростая задача. Для устранения огня подходят не все способы. Использование некоторых из них – к примеру, воды или углекислотного огнетушителя – способно только усугубить ситуацию. Оптимальным выбором считается чугунная стружка или воздушно-механическая пена.
Видео:Галилео. Эксперимент. Магний с пескомСкачать

Магний, уравнение реакции его горения
Какие химические процессы протекают при горении магния
Из этой статьи вы узнаете, что такое магний, и увидите настоящее химическое чудо — горение магния в воде!
В XVII веке в английском городке Эпсом из минерального источника было выделено горьковатое вещество, которое обладало слабительным действием. Этим веществом оказался кристаллогидрат сульфата магния или MgSO₄∙7H₂O. Из-за специфического вкуса аптекари окрестили это соединение «горькой солью». В 1808 году английский химик Гемфри Дэви с помощью магнезии и ртути получил амальгаму двенадцатого элемента. Одиннадцать лет спустя французский химик Антуан Бюсси получил рассматриваемое вещество с помощью хлорида магния и калия, восстановив магний.
Магний — один из самых распространенных элементов в земной коре. Больше всего соединений магния находится в морской воде. Этот элемент играет важную роль в жизни человека, животных и растений.
Как металл, магний не используют в чистом виде — только в сплавах (например, с титаном). Магний позволяет создавать сверхлегкие сплавы.
Видео:Острые признаки нехватки Магния в организме, о которых не знает 99 людейСкачать

Физические свойства магния
Магний представляет собой легкий и пластичный металл серебристо-светлого цвета c характерным металлическим блеском.
Магний окисляется воздухом, на его поверхности образуется достаточно прочная пленка MgO, которая защищает металл от коррозии.
Температура плавления серебристого метала составляет 650 °C, а кипения — 1091 °C.
Видео:10 Признаков Того, Что Вашему Организму Не Хватает МагнияСкачать

Химические свойства магния
Этот металл покрыт защитной оксидной пленкой. Если ее разрушить, магний быстро окислится на воздухе. Под температурным воздействием металл активно взаимодействует с галогенами и многими неметаллами. Магний реагирует с горячей водой, образуя гидроксид магния в виде осадка:
Mg + 2H₂O = Mg(OH)₂ + H₂
Если на газовой горелке в специальной химической ложке поджечь порошок магния, а затем опустить его в воду, порошок начнет гореть интенсивнее.
Вот как это происходит:
Из-за интенсивно-выделяющегося водорода горение будет сопровождаться ослепительными вспышками. При этом образуется оксид магния, а затем его гидроксид.
Магний относится к активным металлам, а потому бурно взаимодействует с кислотами. Однако это происходит не так бурно, как в случае с щелочным металлом калием, то есть реакция проходит без воспламенения. Зато с характерным шипением активно выделяются пузырьки водорода. И хотя пузырьки водорода поднимают металл, он не настолько легкий, чтобы оставаться на плаву.
Уравнение реакции магния и соляной кислоты:
Mg + 2HCl = MgCl₂ +H₂
При температуре выше 600 °C магний воспламеняется на воздухе, испуская при этом крайне яркий свет практически во всем спектре, подобно Солнцу.
Внимание! Не пытайтесь повторить эти опыты самостоятельно!
Такая ослепительная вспышка может травмировать глаза: можно получить ожог сетчатки, а в худшем случае — потерять зрение. Поэтому подобный опыт относится не только к самым красивым, но и к самым опасным. Не рекомендуется проводить этот опыт без специальных защитных темных очков. Здесь вы найдте эксперимент с горением магния, который можно безопасно проводить дома.
В процессе реакции образуются белый порошок оксида магния (его еще называют магнезией), а также нитрид магния. Уравнения горения:
Магний продолжает гореть как в воде, так и в атмосфере углекислого газа, поэтому потушить такой огонь довольно сложно. Тушение водой только усугубляет ситуацию, так как начинает выделяться водород, который также воспламеняется.
12-й элемент очень похож на щелочной металл литий. Например, он также взаимодействует с азотом, образуя нитрид:
Также, подобно литию, нитрид магния можно легко разложить с помощью воды:
Видео:9 признаков недостатка МАГНИЯ в организме: симптомы и профилактикаСкачать

Почему горящий магний нельзя тушить водой написать уравнения
В отличие от многих других горючих веществ (дерева, бензина, пластиков, серы, воска и т.п.) магний способен гореть не только на воздухе, но и в атмосфере углекислого газа. Это свойство магния можно использовать для целого ряда эффектных экспериментов. Однако способность магния гореть в углекислом газе важна не только для химических опытов: магний — металл, который широко используется в технике, поэтому пожары с его участием, увы, неизбежны.
Горящий магний нельзя тушить водой — это может привести к взрыву [1], вместе с тем его бесполезно тушить углекислым газом — металл прекрасно горит и в атмосфере CO2. Остается разве что вариант с аргоном или солями вроде хлористого натрия или калия.
Эксперимент по горению магния в трехлитровой банке с углекислым газом уже был описан в журнале [2]. Решил повторить его, взяв на этот раз фотоаппарат, который дает видео с бОльшим разрешением.
Первой задачей было наполнить трехлитровую банку углекислым газом. Первоначальной решил получить газ реакцией соды и азотной кислоты. Молярная масса кальцинированной соды — 106 г/моль плюс к этому из-за хранения в открытом кульке сода могла присоединить до 10 моль воды на 1 моль безводной соли, молярная масса десятиводного гидрата — 286 г/моль. Это количество выделяет при действии кислоты 1 моль углекислого газа или 22.4 л (при нормальных условиях, но разницей можно пренебречь, т.к. при комнатной температуре объем будет больше). Чтобы заполнить трехлитровую банку нужно литров 5 углекислого газа, т.е. примерно 1/4 моля. Итого, нужно 286/4=72 г соды. Идея провести реакцию между кислотой и таким количеством соды мне не понравилась: слишком уже это муторно (а в случае малейшей ошибки можно получить эффект пенного огнетушителя).
В лаборатории был баллон с углекислым газом, но с неисправным вентилем и редуктором: кран баллона травил, причем не через штуцер, а через резьбу, а редуктор не мог полностью перекрыть поток газа. Попытка набрать газ из такого баллона могла закончиться потерей всего его содержимого. Но я решил: «Держать этот баллон, как музейный экспонат или как?». Даже если все содержимое баллона будет потеряно, стоит набрать хотя бы три литра. Набрал углекислый газ в трехлитровую банку, закрыл крышкой. Минут 5 провозился с вентилем, пока его удалось закрутить настолько, чтобы газ не свистел.
Теперь сам опыт. Сначала внес в банку горящую лучину — она сразу же погасла. Потом зажег в ложечке кусок магния (сплав электрон) и внес его в банку. Сразу же закрыл крышкой. Магний продолжил гореть в углекислом газе — не менее ярко, чем на воздухе. Образовалось много белого дыма оксида магния, который вскоре заполнил все пространство банки. Со временем горящий магний начал тускнеть, приобрел желтый цвет и стал понемногу угасать. Опыт длился несколько минут.
В ложечке для сжигания остался белый оксид магния и черный углерод. Любопытно, что весь углерод был в ложечке: в процессе горения черный дым или хлопья сажи не образовывались.
Боялся, что трехлитровая банка треснет (на дно я не насыпал песок), но в этот раз обошлось.
_____________________________________________
1 См. статьи Эксперименты с магнием. Горит ли магний под водой? [ссылка] и Что будет, если магний гасить водой? [ссылка]
2 См. статью Эксперименты с магнием. Горение магния в углекислом газе [ссылка]
Лучина гаснет в углекислом газе |
Горение магния в углекислом газе |
Эксперименты с магнием Много веществ, которые горят на воздухе, не способны гореть в атмосфере углекислого газа. На этом основан принцип работы углекислотного огнетушителя. Однако некоторые активные вещества способны гореть и в атмосфере углекислого газа. К последним относятся щелочные и щелочноземельные металлы, а также — магний. Эксперимент по горению магния в атмосфере углекислого газа прост в исполнении и не требует специального оборудования. Возьмите трехлитровую банку, насыпьте на дно слой сухого песка или поваренной соли и заполните банку углекислым газом. Накройте банку чашкой Петри или стеклом. В ложечке для сжигания подожгите магний. Когда магний ярко разгорится, внесите его в банку с углекислым газом. Магний продолжит ярко гореть, раскалится добела, при этом образуется много белого дыма — оксида MgO. После горения в ложечке останется белый оксид магния и черный углерод: 2Mg + CO2 = 2MgO + C Если не учитывать образование углерода, горение магния в углекислом газе очень похоже на горение этого металла на воздухе. Горение магния в углекислом газе |
Существует несколько вариантов эксперимента по горению магния в углекислом газе. Первый из них описан в начале статьи. В другом варианте опыта поджигают смесь магниевого порошка и твердого CO2. Происходит яркая вспышка, но смеси магния со многими окислителями ведут себя аналогично, поэтому эксперимент не является оригинальным. Очень красиво выглядит горение магниевой стружки внутри брикета сухого льда. Для этого берут большой брикет сухого льда, делают в нем углубление и засыпают туда магниевую стружку или фольгу. Фольгу поджигают газовой горелкой и накрывают другим брикетом сухого льда. Заключительную часть опыта проводят в темноте. Магниевая стружка разгорится внутри твердого CO2, и брикет будет ярко светиться. Часть сухого льда сублимируется, образуя белый туман. Когда магний сгорит, верхний брикет снимают. В углублении, где был магний, остается смесь белого MgO и черного углерода. Приобрести сухой лед можно на хладокомбинатах или у некоторых продавцов мороженого. Фотографии, приведенные ниже, взяты из коллекции Эдварда Кента (Edward Kent) http://www.kentchemistry.com/KentsDemos.htm, видео взято из youtube.com. |
Горение магния внутри брикета сухого льда |
Для экспериментов с магнием мы использовали ложечку для сжигания, которую легко сделать самому. Для этого нужно взять кусочек сетки из нержавеющей стали и отрезок стальной проволоки длинной 20-30 см. |
Самодельная ложечка для сжигания Казалось бы, проблем возникнуть не должно, ведь магний много лет использовался для фотовспышек. Но все не так просто. Поджечь компактный металл очень трудно. Наоборот, магниевый порошок легко загорается, зато очень быстро сгорает — можно просто не успеть внести ложечку с горящим порошком магния в сосуд с газом или парами. Лучше всего использовать магниевую стружку (магниевую фольгу) — она сравнительно легко загорается в пламени горелки и не так быстро сгорает. У нас под рукой фольги не оказалось, поэтому автор брал кусочки магния (вернее, электрона — сплава магния) размером примерно 10 х 5 х 3 мм. Поджечь такие кусочки оказалось непросто. Для этого кусочек клали в ложечку для сжигания, сильно нагревали ее в пламени газовой горелки, потом направляли на магний узкое пламя, полученное с помощью поддува воздуха через пипетку (см. фотографии к эксперименту Горение магния в воде [ссылка]). Магний плавился и загорался. Если металл покрывался коркой оксида, ее быстро снимали с расплавленного магния скальпелем (часто именно в этот момент магний загорался). Дополнение: сейчас продают переносные пропан-бутановые горелки, которые дают горячее пламя. Такие горелки позволяют сравнительно легко поджечь магний. Не следует брать слишком малое количество магния, иначе он сгорит до того, как вы успеете его внести в сосуд с газом или парами. Для эксперимента по горению магния в воде следует брать в 3-5 раза большее количество магния. Автор взял 3-5 кусочков указанного выше размера. Важно, чтобы весь магний перед внесением в воду ярко загорелся. В случае горения магния в брикете сухого льда необходимо взять примерно 20-50 см 3 стружки. Из магния состоят аноды для бойлеров (см. фотографию), которые можно свободно купить. Из сплавов магния изготавливают некоторые детали самолетов и корпуса крылатых ракет. Раньше такого добра было достаточно в местах сбора металлолома либо возле полигонов. Кроме того, из магния сделаны некоторые корпуса электроинструментов и других изделий. Магний внешне похож на алюминий и его сплавы. К счастью, отличить их очень просто: если на поверхность магния капнуть уксус, начнется выделение водорода. Алюминий к действию уксусной кислоты устойчив. Вместо уксусной кислоты можно использовать лимонную. |
Магниевый анод для бойлера Все эксперименты проводят в защитных очках, а лучше — в защитной маске. Поблизости не должно быть никаких горючих предметов! Температура горения магния достигает нескольких тысяч градусов, искры и кусочки раскаленного металла могут причинить сильные ожоги и стать причиной пожара. Помните, что пламя магния очень яркое и богато ультрафиолетовыми лучами, берегите глаза! Держите под рукой достаточное количество сухого хлорида натрия — чтобы в случае необходимости засыпать горящий магний. Попытки погасить магний водой приведут к сильным вспышкам и разбрызгиванию частиц горящего металла. 🎬 ВидеоВзаимодействие магния с водойСкачать  Что Произойдет с Телом Если Принимать Магний? Роль Магния в ОрганизмеСкачать  Уникальная польза магния для организма🙌 Вода как источник магнияСкачать  Что если прыгнуть в бассейн наполненный ртутью #shortsСкачать  МАГНИЕВЫЕ опыты!Скачать  Именно поэтому у вас дефицит магния!🧐 Где содержится магний?Скачать  Опыты по химии. Горение магния на воздухеСкачать  Дефицит магния опасен для здоровья‼ Причины нехватки магнияСкачать  Как горит магний и где его взять?Скачать  |