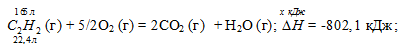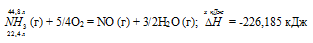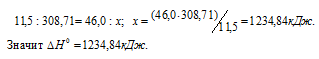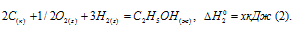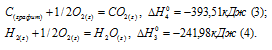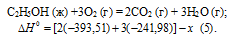Химия | 10 — 11 классы
По термохимическому уравнению реакции CO + 2H2 = CH3OH + 109кДж вычислить количество выделившейся теплоты при образовании 6, 4г метанола.
Ню метанола равно 6, 4 / 32 = 0, 2 моль
составим пропорцию : 1 моль по уравнению дает 109 кДж, 0, 2 моль по условию дадут х кДж
Х = 0, 2 * 109 / 1 = 21, 8кДж.
- Какое количество теплоты выделится при сгорании 2, 24 л водорода?
- 1 / При взаимодействии 3?
- По термохимическому уравнению 2Cu + O2 = 2CuO + 311 кДж Вычислите, Сколько теплоты выделится при окислении меди количеством 6 моль?
- По термохимическому уравнению 2Cu + O2 = 2CuO + 311 кдж?
- ХЕЛП по термохимическому уравнению реакции : 3Fe + 2O2 = Fe3O4 + 1116 кДж вычислите количество теплоты, выделившееся при сжигании 1кг железа в кислороде С РЕШЕНИЕМ ПОЖАЙЛУСТА25 БАЛЛОВ ОТДАМ?
- При сгорании кальция массой 8 г количество выделившейся теплоты составило 127 кДж?
- Согласно термохимическому уравнению реакции 2kclo3 = 2kcl + 3o2 + 78 кдж при образовании 112 ликислорода количество выделившейся теплоты будет равно?
- По термохимическому уравнению реакции 2C2h2 + 5O2 = 4CO2 + 2H2O + 2610 кДж вычислите массу сгоревшего ацетилена, если выделилось 3915 кДж теплоты?
- Вычислите количество теплоты, которая выделится при сгорании 11, 2 м3 метана (н?
- Вычислите, какое количество теплоты выделится при сжигании 100 л водорода, взятого при нормальных условиях?
- По термохимическому уравнению реакции co 2h2 ch3oh 109 кдж
- Как написать хороший ответ?
- Составление термохимического уравнения реакции и вычисление теплот образования веществ
- Теплота образования веществ
- Теплота образования
- Тепловой эффект реакции
- Термохимическое уравнение реакции
- 💥 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Какое количество теплоты выделится при сгорании 2, 24 л водорода?
Какое количество теплоты выделится при сгорании 2, 24 л водорода?
Термохимическое уравнение реакции : 2H2 + O2 = 2H2O + 572 кДж.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

1 / При взаимодействии 3?
1 / При взаимодействии 3.
2 граммов железа с серой выделилось 9.
Составьте термохимическое уравнение этой реакции.
2 / При окислении 16 граммов меди кислородом выделилось 77.
Составьте термохимическое уравнение этой реакции.
Видео:Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

По термохимическому уравнению 2Cu + O2 = 2CuO + 311 кДж Вычислите, Сколько теплоты выделится при окислении меди количеством 6 моль?
По термохимическому уравнению 2Cu + O2 = 2CuO + 311 кДж Вычислите, Сколько теплоты выделится при окислении меди количеством 6 моль.
Видео:Решение задач по теме «Расчеты по термохимическим уравнениям». 9 и 11 класс.Скачать

По термохимическому уравнению 2Cu + O2 = 2CuO + 311 кдж?
По термохимическому уравнению 2Cu + O2 = 2CuO + 311 кдж.
Вычислите, сколько теплоты выделится при окислении меди количеством 6моль.
Видео:Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

ХЕЛП по термохимическому уравнению реакции : 3Fe + 2O2 = Fe3O4 + 1116 кДж вычислите количество теплоты, выделившееся при сжигании 1кг железа в кислороде С РЕШЕНИЕМ ПОЖАЙЛУСТА25 БАЛЛОВ ОТДАМ?
ХЕЛП по термохимическому уравнению реакции : 3Fe + 2O2 = Fe3O4 + 1116 кДж вычислите количество теплоты, выделившееся при сжигании 1кг железа в кислороде С РЕШЕНИЕМ ПОЖАЙЛУСТА
25 БАЛЛОВ ОТДАМ.
Видео:Решение задач по термохимическим уравнениям. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

При сгорании кальция массой 8 г количество выделившейся теплоты составило 127 кДж?
При сгорании кальция массой 8 г количество выделившейся теплоты составило 127 кДж.
Напишите термохимическое уравнение реакции.
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Согласно термохимическому уравнению реакции 2kclo3 = 2kcl + 3o2 + 78 кдж при образовании 112 ликислорода количество выделившейся теплоты будет равно?
Согласно термохимическому уравнению реакции 2kclo3 = 2kcl + 3o2 + 78 кдж при образовании 112 ликислорода количество выделившейся теплоты будет равно.
Видео:Химия ЦТ | Задачи по термохимическим уравнениямСкачать

По термохимическому уравнению реакции 2C2h2 + 5O2 = 4CO2 + 2H2O + 2610 кДж вычислите массу сгоревшего ацетилена, если выделилось 3915 кДж теплоты?
По термохимическому уравнению реакции 2C2h2 + 5O2 = 4CO2 + 2H2O + 2610 кДж вычислите массу сгоревшего ацетилена, если выделилось 3915 кДж теплоты.
Видео:Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

Вычислите количество теплоты, которая выделится при сгорании 11, 2 м3 метана (н?
Вычислите количество теплоты, которая выделится при сгорании 11, 2 м3 метана (н.
У. ), если термохимическое уравнение реакции его горения CH4 + 2O2 — > ; CO2 + 2H2O + 900 кДж.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Вычислите, какое количество теплоты выделится при сжигании 100 л водорода, взятого при нормальных условиях?
Вычислите, какое количество теплоты выделится при сжигании 100 л водорода, взятого при нормальных условиях.
Термохимическое уравнение реакции : 2H2 O2 = 2H2O 484 кДж.
На этой странице находится ответ на вопрос По термохимическому уравнению реакции CO + 2H2 = CH3OH + 109кДж вычислить количество выделившейся теплоты при образовании 6, 4г метанола?, из категории Химия, соответствующий программе для 10 — 11 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
А — химический элемент б — простое вещество в — простое вещество г — химический элемент д — химический элемент е — химический элемент(скорее всего) ж — простое вещество з — простое вещество и — химический элемент к — простое вещество(скорее всего).
Водород, углерод, кислород, магний, алюминий, хлор, железо, медь, серебро.
2, 5 — диметил — гектадиен — 3, 4.
Марганец 54, 93 и валентность 2 ; 4 ; 7 Олово 118, 71 и валентность 2 ; 4 Ртуть 200, 59 и валентность 1 ; 2.
А) Металлические свойства ослабевают, т. К увеличивается количество электронов на внешнем энергетическом слое. А т. к металлические свойства — это свойство отдавать электроны, то чем больше их становится тем сложнее и неохотнее их отдают элементы. ..
1)6RbOH + 3Br2 = 5RbBr + RbBrO3 + 3H2O 3)CsOH + Al = Al(OH)3 + Cs2 7)2Fe(OH)3 + 3K2O = 6KOH + Fe2O3.
Это сами металлы Al, K, Na.
K2S = 2K( + ) + S( — 2) гидролиз по аниону S( — 2) + HOH — > HS( — ) + OH( — ) среда щелочная 2K( + ) + S( — 2) + HOH — > 2K( + ) + HS( — ) + OH( — ) K2S + H2O — > KHS + KOH.
Cu ^ 0 — 2e = Cu ^ + 2 восстановитель 2H ^ + 1 + 2e = H2 окислитель Cu + H2O — — — — > CuO + H2 коффициенты 1.
F2 — связь одинарная, сигма — связь. O2 — связь двойная (одна сигма — связь, другая пи — связь). CO2 , структура такая O = C = O , каждая связь C = O двойная, одна сигма — связь, вторая пи — связь NH3 — все связи N — H одинарные, сигма — связи.
Видео:Тепловой эффект реакции. ЗадачиСкачать

По термохимическому уравнению реакции co 2h2 ch3oh 109 кдж
Вопрос по химии:
По термохимическому уравнению реакции CO+2H2=CH3OH + 109кДж
вычислить количество выделившейся теплоты при образовании 6,4г метанола.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Ню метанола равно 6,4/32 = 0,2 моль
составим пропорцию: 1 моль по уравнению дает 109 кДж,
0,2 моль по условию дадут х кДж
Х = 0,2*109/1 =21,8кДж
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Составление термохимического уравнения реакции и вычисление теплот образования веществ
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
💥 Видео
Тепловой эффект химической реакции | ХимияСкачать

В12 ЦТ 2019. Газовые смеси. Задачи по химииСкачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать

Решение задач на термохимические уравнения | Химия | Курсы подготовки к ЦЭ /ЦТ 2024 | АдукарСкачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

Химия | Задачи на термохимиюСкачать