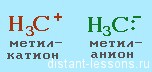Видео:Классификация реакций: ионные и радикальные реакцииСкачать

Ионный и радикальный механизмы
химических реакций органической химии
Ионный механизм химической реакции
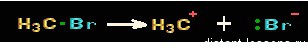
Судя по названию, ионный механизм реакции — это механизм, приводящий к образованию ионов. Соответственно, образуются органические катионы и анионы — карбокатионы или карбоанионы.
Такие ионы образуются при разрыве полярных ковалентных связей в органическом веществе.
Гетеролитический разрыв связей:
- карбокатионы будут взаимодействовать с нуклеофильными частицами,
- анионы – с электрофильными частицами (катионы металлов, галогены и др.)
- карбоанионы ( у них «избыток» электронов) будут взаимодействовать с электрофильными частицами.
Пример ионного механизма химической органической реакции:
Нуклеофильные частицы:
Электрофильные частицы:
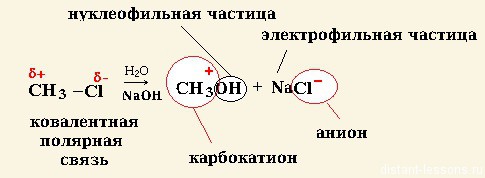
Электрофильные и нуклеофильные реакции
Нуклеофильные реакции — органическое вещество реагирует с нуклеофильным реагентом.
S N — substitution nucleophile
Ad N — addition nucleophile
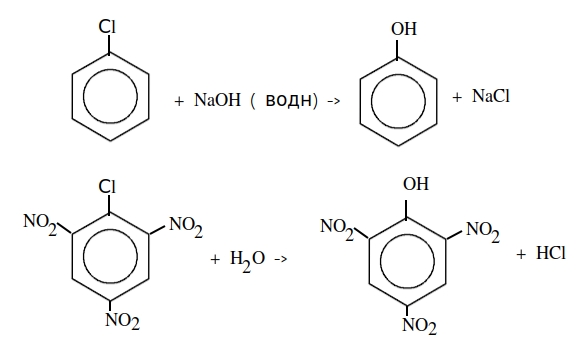
СH 3 Cl + NaOH -> СH3 OH + NaCl
нуклеофильное замещение протекает в тяжелых условиях ( t,p),
но если в бензольном кольце будут электроноакцепторные
заместители, то реакции пойдут намного легче,
электронодонорные — наоборот — затрудняют реакцию
HС≡CH + H2O -> ( Hg 2+ )->
Электрофильные реакции — органическое вещество реагирует с электрофильным реагентом
S E Ar — substitution electrophilic reaction
Ad E — addition electrophilic reaction
( образуется промежуточная частица NO 2 + )
C6H6 + CH 3Cl -> C6H5CH 3 + HCl
В органической химии чаще всего атакующей электрофильной частицей является протон H +
бромирование кратной связи
гидратация двойной связи
присоединение аминов или NH3
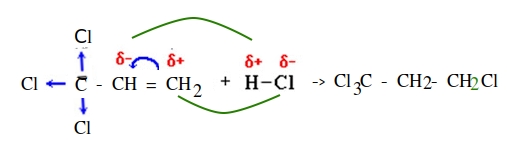
Присоединение по правилу Марковникова — типичный пример ионного типа механизма химической реакции:
водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
В основном, это реакции присоединения к кратным связям или обменные реакции.
Присоединение против правила Марковникова:
- заместитель при двойной связи оттягивает электронную плотность на себя
- если реакция присоединения идет не по электрофильному, а по радикальному механизму,
Ионные реакции проводят:
- при невысокой температуре;
- в полярных растворителях (в воде, например)
Радикальный механизм химической реакции
— механизм, приводящий к образованию радикалов.
Соответственно, образуются органические частицы — радикалы — имеющие неспаренный электрон.
Такие частицы образуются при разрыве неполярных слабо полярных ковалентных связей в органическом веществе.
Гомолитический разрыв связей:
Образовавшиеся радикалы могут взаимодействовать друг с другом.
Классическая реакция, идущая по радикальному механизму — хлорирование метана (обязательно на свету):
Радикальные реакции проводят:
- при высокой температуре,
- под действием света или радиоактивном облучении.
- примеры ЕГЭ — вопросов по механизмам органических реакций
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций:
Например , взаимодействие метана с хлором протекает по цепному радикальному механизму. То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций:
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. I стадия. Электрофилом является протон Н + в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион . На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд: II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. Например , при присоединении бромоводорода к этилену образуется только бромэтан. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Например , при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве: В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. Например , при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода: 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Например , при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан: Видео:Механизм реакции AdR (радикального присоединения) (Бровцин Егор)Скачать  По ионному механизму протекают реакции уравненияИз предложенного перечня выберите реакции, протекающие по ионному механизму. Запишите номера выбранных ответов в порядке возрастания. 1) присоединение бромоводорода к пропену 2) термический крекинг октана 3) взаимодействие пропина с водой в присутствии 4) бромирование бензола в присутствии 5) алкилирование толуола в присутствии 1. Реакция протекает по механизму электрофильного присоединения в несколько стадий (ионный механизм); 2. Радикальный механизм; 3. Реакция проходит с образованием катионов; 4. Реакция идёт с образованием промежуточной частицы — катиона 5. При нагревании бром распадается на радикалы, реакция идёт по радикальному механизму. 💥 Видео9 класс. Реакции ионного обмена. Ионные уравнения.Скачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Реакции ионного обмена. 9 класс.Скачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  Механизм реакций замещения | Химия ЕГЭ 10 класс | УмскулСкачать  Реакции ионного обменаСкачать  Реакции ионного обмена. 9 класс.Скачать  Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  8 класс. ОВР. Окислительно-восстановительные реакции.Скачать  Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  Механизм реакции SN1Скачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  механизмы реакций в органической химииСкачать  Гидролиз солей. 9 класс.Скачать  |