Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Составление уравнений реакций для генетических цепочек по кислородсодержащим. часть 1Скачать  Реакция Дюма (декарбоксилирование)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. Относится к реакциям декарбоксилирования солей карбоновых кислот. Декарбоксилирование – это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (–COOH) или органической кислоты или карбоксилатной группы (–COOMe) соли органической кислоты. Как правило, декарбоксилирование протекает при нагревании с кислотами или щелочами. Сложнее всего отщепить диоксид углерода у монокарбоновых предельных кислот: реакция протекает только при высоких температурах. R–COONa + NaOH → R–H + Na2CO3 Например , ацетат натрия реагирует с гидроксидом натрия только при 400 о С: При этом образуется метан и карбонат натрия. Пропионат калия взаимодействует с гидроксидом калия в расплаве с образованием этана: Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать  Термическое разложение пропионата кальцияЧто такое продукты разложения? Форматит кальция разлагается в формальдегид и карбонат кальция. Ацетат кальция разлагается в ацетон и карбонат кальция. Как пропионат кальция разлагается? Существует бумага (1) , где TG — GLC — MS с последующим XRD анализ твердых продуктов был использован для анализа выделяющихся газов во время разложения пропионата кальция при различных скоростях нагрева. Обнаруженные продукты были $ ce $, $ ce $, $ ce $, $ ce $, $ ce $, $ ce $ , В разделе обсуждения данного документа предлагается следующий механизм формирования:
Combination of the two free radicals results in the formation of the major product, 3-pentanone: The other trace products observed, 2-butanone and propanal, can be accounted for by disproportionation reactions involving the ethyl radical: The methyl and hydrogen radicals so produced may react with the large excess of the original propanoyl radicals to give 2-butanone and propanal respectively. The $ce$ may combine with any of the other radicals or may disproportionate. In any event there was no evidence for compounds larger than 3-propanone. However on close examination of the GC curves there were indications of a very small peak before that due to $ce$ which could be attributed to low molecular weight alkanes and alkenes. (1) Barnes, P. A.; Stephenson, G.; Warrington, S. B. Journal of Thermal Analysis 1982, 25 (2), 299–311. DOI: 10.1007/BF01912955 (2) Hites, R. A.; Biemann, K. J. Am. Chem. Soc. 1972, 94 (16), 5772–5777. DOI: 10.1021/ja00771a039 Abbrev.
Логически можно ответить. Формула для пропаноата кальция представляет собой $ ce $ или, в частности, $ ce $. См., Каждый раз, имеется общий продукт разложения, например, карбонат кальция ($ ce $). Итак, удалим $ ce $ из $ ce $, и вы получите $ ce $, известный как бутанон (MEK). В каждом случае наблюдается увеличение метильной группы. Так, в соответствии с этим продуктами разложения были бы карбонат кальция и МЕК. Для дальнейшего ознакомления с механизмом реакции и условием быстро прочитайте следующие документы: Термическое разложение СР началось, когда карбоксильный радикал был выпаривают от 565 К до 759 К, для которых соответствующая потеря массы процент составил 47,79%. Остаток затем разлагали до выделяют двуокись углерода $ ce <^ > $ между 843 K и 1012 K. Последняя фаза процесс происходил более легко, чем с CC из-за ослабления структура СР, возникающая в результате испарения карбоксильного радикала в низкотемпературной зоне , которая может быть видна непосредственно при сканировании электронный микроскоп. Максимальные потери массы этой фазы при температурах 972 К и 1012 К для СР и СС, соответственно. Метод Озава-Флинн-Уэлл использовался для расчета энергия активации в процессе термического разложения при нагревании скорости 5, 7,5, 10 и 15 K/мин. Результат также подтвердил многоступенчатая характеристика термического разложения СР, которая может быть наблюдаемых в дифференциальных термогравиметрических кривых. Порядок реакции CP в диапазоне преобразования 20% -80%, рассчитанный с использованием теории Аврами были от 0,061 до 0,608, меньше, чем у CC, которые составляли 1,647 до 2.084. Есть что сказать. Применяя дополнительное тепло (выходящее за пределы температуры, в которой CP полностью разлагается на MEK и CC), карбонат кальция разлагается на оксид кальция ($ ce $), а MEK разлагается, чтобы выделять раздражающие и вредные газы, как отмечено pubchem , $ ce <^ > $, скорее всего, двуокись углерода и окиси углерода.
Льюис, Р.J. Sax Опасные свойства промышленных материалов . 9-е изд. Объемы 1-3. Нью-Йорк, Нью-Йорк: Ван Ностранд Рейнхольд, 1996 ., С. 637 💡 ВидеоВсе реакции с неметаллами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать  Задача на выход реакции: разбор задания 28 | ХИМИЯ ЕГЭ 2022Скачать  Реакция карбоната кальция и соляной кислотыСкачать  Получение ПЕРОКСИДА КАЛЬЦИЯ CaO2. Реакция ГИДРОКСИДА КАЛЬЦИЯ и ПЕРЕКИСИ ВОДОРОДА. Опыты по химииСкачать  Реакция при смешивании нитрата кальция и сульфата магнияСкачать  ON Fire. Все реакции в органике и неорганике при нагреванииСкачать  Органические цепочки с реального ЕГЭ | ЕГЭ ХИМИЯ 2022 | СОТКАСкачать  8 класс. Химия. Соли (получение фосфата кальция).Скачать  Топ-10 реакций, в которых ошибается большинство — Химия | SKILLVERSEСкачать  Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Получение алканов. Реакция Кольбе (механизм + сложные случаи). ЕГЭ по химии.Скачать 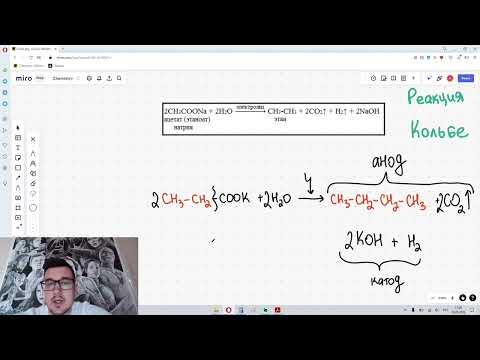 Классификация химических реакций. Вопрос №19 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать  Синтез гидроксида кальция и проведение с ним опыта! [ChemistryToday]Скачать ![Синтез гидроксида кальция и проведение с ним опыта! [ChemistryToday]](https://i.ytimg.com/vi/cYdGoQId95o/0.jpg) 11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Практическая работа №5. Получение углекислого газа, качественная реакция на карбонат ионыСкачать  Именные реакции и правила в органической химии.Скачать  Как решать Задание 15 ЕГЭ по химии?Скачать  Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать  |

