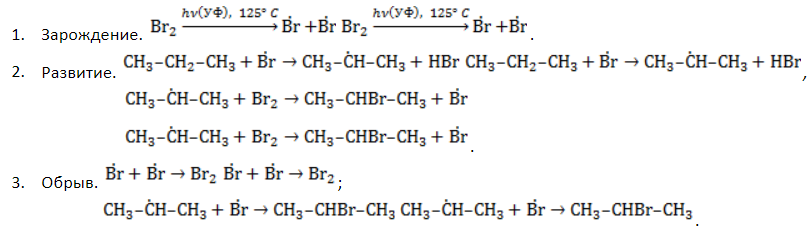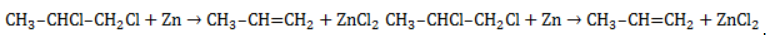Вы будете перенаправлены на Автор24
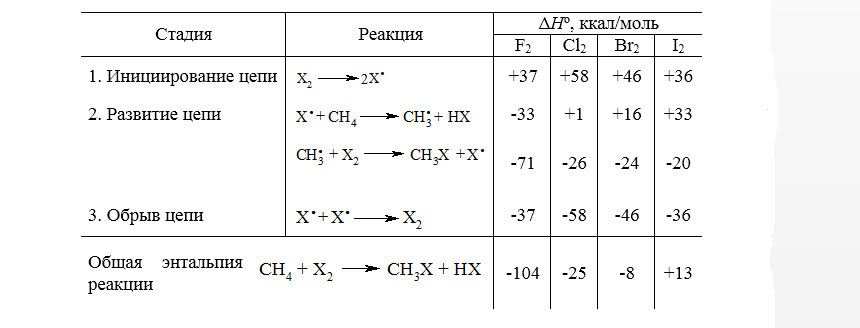
Радикальный механизм хлорирования метана, аналогичен и для реакций с остальными галогенами. Для всех галогенов это цепной радикальный процесс, который инициируется гомолизом молекул галогенов с образованием атомов галогена. Как и следовало ожидать, реакционная способность значительно уменьшается в ряду $F_2 > Cl_2 > Br_2 > I_2$. Энтальпии последовательных стадий галогенирования метана до $CH_3X$ приведены на рис.1
Рисунок 1. Энтальпии отдельных стадий галогенирования метана
Как видно по данным таблицы, относительные реакционные способности галогенов согласуются как с суммарными значениями $Delta H^circ$ всего процесса галогенирования в целом, так и со значениями $Delta H^circ$ для стадий развития цепи. Это обычный результат для радикальной реакции в газовой фазе.
- Бромирование метана
- Готовые работы на аналогичную тему
- Йодирование метана
- Фторирование метана
- Метан: способы получения и свойства
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Галогенирование алканов на примере пропана
- Краткая характеристика алканов
- Галогенирование алканов
- Стадии галогенирования
- Региоселективность
- Хлорирование и бромирование пропана
- Галогенирование бутана
- Реакция отщепления
- Применение галогеналканов
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

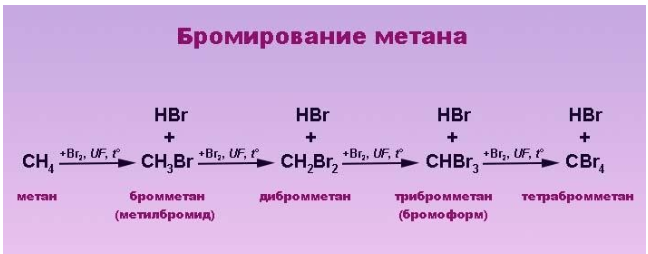
Бромирование метана
Бромирование по сумме всех стадий — экзотермический процесс, но уже для первой взаимодействия на стадии роста цепи необходимо предоставить примерно 59 кДж / моль (взаимодействие эндотермическая) в отличие от фторирования и хлорирования (рис. 1):
Рисунок 2. Бромирование, йодирование и фторирование метана
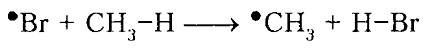
Энергия активации при этом равна примерно 75 кДж / моль. Поэтому только атомы брома с высокой энергией способны преодолеть высоту энергетического барьера и прореагировать с метаном.
Общая, при небольших температурах, скорость бромирования значительно меньше по сравнению с хлорированием (примерно в 250 000 раз). Однако реакция бромирования происходит с высокой селективностью.
Бромирование благодаря низкой среди галогенов экзотермичности ($Delta H- 29$ кДж / моль) и меньшей энергии свободного радикала брома происходит более селективно и дает почти чистые продукты. Известно, что селективность тем больше, чем меньше реакционная способность агента галогенирования.
Готовые работы на аналогичную тему
Легче галогенирования происходит в третичного атома углерода, затем — вюринного и, в конце, — первичного. Для Брома соотношение скоростей замещения в этих атомов 1600: 82: 1.
Высокую селективность бромирования связывают с медленным течением реакций, а также ее кинетическим контролем.
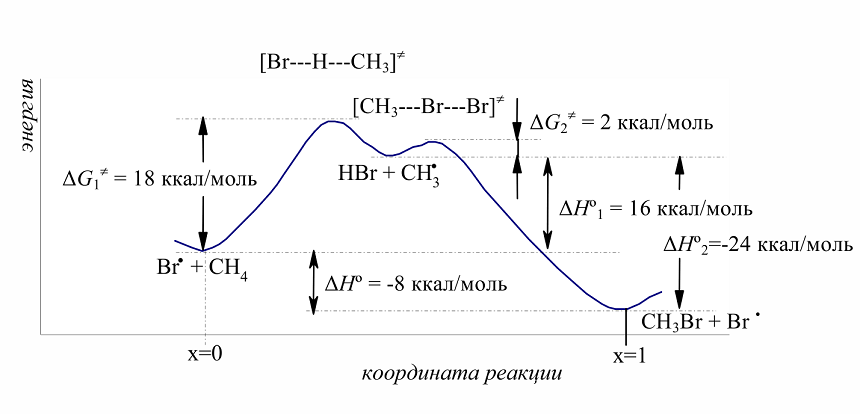
Бромирование метана происходит с меньшим выделением энергии, чем хлорирование. На первой стадии развития цепи наблюдается высокий эндотермический эффект: $Delta H^circ_1 = +16$ ккал/моль (при хлорировании $Delta H^circ_1 = +1$ ккал/моль). Это означает, что свободная энергия активации $Delta G_1^neq$ для первой стадии должна быть намного выше, чем для хлорирования. Действительно, $Delta G_1^neq$ для первой стадии развития цепи (18 ккал/моль; рис. 1) при бромировании намного превышает $Delta G_1^neq$ для хлорирования (4 ккал/моль). Тепловые эффекты второй стадии развития цепи при бромировании (- 24 ккал/моль) и при хлорировании (- 26 ккал/моль) весьма близки и энергия активации $Delta G_2^neq$ для обоих процессов тоже очень мало различаются. Значительно более высокое значение $Delta G_1^neq$ для бромирования указывает на то, что бромирование метана протекает с меньшей скоростью, чем хлорирование.
Рисунок 3. Энергетическая диаграмма свободнорадикального бромирования метана
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Йодирование метана
Йодирования алканов проходит с очень малой скоростью нуждается в дополнительной энергии (процесс эндотермический), а образованный $HI$ активно восстанавливает йодалкилы снова в алканы. Только применяя специальные йодирующие агенты, например трет-бутоксийодид полученный из йодида ртути $HgI_2$ действием тpeт-бутоксихлорида, возможно йодирование алканов с небольшими выходами.
Рисунок 4. Бромирование, йодирование и фторирование метана
Применяют также реакцию обмена хлора в хлоралкане йодом под действием йодида натрия NaI в ацетоновом растворе — реакция $X$. Финкельштайна, 1910 гг.:
Рисунок 5. Бромирование, йодирование и фторирование метана
Реакции Финкельштайна способствует большая растворимость NaИ в ацетоне сравнению с хлоридом натрия.
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Фторирование метана
Взаимодействие алкана непосредственно с фтором происходит со взрывом в результате значительного экзотермии (выделение теплоты). Так, при монофторировании метана для разрыва одной $C-H$-связи и связи $F-F$ необходимо потратить соответственно 425 и 160 кДж / моль (рис. 1):
$H_3C-H+F-F Longrightarrow H_3C-F+HF$, $triangle H=-437$
Одновременно с образованием новых связей $C-F$ и $H-F$ выделяется соответственно -452 и -570 кДж / моль. Суммарная теплота (экзотермии) реакции составляет $[-452 + (- 570)] — (160 + 425) = -437$ кДж / моль.
Для разрыва $C-C$-связи необходимо примерно 350 кДж / моль, поэтому непосредственное фторирование происходит со взрывом:
$CH_3-CH_2-CH_3+4F_2 longrightarrow 3C_<underline> + 8HF$
Во избежание сильной экзотермии фтор разводят жидким азотом или проводят реакцию в растворителе — полностью фторированных алканах:
$CH_3-CH_3+6F_2 longrightarrow CF_3 — CF_3 + 6HF$
Разбавления фтора азотом дает возможность добывать полифторпроизводные алканов с достаточно высоким выходом:
Рисунок 6. Бромирование, йодирование и фторирование метана
Направленое фторирование алканов без разрыва связей $C-C$ также проводят кобальт (III) фторидом или фтором, который выделяется при электролизе. Через слой $CoF_3$ пропускают газообразные алканы, при этом образуется перфторалканы и фторид кобальта (II):
Рисунок 7. Бромирование, йодирование и фторирование метана
Фторид кобальта (II) регенерируют, пропуская через через него ток фтора.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 16 09 2021
Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

Метан: способы получения и свойства
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Видео:Галогенирование алкановСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Хлорирование метанаСкачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Галогенирование метанаСкачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Видео:Видео №3. Как составить изомерыСкачать  Получение метанаВидео:Получение и изучение свойств метана. Опыт 1Скачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Занятие 1. ЕГЭ по химии. Органическая химияСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Номенклатура алканов. Учимся давать названия алканам.Скачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:Механизм реакции РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ у АЛКАНОВСкачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:Алканы. Химические свойства. Ч.1. Реакции радикального замещения.Скачать  Галогенирование алканов на примере пропанаГалогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода. Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Краткая характеристика алкановК простейшим органическим соединениям относятся ациклические насыщенные, или предельные углеводороды (алканы). Их отличают следующие структурные особенности:
Общая формула имеет вид Механизм замещения у алканов носит радикальный характер, так как разрыв слабополярной связи C-H протекает с образованием пары свободных радикалов – нейтральных частиц, имеющих по одному неспаренному электрону. Атом водорода может замещаться галогеном, нитрогруппой или сульфогруппой. Видео:1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать  Галогенирование алкановРеакция свободно-радикального замещения (обозначается символом SR – от англ. substitution radical reaction) водородного атома в молекуле алкана атомом галогена называется галогенированием. Ее инициирование требует воздействия ультрафиолетового облучения или повышенной температуры. Реакция носит цепной характер, так как в каждом ее акте образуются свободные радикалы, генерирующие следующий акт. Замещение фтором – фторирование – чрезвычайно экзотермический процесс, сопровождающийся взрывом и разрушением молекулы алкана. Реакция с участием йода, наоборот, является эндотермической и обратимой – в ходе ее происходит восстановление продукта реакции йодоводородом, поэтому прямое йодирование неэффективно. Практический интерес представляют реакции алканов с хлором и бромом. Стадии галогенированияУдобнее всего рассмотреть, какой механизм имеет реакция хлорирования алканов, на примере метана. При облучении или нагреве реакционной смеси реакция инициируется, и далее цепная реакция протекает в несколько стадий.
В общем виде уравнение галогенирования метана хлором записывается в форме: Процесс замещения не ограничивается образованием хлорметана, на молекулы которого также воздействуют радикалы Выход продуктов зависит от мольного соотношения реагентов и условий реакции. Так, при эквимолярном количестве метана и хлора и температуре 440° C соотношение молярных долей продуктов в процентах составляет около 39:41:19:1. Реакция бромирования отличается меньшим выделением энергии и протекает медленнее, так как его реакционная способность ниже, чем у хлора. РегиоселективностьНачиная с пропана Селективность зависит от следующих факторов:
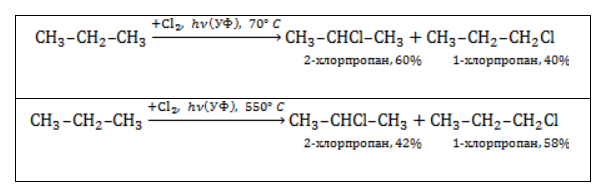
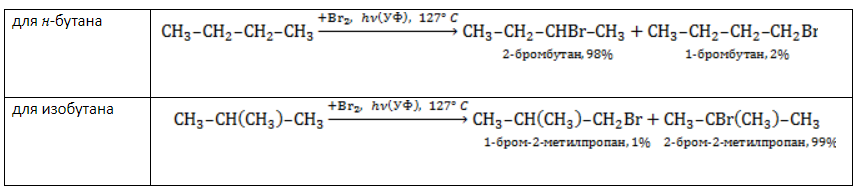
Хлорирование и бромирование пропанаВ реакции пропана с хлором при низкой температуре селективная направленность выражена слабо. Несмотря на то, что образующиеся в ходе реакции радикалы При нагревании радикалы хлора атакуют первичные атомы даже более активно, так как на разрыв их связи с водородом затрачивается меньше энергии. При бромировании пропана региоселективность вследствие меньшей активности брома достигает высоких значений: Бромирование протекает аналогично реакции с участием простейших алканов с преимущественным замещением водорода у вторичных атомов: Продуктом этой реакции является 2-бромпропан. Галогенирование бутанаВ реакциях бутана с хлором селективность не играет заметной роли. Даже при низкой температуре соотношение продуктов хлорирования может быть различным: Бромирование бутана демонстрирует большую селективность: Реакция отщепленияАктивные двухвалентные металлы (как правило, магний или цинк) отщепляют от молекул дигалогеналканов атомы хлора или брома, если они замещают водород у двух соседних атомов углерода. Между последними образуется двойная связь. Продуктом такой реакции является алкен. Пример реакции дегалогенирования алканов – отщепление цинком атомов хлора от 1,2-дихлорпропана с образованием пропилена (пропена) и хлорида цинка: Применение галогеналкановХлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием. Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов. |
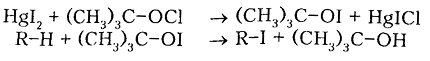
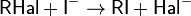
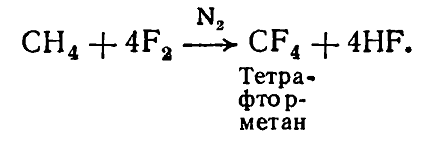
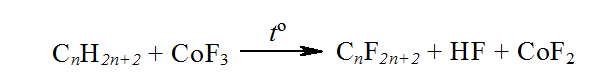
















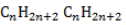 . Углеродная цепь в молекулах алканов характеризуется полным насыщением водородными атомами, вследствие чего эти соединения проявляют слабую химическую активность. Они вступают в реакции замещения, окисления, разложения и изомеризации.
. Углеродная цепь в молекулах алканов характеризуется полным насыщением водородными атомами, вследствие чего эти соединения проявляют слабую химическую активность. Они вступают в реакции замещения, окисления, разложения и изомеризации.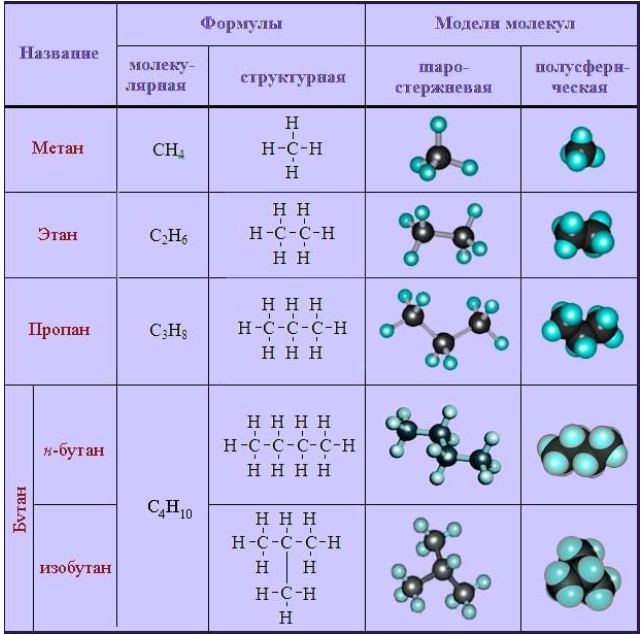


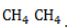 , радикал
, радикал  отщепляет от нее атом водорода с образованием метил-радикала
отщепляет от нее атом водорода с образованием метил-радикала  , который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию: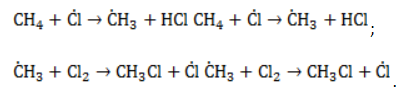

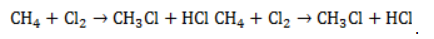
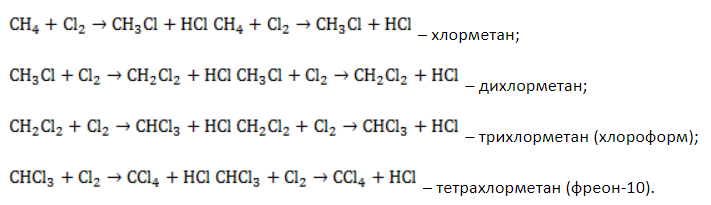
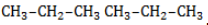 , в составе молекул алканов появляются вторичные атомы углерода, а с бутана, имеющего два изомера (н-бутан
, в составе молекул алканов появляются вторичные атомы углерода, а с бутана, имеющего два изомера (н-бутан 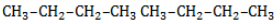 и изобутан
и изобутан 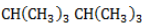 ), – третичные, связанные соответственно с двумя и тремя другими углеродными атомами. Скорость галогенирования у разных атомов различна и возрастает в ряду «первичный → вторичный → третичный». Это явление носит название регионаправленности галогенирования, или региоселективности. Четвертичные атомы не участвуют в реакции радикального замещения.
), – третичные, связанные соответственно с двумя и тремя другими углеродными атомами. Скорость галогенирования у разных атомов различна и возрастает в ряду «первичный → вторичный → третичный». Это явление носит название регионаправленности галогенирования, или региоселективности. Четвертичные атомы не участвуют в реакции радикального замещения.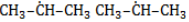 менее энергичны и, следовательно, более устойчивы, свободные атомы хлора чрезвычайно активны и воздействуют как на вторичные, так и на первичные атомы, особенно при высокой температуре.
менее энергичны и, следовательно, более устойчивы, свободные атомы хлора чрезвычайно активны и воздействуют как на вторичные, так и на первичные атомы, особенно при высокой температуре.