Репетитор по химии и биологии
Богунова В.Г.
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Хватит бояться ОВР! 9.6. Галерея классических окислителей. Перманганат
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня мы начинаем знакомиться с портретами известных окислителей, вернее, с продуктами их восстановления. Их нужно помнить, чтобы написать ОВР методом полуреакций. Не нужно нервничать. Точек продуктов восстановления окислителей очень мало (около 15). Остальное — технология написания окислительно-восстановительных реакций.
Вначале давайте вспомним, кто такие окислители и чем они отличаются от восстановителей?
1) Окислитель — атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
2) Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
3) Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (равна номеру группы).
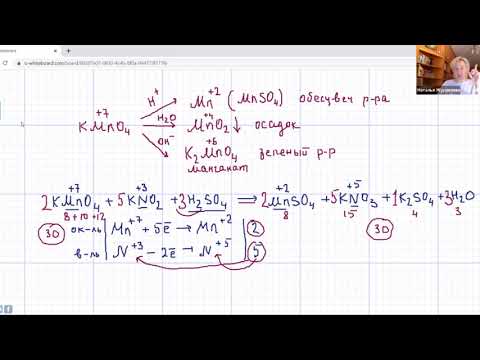
1) Перманганат калия KMnO4 — черное кристаллическое вещество, растворы которого имеют интенсивно фиолетовую окраску.
2) KMnO4 — очень сильный окислитель.
3) Степень восстановления атома Mn+7 зависит от рН среды
На схеме хорошо видно, чем выше кислотность среды, тем выше окислительные способности перманганат-иона MnO4 — . Это объясняется тем, что ионы Н + внедряются в анионы MnO4 — и ослабляют связь между атомами марганца и кислорода, деформируют анионы (за счет их поляризации) и облегчают, тем самым, действие восстановителя. Гидроксид-ионы в щелочной среде способствуют упрочнению связи между атомами марганца и кислорода Mn-О, поэтому перманганат-ион восстанавливается «совсем чуть-чуть».
Хотите научиться писать ОВР? Первое задание — выучить три точки продукта восстановления перманганат-иона (в разных средах).
Внимательно прочитайте примеры ОВР с участием перманганата калия в различных средах и попробуйте прописать их самостоятельно.
1) Перманганат в кислой среде
2) Перманганат в нейтральной среде
3) Перманганат в щелочной среде
На закуску дарю небольшую подборку вариантов 30-х заданий ЕГЭ с перманганатом калия. Попробуйте выполнить задания и написать ОВР методом полуреакций. Правильность написания ОВР можно проверить по готовым молекулярным уравнениям реакции.
Задание 30 (5 вариантов с решением)
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Допустимо использование водных растворов веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) перманганат калия, иодид калия, сульфат аммония, ацетат натрия, сульфат магния
2) бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия
3) перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия
4) нитрит калия, перманганат калия, нитрат натрия, хромат натрия, хлорид бария
5) перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова (II)
Ссылки на статьи, в которых очень подробно разобрана технология написания окислительно-восстановительных реакций:
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья ВК, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Пишите мне в WhatsApp +7(903)186-74-55
Приходите ко мне на занятия, я помогу вам изучить химию и биологию, научу решать любые задачи, даже самые сложные.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Перманганат калия в разных средах уравнения
— это реакции, протекающие с изменением степеней окисления элементов. В ходе таких реакций происходит отдача (отрыв) электронов от одного элемента и присоединение их к другому.
Важно запомнить следующие термины: окислитель, восстановитель, окисление, восстановление
Процесс отдачи электронов атомом называется окислением, при этом степень окисления этого элемента повышается (он — восстановитель)
Процесс присоединения электронов атомом называется восстановлением, при этом степень окисления этого элемента снижается (он — окислитель)
Восстановитель — это элемент, степень окисления которого повышается, т.е. он отдает электроны
Окислитель — это элемент, степень окисления которого снижается за счет присоединения электронов
Помним, что электрон заряжен отрицательно. Поэтому, когда атом отдает электроны, отрицательных частиц в нем становится меньше, чем положительных протонов, и его степень окисления повышается (он — восстановитель). И наоборот, если атом присоединяет к себе электроны, отрицательных частиц становится больше, чем положительных, соответственно, степень окисления снижается.
Восстановителями могут быть элементы в низших степенях окисления:
— простые вещества металлы,
— соединения неметаллов в низших степенях окисления (HCl, HBr, HI, H 2 S и их соли, NH 3 , PH 3, соли аммония )
Окислителями могут быть элементы в высших степенях окисления:
— KMnO4, K2CrO4, K2Cr2O7,
— H2SO4 (конц), HNO3 в любой концентрации, ее соли (KNO3, NaNO3), CO2
— простые вещества F2, О3
И окислителями и восстановителями могут быть элементы с промежуточной степенью окисления:
— простые вещества неметаллы H2, Cl2, Br2, I2, S, P, N2, C
— соединения металлов в промежуточной степени окисления (FeSO2, FeCl2, Cr2(SO4)3, MnO2, K2MnO4)
— H2O2, HClO3 и ее соли
Важно : нередко в реакциях один и тот же элемент может одновременно повысить и понизить степень окисления. Такие реакции называют реакциями диспрапорционирования
В ОВР часто в реакцию вступает третье вещество, которое не является ни окислителем, ни восстановителем. Такие вещества создают среду раствора. Она может быть кислой (за счет H2SO4), нейтральной (H2O), щелочной (KOH или NaOH). Среда раствора определяет по какому пути пойдет реакция
Соединения марганца
Марганец имеет несколько степеней окисления, наиболее характерными являются +2, +4, +6, +7.
В зависимости от с.о. соединения Mn будут проявлять различную окислительно-восстановительную способность:
Mn в с.о. 0 — это простое вещество, металл, степень окисления которого может только повышаться, значит Mn(0) — только восстановитель.
Mn в с.о. +6 — манганаты калия и натрия (K2MnO4, Na2MnO4) — так же являются как окислителями, так и восстановителями, их растворы имеют зеленоватый оттенок
Соли марганца (II)
Mn в с.о. +2 — обычно представляются в виде солей (хлоридов, сульфатов) и имеют бледно-розовый оттенок раствора. Преимущественно является восстановителем, но в некоторых реакциях может выступать как окислитель, например, при электролизе или реакциях замещения
Оксид марганца (IV) MnO2
Mn в с.о. +4 — только MnО 2 — амфотерный оксид, может быть как окислителем, так и восстановителем в зависимости от условий реакции (при наличии более сильного окислителя, он — восстановитель, при более сильном восстановителе, проявляется как окислитель)
MnO 2 + KBr + H 2 SO 4 = MnSO 4 + Br 2 + K 2 SO 4 + H2O ( MnO 2 — окислитель)
КBr не может быть окислителем, т.к. Br находится в низшей с.о. (-1)
MnO 2 + NaClO3 + NaOH = Na2MnO4 + NaCl + H2O ( MnO 2 — восстановитель)
Хлорат натрия NaClO3 — сильный окислитель, а значит MnO2 — будет восстановителем
Перманганат калия KMnO4
Mn в с.о. +7 — перманганаты калия и натрия (KMnO4, NaMnO4) — только окислители, т.к. марганец находится в высшей степени окисления, а значит повышать ее и быть восстановителем уже не может. Растворы перманганатов имеют ярко малиновый окрас
KMnO4 — сильный окислитель, реагирует как с неорганическими веществами, так и с органическими (спиртами, альдегидами, непредельными углеводородами).
В зависимости от среды, в реакциях будут образовываться различные продукты восстановления Mn:
— в кислой среде образуются соли Mn (+2), например MnCl2, MnSO4
— в нейтральной среде выпадает осадок MnO2 бурого цвета
— в щелочной среде образуется манганат K2MnO4? где Mn (+6)
FeSO4 + KMnO4 + H2SO4 = Fe2(SO4) + MnSO4 + K2SO4 + H2O
KMnO4 + KNO2 + H2O = KNO3 + MnO2 + KOH
Cr2(SO4)3 + KMnO4 + KOH = K2CrO4 + K2MnO4 + K2SO4 + H2O
Соединения хрома
Хром имеет несколько степеней окисления, наиболее характерны из которых +3 и +6.
Соединения Cr (+2) не стабильны, легко окисляются до +3, являясь сильнейшими восстановителями
Соединения хрома (III)
Cr в с.о. +3 представляются в виде солей (сульфата, нитрата или хлорида) и гидроксида. Т.к. хром в этих соединениях находится в промежуточной степени окисления, то он может выступать в роли и окислителя и восстановителя, хотя ОВР, где Cr (+3) — окислитель в практике ЕГЭ редки.
Цвета растворимых солей располагаются в лилово-зеленой гамме в зависимости от формулы и температуры. Гидроксид хрома (III) имеет грязно-зеленый оттенок.
При взаимодействии Cr (+3) с сильными окислителями, он окисляется до Cr (+6), т.е. до хромата или бихромата (зависит от кислотности среды):
— в кислой среде образуется оранжевый бихромат (К2Cr2О7)
— в щелочной среде — желтый хромат (К2CrО4)
Хроматы и бихроматы
Cr в с.о. +6 представлен двумя группами веществ — хроматами и бихроматами (или дихроматами, разницы нет). Они являются сильными окислителями, восстанавливаясь до Cr (+3).
Ядовиты. Редко вступают в реакции ионного обмена. Так, хроматы могут реагировать с солями бария и серебра образуя желтый осадок хромата бария и кроваво-красный осадок хромата серебра.
К2 Cr2О7 — бихромат калия — вещество оранжевого цвета, стабильно в нейтральной и кислой среде.
K2 CrO4 — хромат калия — вещество желтого цвета, стабильно в нейтральной и щелочной среде.
При добавлении щелочи к раствору бихромата, он окрашивается в желтый цвет — бихромат превращается в хромат. И наоборот, при добавлении кислоты в желтый раствор хромата, окраска изменятся на оранжевый.
Видео:ОВР с перманганатом калия.Скачать
Примеры ОВР соединений марганца
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
ОВР соединений марганца
Рассмотрим окислительно – восстановительные свойства соединений марганца, проявляемые ими в разных условиях (в кислотной, нейтральной или щелочной). При проведении ОВР для создания в растворе кислотной среды обычно используют серную кислоту . Азотную кислоту используют крайне редко, так как она сама является сильным окислителем; соляную, бромоводородную и йодоводородную кислоты не используют из-за их способности к окислению. Щелочная среда создается добавлением в раствор гидроксидов натрия или калия.
Перманганат калия К MnO 4 всегда является окислителем. Продукты восстановления зависят от характера среды:
Условия протекания окислительно-восстановительных превращений для соединений марганца можно представить в виде схемы, приведенной на рисунке 2.
Как видно из приведенной на этом рисунке схемы, перманганат-ион, входящий в состав самого популярного в лабораторной практике окислителя, KMnO 4 , в различных средах восстанавливается по-разному. В наибольшей степени окислительные свойства перманганат калия проявляет в кислотной среде, в несколько меньшей – в нейтральной и в наименьшей степени – в щелочной.
Рассмотрим эти случаи на конкретных примерах.
Пример 1. Составьте уравнение реакции, протекающей при пропускании оксида серы ( IV ) через подкисленный серной кислотой раствор перманганата калия.
Для составления уравнения воспользуемся методом электронного баланса.
При составлении уравнений ОВР наличием в растворе гидросульфатных ионов обычно пренебрегают. (Наличием ионов HSO 4 — нельзя пренебрегать при составлении уравнений ОВР типа взаимодействия концентрированной H 2 SO 4 с NaBr (среди прочего образуется NaHSO 4 ), но уравнения этих реакций составляют, используя метод электронного балланса.)
2. После умножения каждого из уравнений полуреакций на соответствующие множители, сложения уравнений и приведения подобных членов получаем ионное уравнение.
2MnO 4 — + 16 Н + + 5SO 2 + 10H 2 O = 2Mn 2+ + 5SO 4 2- + 20 H + + 8H 2 O
3. Добавив в левой части уравнения необходимое количество противоионов и не забывая о них при написании формул продуктов реакции, запишем молекулярное уравнение:
Из уравнения видно, что серная кислота, которая по смыслу задания должна была вступить в реакцию, в действительности в реакцию не вступает, а, наоборот, в процессе реакции выделяется, то есть добавлена в раствор только как средообразователь . Но это скорее исключение, чем правило. Убедимся в этом на другом примере.
Пример 2. Составьте уравнение реакции, протекающей при сливании раствора перманганата калия с раствором аммиака.
1 . Аммиак – слабое основание, поэтому среда в его водном растворе слабощелочная. Перманганат-ион в этих условиях при восстановлении превращается в диоксид марганца, выпадающий из раствора в виде бурого осадка. В нейтральной и щелочной среде очень мало ионов оксония, поэтому для связывания «лишних» атомов кислорода могут быть использованы лишь молекулы воды. Каждая молекула воды, присоединяя один атом кислорода, превращается в два гидроксид-иона. Аммиак в этих условиях окисляется до азота (ближайшая устойчивая степень окисления – ноль).
2. Ионное уравнение:
2MnO 4 — + 10H 2 O + 2NH 3 = 2MnO 2 + 8OH — + N 2 
3. Так как в одной из полуреакций образуются гидроксид-ионы, а в другой – ионы водорода, что вполне допустимо в нейтральной (или близкой к ней) среде, перед приведением подобных членов в ионном уравнении необходимо учесть, что эти ионы одновременно в водном растворе существовать не могут (пройдет реакция нейтрализации).
После приведения подобных членов получаем ионное уравнение:
2MnO 4 — + 2NH 3 = 2MnO 2 + 2OH — + N 2 
4. Запишем молекулярное уравнение:
2 KMnO 4 + 2 NH 3 = 2 MnO 2 + 2 KOH + N 2 
Пример 3. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита калия в присутствии гидроксида калия.
Пример 4. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия в присутствии серной кислоты.
Пример 5. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия.
🌟 Видео
Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Окисление органических соединений перманганатом калияСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Окисление перманганатом калия в различных средахСкачать

Решение ОВР методом полуреакцийСкачать

Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Перманганат калия: химические свойства, качественные реакции, ОВР в органике и неорганикеСкачать

Влияние рН среды на окислительную активность перманганат-ионаСкачать

Опыты по химии. Взаимодействие перманганата калия с сульфитом натрия в различных средахСкачать

Все ОВР с дихроматом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Перманганат калия разложениеСкачать

ОВР в органических реакциях на примере окисления алкенов растворами перманганата калияСкачать

ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать






m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)


_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)













