В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- Жесткое окисление алкенов. Как записать уравнение?
- Жесткое окисление алкенов в кислой среде
- Пропен + KMnO4 +H2SO4
- 2-метилпропен + KMnO4 + H2SO4
- Пропен + K2Cr2O7 + H2SO4
- 2-метилпропен + K2Cr2O7 + H2SO4
- Перманганат калия в кислой среде уравнение реакции
- 🎦 Видео
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:ОВР с перманганатом калия.Скачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Окисление органических соединений перманганатом калияСкачать

Мягкое окисление
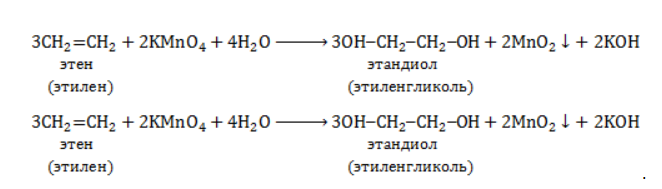
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 
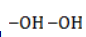
- кислород из перманганат-иона;
- вода.
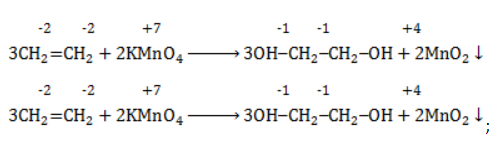
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
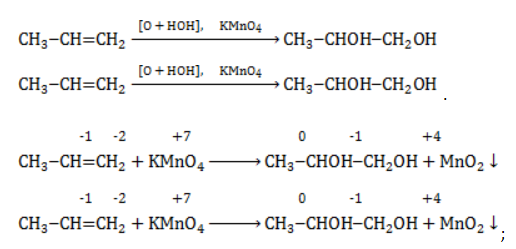
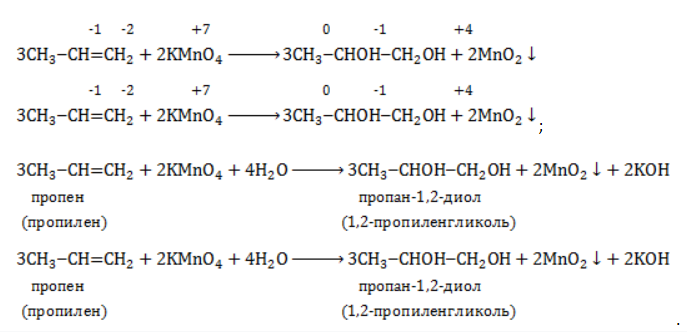
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 
Видео:Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
Окисление перманганатом калия в кислой среде
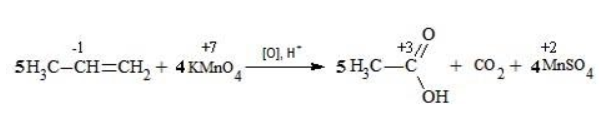
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
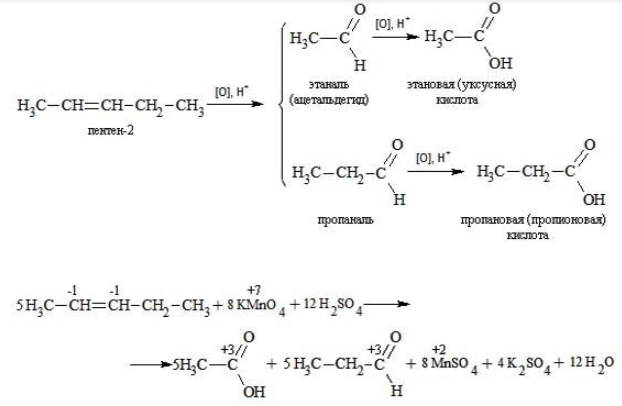
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
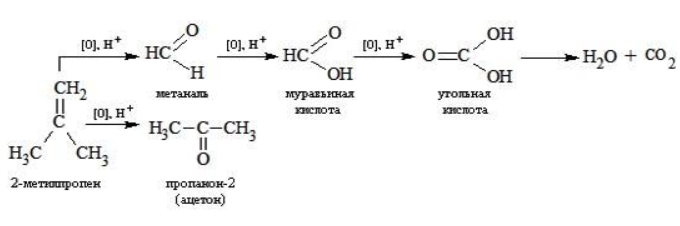
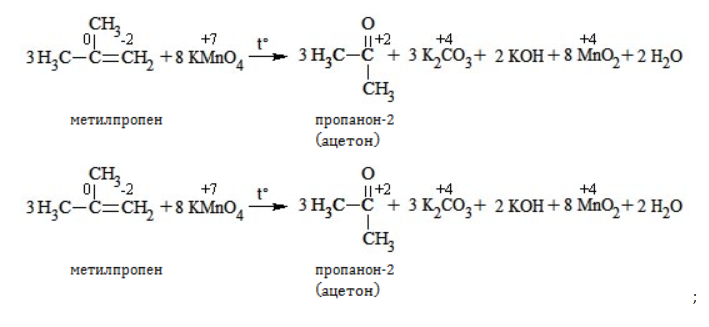
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:Окисление алкенов перманганатом калия (марганцовкой) в кислой средеСкачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

Жесткое окисление алкенов. Как записать уравнение?
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Жесткое окисление алкенов в кислой среде
Данный процесс чаще всего осуществляют, действуя на алкены подкисленным раствором перманганата калия, либо дихромата калия. В качестве средообразователя всегда используют серную кислоту. При таком окислении происходит полный разрыв углеродного скелета по двойной связи, и в зависимости от особенностей строения продуктами окисления могут быть различные вещества.
Давайте сначала разберемся с тем, какие углеродсодержащие продукты образуются при жестком окислении алкенов с различным строением. Представим, что у нас стоит задача определить продукты окисления для следующих двух веществ:
Обратите внимание, что углеродные атомы при двойной связи обозначены разными цветами.
Атом углерода, выделенный красным цветом, является первичным, то есть связан только с одним другим атомом углерода.
Атом углерода, выделенный желтым цветом, является вторичным, то есть связан с двумя другими атомами углерода.
Атом углерода, выделенный зеленым цветом, является третичным, то есть связан с тремя другими атомами углерода.
Жесткое окисление подразумевает разрыв углеродного скелета по месту двойной связи:
Следует запомнить, что первичные атомы углерода (красные) при таком окислении переходят в углекислый газ.
Вторичные атомы углерода (желтые) переходят в состав карбоксильной группы (COOH), то есть образуется карбоновая кислота.
Третичные атомы углерода(зеленые) переходят в состав карбонильной группы, то есть образуется кетон.
Теперь осталось разобраться с остальными продуктами реакции. Если в качестве окислителя используется сернокислый раствор перманганата калия, то продуктами будут также MnSO4, K2SO4 и H2O. Если же в качестве окислителя взяли сернокислый раствор дихромата калия, продуктами будут Cr2(SO4)3, K2SO4 и H2O.
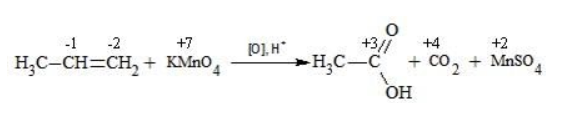
Давайте разберем все эти случаи. Начнем с реакции пропена с сернокислым раствором перманганата калия.
Пропен + KMnO4 +H2SO4
Исходя из вышесказанного, запишем схему этой реакции:
Осталось расставить коэффициенты. Определим, какие атомы изменили степени окисления. В случае марганца ничего сложного нет: степень окисления его в перманганате была +7, стала равна +2. Также степени окисления меняют те атомы углерода, у которых изменилось окружение. В схеме эти атомы обозначены желтым и красным цветами. Определим степени окисления этих атомов методом блоков. Изолируем друг от друга фрагменты молекулы по углерод-углеродным связям следующим образом:
Далее, условно примем, что заряд каждого выделенного блока равен нулю (как у нейтральной молекулы). Степень окисления водорода в органических веществах всегда равна +1. Обозначим степени окисления «желтого» атома С как х, «красного» — как y:
Далее, учитывая, что заряд каждого блока мы приняли равным нулю, мы можем составить и решить два уравнения:
Аналогично рассчитаем степень окисления «желтого» атома углерода в уксусной кислоте и «красного» в молекуле углекислого газа, учитывая, что степень окисления кислорода в органических веществах всегда равна -2 (кроме органических пероксидов, изучение которых в не входит в программу ЕГЭ):
Далее, аналогично, составим и решим два уравнения, учитывая, что заряд выделенного блока мы приняли равным нулю, а заряд молекулы углекислого газа, как и у любой другой молекулы, также нейтрален.
Таким образом, «желтый» атом углерода имел степень окисления до реакции, равную -1, а после +3.
«Красный» атом углерода изменил свою степень окисления с -2, на +4.
Учитывая, что марганец изменил свою степень окисления с +7 на +2, еще раз запишем схему реакции и составим электронный баланс. «Желтый» и «красный» атомы углерода, очевидно, всегда будут в соотношении 1 к 1, независимо от коэффициента перед органическим веществом, потому запишем их в одной строчке «полуреакции» окисления.
Перенесем коэффициенты из баланса:
Поскольку в левой части схемы мы видим два атома калия, в правой части схемы перед сульфатом калия коэффициент 1, ставить который не нужно. В правой части уравнения мы видим 3 сульфатных остатка, поэтому ставим перед серной кислотой коэффициент 3:
Осталось поставить коэффициент перед водой в правой части. Это можно сделать по кислороду или водороду на выбор. Поскольку мы уравняли число сульфатных остатков в левой и правой частях, то кислород в них можно не учитывать. Считаем только кислород в остальных соединениях. Слева мы видим 8 атомов кислорода (не считая кислород в серной кислоте). В правой части не считая воду — 4 атома кислорода. Поэтому перед водой коэффициент будет равен 4:
Сравнивая количества всех элементов слева и справа, видим, что все коэффициенты расставлены верно.
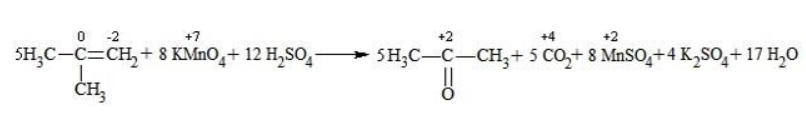
2-метилпропен + KMnO4 + H2SO4
Аналогично предыдущему примеру рассчитаем степени окисления углеродных атомов, которые изменили свою степень окисления:
Учитывая, что заряд каждого выделенного блока мы приняли равным нулю, составим и решим уравнения:
Аналогично поступим с продуктами окисления:
составим и решим уравнения:
Таким образом, «зеленый» атом углерода до реакции имел степень окисления, равную 0, после +2, «красный» изменил свою степень окисления с -2 на +4.
Далее запишем схему окисления и составим электронный баланс:
Перенесем коэффициенты из электронного баланса в схему:
Далее мы видим, что в левой части схемы 8 атомов калия, потому перед сульфатом калия поставим коэффициент 4.
Теперь можно заметить, что в правой части уравнения 12 сульфатных групп (8 в сульфате марганца, 4 в сульфате калия). Поэтому перед серной кислотой в левой части нужно поставить коэффициент 12:
Осталось поставить коэффициент перед водой. Сделаем это по кислороду. Количество сульфатных групп мы уравняли, потому кислород в них можно не учитывать. Слева мы видим 32 атома кислорода (8*4). В правой части уравнения, не считая воды и сульфатных групп, 15 атомов кислорода (5 в молекуле кетона и 10 в 5 молекулах углекислого газа). Таким образом, перед водой необходимо поставить коэффициент 17.
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
Пропен + K2Cr2O7 + H2SO4
Состав продуктов будет точно таким же, как и в случае окисления перманганатом, за исключением того, что вместо сульфата марганца (II) образуется сульфат хрома (III). Запишем схему реакции и составим электронный баланс.
Перенесем коэффициенты из баланса в схему:
Далее уравняем калий, поставив коэффициент 5 перед сульфатом калия:
В правой части мы видим 20 сульфатных групп. Следовательно, перед формулой серной кислоты нужно поставить коэффициент 20:
Осталось поставить последний коэффициент перед формулой воды. Сделаем это, как и в двух предыдущих случаях, по кислороду, не считая кислород в сульфатных группах, поскольку их количества уравнены. В левой части мы видим 35 атомов кислорода. В правой части, не считая воды, 12 атомов кислорода (6 в трех молекулах CH3COOH и 6 в трех молекулах CO2). Таким образом, перед формулой воды нужно поставить коэффициент 23:
Посчитав водород слева и справа, мы убеждаемся, что коэффициенты расставлены верно.
2-метилпропен + K2Cr2O7 + H2SO4
Запишем схему реакции и электронный баланс:
Перенесем коэффициенты из баланса в схему:
Перед сульфатом калия поставим коэффициент 4, чтобы уравнять количества атомов калия в левой и правой частях схемы:
Перед серной кислотой поставим коэффициент 16, чтобы уравнять количество сульфатных групп:
Последний коэффициент перед водой поставим по кислороду, игнорируя сульфатные группы, поскольку их количество уравнено. Слева мы видим 28 атомов кислорода. Справа, не считая воды, 9 атомов кислорода. Таким образом, перед водой необходимо поставить коэффициент 19.
Далее, подсчитав водород в обеих частях уравнения, убеждаемся, что коэффициенты расставлены верно.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Перманганат калия в кислой среде уравнение реакции
Репетитор по химии и биологии
Богунова В.Г.
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Хватит бояться ОВР! 9.6. Галерея классических окислителей. Перманганат
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня мы начинаем знакомиться с портретами известных окислителей, вернее, с продуктами их восстановления. Их нужно помнить, чтобы написать ОВР методом полуреакций. Не нужно нервничать. Точек продуктов восстановления окислителей очень мало (около 15). Остальное — технология написания окислительно-восстановительных реакций.
Вначале давайте вспомним, кто такие окислители и чем они отличаются от восстановителей?
1) Окислитель — атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
2) Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
3) Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (равна номеру группы).
1) Перманганат калия KMnO4 — черное кристаллическое вещество, растворы которого имеют интенсивно фиолетовую окраску.
2) KMnO4 — очень сильный окислитель.
3) Степень восстановления атома Mn+7 зависит от рН среды
На схеме хорошо видно, чем выше кислотность среды, тем выше окислительные способности перманганат-иона MnO4 — . Это объясняется тем, что ионы Н + внедряются в анионы MnO4 — и ослабляют связь между атомами марганца и кислорода, деформируют анионы (за счет их поляризации) и облегчают, тем самым, действие восстановителя. Гидроксид-ионы в щелочной среде способствуют упрочнению связи между атомами марганца и кислорода Mn-О, поэтому перманганат-ион восстанавливается «совсем чуть-чуть».
Хотите научиться писать ОВР? Первое задание — выучить три точки продукта восстановления перманганат-иона (в разных средах).
Внимательно прочитайте примеры ОВР с участием перманганата калия в различных средах и попробуйте прописать их самостоятельно.
1) Перманганат в кислой среде
2) Перманганат в нейтральной среде
3) Перманганат в щелочной среде
На закуску дарю небольшую подборку вариантов 30-х заданий ЕГЭ с перманганатом калия. Попробуйте выполнить задания и написать ОВР методом полуреакций. Правильность написания ОВР можно проверить по готовым молекулярным уравнениям реакции.
Задание 30 (5 вариантов с решением)
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Допустимо использование водных растворов веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) перманганат калия, иодид калия, сульфат аммония, ацетат натрия, сульфат магния
2) бром, нитрат бария, сульфат аммония, концентрированная соляная кислота, перманганат калия
3) перманганат калия, фосфин, серная кислота, нитрат лития, гидроксид алюминия
4) нитрит калия, перманганат калия, нитрат натрия, хромат натрия, хлорид бария
5) перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова (II)
Ссылки на статьи, в которых очень подробно разобрана технология написания окислительно-восстановительных реакций:
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья ВК, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Пишите мне в WhatsApp +7(903)186-74-55
Приходите ко мне на занятия, я помогу вам изучить химию и биологию, научу решать любые задачи, даже самые сложные.
🎦 Видео
Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

10 класс (профиль).Ч.2.Окисление алкенов раствором марганцовки в кислой среде.Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Уравнивание реакции взаимодействия алкенов с перманганатом калия в кислой средеСкачать

Перманганат калия: химические свойства, качественные реакции, ОВР в органике и неорганикеСкачать

Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Реакция этилена с раствором перманганата калияСкачать

Как расставить коэффициенты в органических ОВР? | Екатерина СтрогановаСкачать

Окисление алкенов с Тасей | Химия ЕГЭСкачать

Перманганат калия разложениеСкачать



 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей 



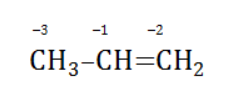

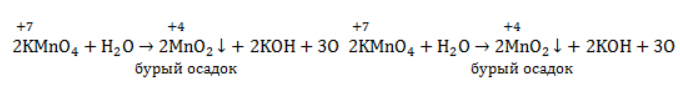
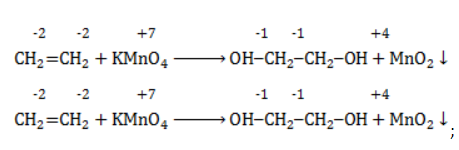

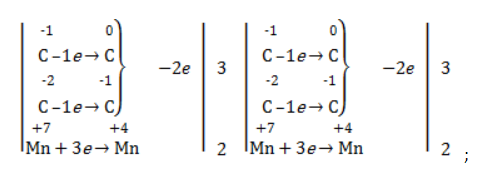

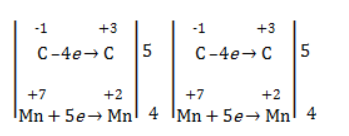


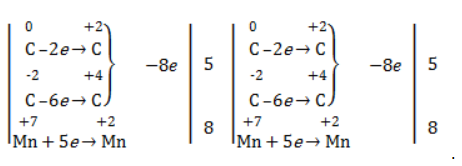

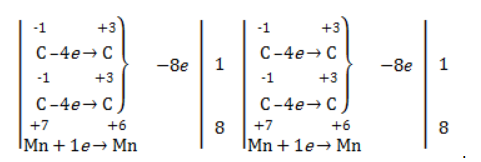


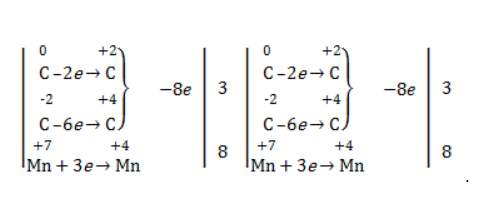





m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)


_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)