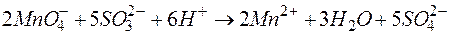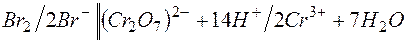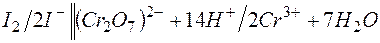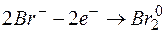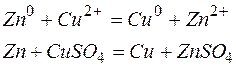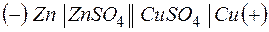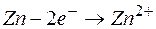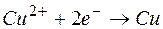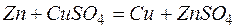Решение. KMnO4 и Na2SO3 – сильные электролиты, поэтому в растворе они практически полностью диссоциируют на ионы. Окисляющим началом является анион MnO4 – , в котором марганец находится в степени окисления +7. В то же время у серы в сульфит-анионе имеется ресурс окисления до сульфат-аниона, поэтому он является восстановителем. Известно, что в кислой среде перманганат-анион восстанавливается до Mn 2+ . Поэтому уравнения полуреакций записываются в виде:
| 2 | MnO4 – + 8Н + + 5е  Mn 2+ + 4 Н2О Mn 2+ + 4 Н2О | восстановление, окислитель KMnO4 |
| 5 | SО3 2– + Н2О – 2е  SО4 2– + 2Н + SО4 2– + 2Н + | окисление, восстановитель Na2SO3 |
2MnO4 – + 16Н + + 5SО3 2– +5Н2О 
Можно видеть, как пара Н + – Н2О осуществляет перераспределение кислорода между реагентами и продуктами реакции.
Коэффициенты перед строками уравнений полуреакций отражают требования электронного баланса: количество электронов, принятых окислителем должно быть равно количеству электронов, отданных восстановителем. Суммирование левых и правых частей уравнений реакций с учетом умножения их на указанные коэффициенты дает уравнение окислительно-восстановительной реакции в ионно-молекулярной форме, приведенное под чертой. Сокращение подобных членов в этом уравнении приводит к более компактной его форме
Переход к молекулярной форме приводит к окончательному виду уравнения: 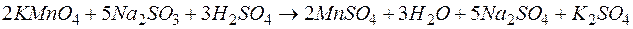
Пример 3. Составление уравнений окислительно-восстановительных реакций, протекающих в нейтральной среде.
Задача 1. Составьте уравнение окислительно-восстановительной реакции между сульфатом марганца(II) и перманганатом калия.
Решение. Продуктомэтой реакции является MnO2, следовательно, в роли окислителя выступает анион 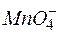
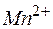
| 2 | MnO4 – + 2Н2О + 3е  MnО2 + 4ОН – MnО2 + 4ОН – | восстановление, окислитель MnO4 – |
| 3 | Mn 2+ + 2Н2О – 2е  MnО2 + 4Н + MnО2 + 4Н + | окисление, восстановитель Mn 2+ |
2MnO4 – + 10Н2О + 3Mn 2+ 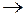
Суммирование левых и правых частей уравнений полуреакций с учетом умножения их строк на приведенные коэффициенты дает ионно-молекулярное уравнение, представленное под чертой. С учетом того, что рекомбинация 8Н + и 8ОН – в правой части этого уравнения дает 8 молекул воды, сокращаем воду в левой и правой частях и получаем уравнение
2MnO4 – + 2Н2О + 3Mn 2+ 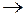
Переход к молекулярной форме приводит к окончательному виду уравнения:
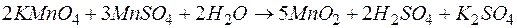
Пример 4. Составление уравнений окислительно-восстановительных реакций с участием органических соединений.
Задача 1. Составьте уравнение реакции окисления этилбензола перманганатом калия в нейтральной среде.
Решение. Роль окислителя в этой реакции выполняет перманганат-анион, а восстановителя – этилбензол, 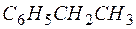
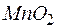
| 4 | MnO4 – + 2Н2О + 3е 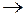 MnО2 + 4ОН – MnО2 + 4ОН – | восстановление, окислитель MnO4 – |
| 1 | 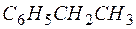 + 4Н2О – 12е + 4Н2О – 12е 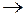 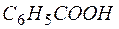 + + 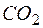 + 12Н + + 12Н + | окисление, восстановитель 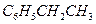 |
4MnO4 – + 12Н2О + 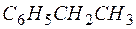
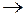
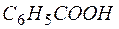
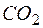
Сокращая воду в левой и правой частях полученного уравнения и учитывая взаимодействия
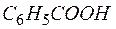
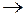
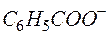
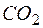
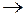
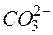
приходим к уравнению
4MnO4 – + 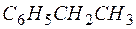
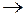
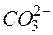
Переходим к молекулярной форме уравнения:
4КМnO4 + 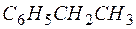
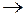
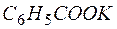
Пример 5.Определение окислительно-восстановительных молярных масс эквивалентов.
Задача 1. Чему равен эквивалент окислителя в реакции 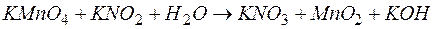
Решение. Молярная масса эквивалента окислителя (восстановителя) равна его молярной массе, деленной на число принятых (или отданных) электронов. В приведенной реакции окислителем является 
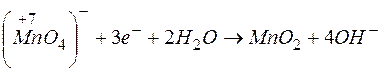
Следовательно, молярная масса эквивалента окислителя равна
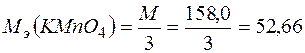
Пример 6.Определение направления окислительно-восстановительной реакции по величине окислительно-восстановительных потенциалов (Red-Ox-потенциалов).
Задача 1. Возможно ли в качестве окислителя в кислой среде использовать 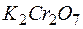
а) 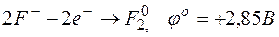
б) 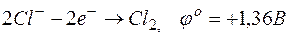
в)
г) 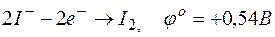
Стандартный окислительно-восстановительный потенциал системы
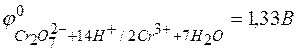
Решение. Для определения направления окислительно-восстановительной реакции необходимо определить ЭДС ( 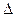
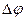
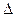
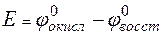
где 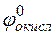
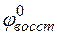
Реакция возможна, если 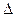
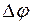
Для выяснения возможности протекания окислительно-восстановительных реакций определяем ЭДС следующих систем:
а)
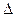
б)
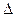
в)
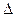
г)
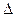
Таким образом, дихромат калия 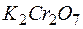
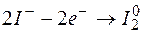
Пример 7. Определение возможности протекания окислительно-восстановительной реакции по величине изменения энергии Гиббса (изобарно-изотермического потенциала).
Задача 1.Определите возможность протекания окислительно-восстановительной реакции
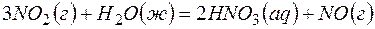
если стандартные значения энергии Гиббса равны:
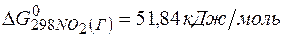
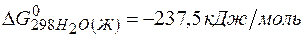
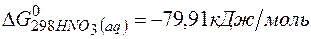
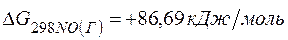
Решение.Определяем 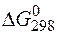
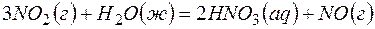
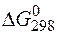
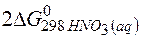
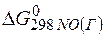
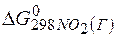
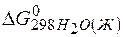
=2(-79,91) + 86,69 – 3(51,84) – (-237,5)=8,65кДж.
Так как 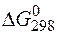
1.8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимическими процессами называют процессы взаимного превращения химической и электрической форм энергии.
Электрохимические процессы можно разделить на две основные группы:
1)процессы превращения химической энергии в электрическую (в гальванических элементах);
2) процессы превращения электрической энергии в химическую (электролиз).
Простейшая электрохимическая система состоит из двух электродов, соединенных друг с другом металлическим проводником (внешней цепи) и ионного проводника между ними (растворы или расплавы электролитов).
1.8.1. Гальванические элементы
При окислительно-восстановительных реакциях происходит переход электронов от восстановителя к окислителю. Эту реакцию можно проводить таким образом, чтобы процессы окисления и восстановления были пространственно разделены, а электроны перемещались от восстановителя к окислителю по внешней цепи.
Устройства, при помощи которых химическая энергия превращается в электрическую, называются гальваническими элементами, или химическими источниками электрической энергии.
Одним из первых гальванических элементов был сконструирован гальванический элемент Якоби-Даниэльса. Это устройство состоит из двух электродов — металлических пластин (цинковой и медной), помещённых в раствор электролитов (солей цинка и меди), разделенных пористой перегородкой, и соединённых проводником.
Электрод, на котором протекает процесс окисления, называется анодом.
Электрод, на котором протекает процесс восстановления, называется катодом.
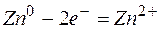
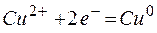
Используют специальную форму записи гальванического элемента, в которой указывают анод, поверхность раздела, первый электролит, электролитический ключ, второй электролит, катод и направление движения электронов во внешней цепи:
Т.о., цинковая пластина начинает растворяться, а на медной пластине начинает осаждаться медь, пока равновесие не восстановится.
Электрический ток, протекающий по внешней цепи, может совершать полезную работу, которая равна произведению количества прошедшего электричества на напряжение:
где: n – число электронов, участвующих в окислительно-восстановительном процессе;
F – число Фарадея (F = 96500 Кл/моль);
DE – электродвижущая сила гальванического элемента (ЭДС).
В то же время максимальная полезная работа равна изменению свободной энергии Гиббса реакции: Amax = — ∆G.
Работа гальванического элемента процесс самопроизвольный (∆G n+ + ne
| — — — Металл — — — — | + + + + + + + + + + Раствор + + + + |
| Рис.1 Строение двойного электрического слоя на границе раздела металл-раствор |
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла, в результате чего на границе металл–раствор возникает двойной электрический слой (рис.1). Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом.
Наряду с окислением металла протекает обратная реакция – восстановления ионов металла до атомов. При некотором значении электродного потенциала, который называется равновесным электродным потенциалом, устанавливается равновесие
М + m H2O 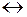
или без учета гидратационной воды: М 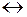
Дата добавления: 2014-12-05 ; просмотров: 6900 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Опыты по химии. Взаимодействие перманганата калия с сульфитом натрия в различных средахСкачать

Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Видео:перманганат калия + сульфид натрия в ЩЕЛОЧНОЙ средеСкачать

Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
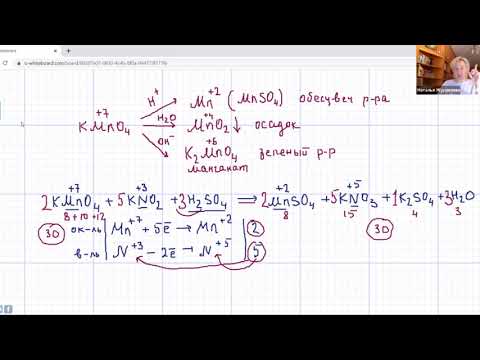
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Видео:СУЛЬФИД НАТРИЯ, СЕРОВОДОРОД и многое другое!Скачать

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Видео:Реакция Между Перманганатом Калия, Сульфатом Марганца и Серной Кислотой. Сульфат Марганца(4).Скачать

Составить уравнения: Сульфит натрия + перманганат калия + серная кислота =
Видео:ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать

Ваш ответ
Видео:Реакция СУЛЬФИТА НАТРИЯ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Простые опыты по химии.Скачать

решение вопроса
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
🎬 Видео
Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Реакция Соляной Кислоты, Дихромата Аммония и Сульфита Натрия. Реакция HCl, (NH4)2Cr2O7 и Na2SO3.Скачать

Сульфит натрия. Сильный восстановитель.Скачать

Химическая реакция йода и алюминия.Скачать

ОВР с перманганатом калия.Скачать
Опасно для здоровья! ⚠️ Опыты с серной кислотойСкачать

ОБЕСЦВЕЧИВАНИЕ РАСТВОРА. Реакция Перманганата Калия, Серной Кислоты И Перекись Водорода.Скачать

Реакция Йодида Калия, Перманганата Калия и Серной Кислоты. Выпадение Йода. Реакция KI, KMnO4 и H2SO4Скачать

Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать

Взаимодействие перманганата калия с сульфатом железа (||) и серной кислотойСкачать

Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

Окисление органических соединений перманганатом калияСкачать

Перманганат калия разложениеСкачать