Окислительно-восстановительные процессы лежат в основе важнейших явлений живой и неживой природы: горения, разложения сложных веществ, синтеза органических соединений. Перманганат калия, свойства которого мы изучим в нашей статье, относится к наиболее сильным окислителям, применяемым в лабораторных и промышленных условиях. Его окислительные способности зависят от степени окисления атома, которая меняется в ходе реакции. Рассмотрим это на конкретных примерах химических процессов, происходящих с участием молекул KMnO4.
Видео:Окисление органических соединений перманганатом калияСкачать

Характеристика вещества
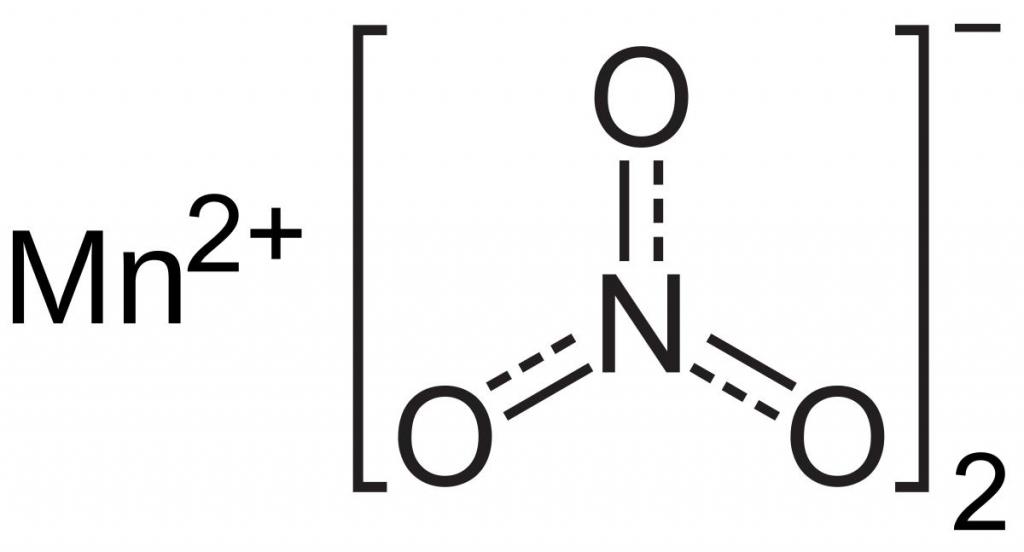
Рассматриваемое нами соединение (перманганат калия) является одним из наиболее применяемых в промышленности веществ – соединений марганца. Соль представлена кристаллами в виде правильных призм темно-фиолетового цвета. Она хорошо растворяется в воде и образует раствор малинового цвета, обладающий прекрасными бактерицидными характеристиками. Поэтому вещество нашло широкое применение как в медицине, так и в быту в качестве бактерицидного средства. Как и другие соединения семивалентного марганца, соль способна окислять многие соединения органической и неорганической природы. К разложению перманганата калия прибегают в химических лабораториях для получения небольших объемов чистого кислорода. Соединение окисляет сульфитную кислоту в сульфатную. В промышленности KMnO4 применяется для выделения газообразного хлора из соляной кислоты. Оно также окисляет большинство органических веществ, способно переводить соли двухвалентного железа в форму его трехвалентных соединений.
Видео:Задание 29 ОВР: перманганат калия в разных средах - видимые признаки реакций | Химия ЕГЭ | УМСКУЛСкачать

Опыты с марганцовкой
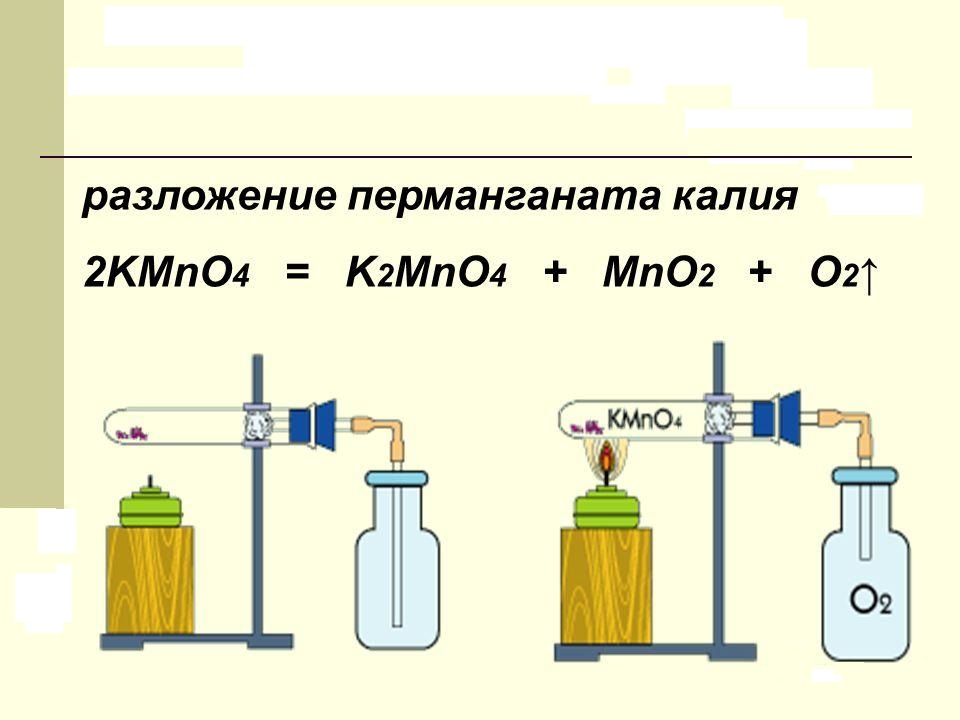
Вещество, в быту называемое марганцовкой, при нагревании разлагается. В продуктах реакции обнаруживается свободный кислород, двуокись марганца и новая соль – K2MnO4. В лаборатории этот процесс проводят для получения чистого кислорода. Химическое уравнение разложения перманганата калия можно представить так:
Сухое вещество, представляющее собой фиолетовые кристаллы в виде правильных призм, нагревают до температуры +200 °C. Катион марганца, находящийся в составе соли, имеет степень окисления, равную +7. Она снижается в продуктах реакции до величин +6 и +4 соответственно.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Окисление этилена
Газообразные углеводороды, относящиеся к различным классам органических соединений, имеют как одинарные, так и кратные связи между атомами углерода в составе своих молекул. Как определить присутствие пи-связей, лежащих в основе непредельного характера органического соединения? Для этого проводят химические опыты, пропуская исследуемое вещество (например, этен или ацетилен) через фиолетовый раствор перманганата калия. Наблюдается его обесцвечивание, так как непредельная связь разрушается. Молекула этилена окисляется и из непредельного углеводорода превращается в двухатомный предельный спирт – этиленгликоль. Данная реакция является качественной на наличие двойных или тройных связей.
Видео:Реакция этилена с раствором перманганата калияСкачать

Особенности химических проявлений KMnO4
Если степени окисления реагентов и продуктов реакции изменяются, значит происходит реакция окисления-восстановления. В ее основе лежит явление перемещения электронов от одних атомов к другим. Как и в случае с разложением перманганата калия, так и в других реакциях, вещество проявляет ярко выраженные свойства окислителя. Например, в подкисленном растворе сернистокислого натрия и перманганата калия образуется сульфаты натрия, калия и марганца, а также вода:
В этом случае ион серы является восстановителем, а марганец, входящий в сложный анион MnO4 — , проявляет свойства окислителя. Он принимает пять электронов, поэтому степень его окисления снижается с +7 до +2.
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

Влияние среды на протекание химической реакции
В зависимости от концентрации ионов водорода или гидроксильных групп различают кислый, щелочной или нейтральный характер раствора, в котором происходит окислительно-восстановительная реакция. Например, при избыточном содержании катионов водорода, ион марганца со степенью окисления +7 в перманганате калия понижает ее до +2. В щелочной среде, при высокой концентрации гидроксильных групп, сульфит натрия, взаимодействуя с перманганатом калия, окисляется до сульфата. Ион марганца со степенью окисления +7 переходит в катион с зарядом +6, находящийся в составе K2MnO4, раствор которого имеет зеленую окраску. В нейтральной среде сульфит натрия и перманганат калия реагируют между собой, при этом осаждается двуокись марганца. Степень окисления катиона марганца уменьшается с +7 до +4. В продуктах реакции также обнаруживаются сульфат натрия и щелочь – гидроксид натрия.
Видео:Получение кислорода из перманганата калияСкачать

Применение солей марганцевой кислоты
Реакция разложения перманганата калия при нагревании и другие окислительно-восстановительные процессы, проходящие с участием солей марганцевой кислоты, часто используются в промышленности. Например, окисление многих органических соединений, выделение газообразного хлора из соляной кислоты, превращение солей двухвалентного железа в трехвалентное. В сельском хозяйстве раствор KMnO4 применяют для предпосевной обработки семян и почвы, в медицине им обрабатывают поверхность ран, дезинфицируют воспаленные слизистые оболочки носовой полости, используют для обеззараживания предметов личной гигиены.
В нашей статье мы не только подробно изучили процесс разложения перманганата калия, но также рассмотрели его окислительные свойства и применение в быту и промышленности.
Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Реакция термического разложения перманганата калия
Видео:Перманганат калия разложениеСкачать

2KMnO4  K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
Реакция термического разложения перманганата калия с образованием манганата калия, оксида марганца(IV) и кислорода. Реакция протекает при температуре выше 200°C. Лабораторный метод получения кислорода.
Термическое разложение перекристаллизованного, просушенного и дегазированного перманганата калия в вакууме — лучший способ получения высокочистого кислорода, легко поддающийся контролю. [16]
Видео:ОКИСЛЕНИЕ АЛКЕНОВ ЕГЭ / жёсткое, мягкое окисление в органике с KMnO4Скачать

Марганец (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Марганцевая кислота. Поскольку семивалентный марганец является кислотообразующим элементом, ему соответствует кислота HMnO4. Марганцевая кислота – одна из немногих кислот, обладающих окраской. Ее растворы, а также растворы ее солей имеют характерный красно-фиолетовый цвет.
Получить марганцевую кислоту можно растворением оксида семивалентного марганца в холодной воде:
Но чаще применяют другой метод – окисление солей двухвалентного марганца диоксидом свинца или другим сильным окислителем в сильнокислой среде:
Марганцевая кислота устойчива только в разбавленных водных растворах, максимальная концентрация которых никогда не превышает 20%. При попытке получить более насыщенный раствор происходит разложение кислоты:
Аналогичный процесс наблюдается при нагревании растворов марганцевой кислоты.
Марганцевая кислота проявляет свойства очень сильной кислоты (степень диссоциации кислоты нередко превышает отметку в 90%). Она вступает в реакцию с большинством оснований и основных оксидов, разлагает соли слабых кислот и т. д.:
Во взаимодействии с металлами марганцевая кислота ведет себя как сильный окислитель: в то время как обычные неокисляющие кислоты (например, соляная или разбавленная серная) растворяют металлы с выделением водорода, марганцевая кислота вместо водорода образует осадок диоксида марганца:
Необходимо отметить, что окислительная способность у марганцевой кислоты преобладает над ее кислотными свойствами. Поэтому при возможности протекания двух процессов: кислотно-основного или окислительно-восстановительного – всегда будет идти последний. Примером может послужить взаимодействие с легко окисляющимися солями, такими как сульфиты. Обычные кислоты разлагают сульфиты с выделением сернистого газа, в котором сера имеет ту же степень окисления, что и в исходном сульфите (кислотно-основный процесс):
Но если сульфит обработать раствором марганцевой кислоты, вместо выделения газа происходит образование сульфатов, в которых степень окисления серы выше, чем в исходной соли, а также наблюдается выпадение осадка диоксида марганца:
Перманганаты – это соли, производные от марганцевой кислоты, с общей формулой MeMnO4 (Me – одновалентный металл). Все перманганаты аналогично образующей их кислоте окрашены в интенсивный красно-фиолетовый цвет, что позволяет использовать их в аналитической химии, так как даже небольшие количества перманганатов будут легко заметны благодаря своей сильной окраске.
С химической точки зрения перманганаты характеризуются, во-первых, сильными окислительными свойствами и, во-вторых, относительно небольшой устойчивостью.
Сильные окислительные свойства перманганатов проявляются в том, что окисляют практически все восстановители. В зависимости от среды они образуют различные продукты своего восстановления:
*) в сильнокислой среде перманганаты превращаются в соли двухвалентного марганца, что легко заметить по изменению цвета раствора с красно-фиолетового на бледно-розовый или (при малых концентрациях реагентов) практически бесцветный:
*) в слабокислой, нейтральной или слабощелочной среде в результате восстановления перманганатов образуется нерастворимый в воде оксид марганца (IV) темно-коричневого или черного цвета:
*) в сильнощелочной среде из перманганатов получаются манганаты, окрашенные в темно-зеленый цвет:
Обобщенно окислительные свойства перманганатов можно представить в виде трех полуреакций восстановления в зависимости от среды раствора:
Перманганаты относительно стабильны только при комнатной температуре и в кристаллическом виде. А при нагревании или при длительном нахождении в виде водных растворов они распадаются с выделением кислорода:
Иногда эту реакцию применяют для получения кислорода в лабораторных условиях.
МАРГАНЕЦ И ЕГО СОЕДИНЕНИЯ
Опыт 1. Получение гидроксида марганца (II) и изучение его свойств. В три пробирки внесите по 3-5 капель раствора сульфата марганца (II) и такой же объем 2 н. раствора щелочи. Отметьте цвет выпавшего осадка.
Размешайте осадок в первой пробирке при помощи стеклянной палочки и оставьте стоять в штативе на некоторое время. Во вторую пробирку к осадку прилейте 5-6 капель разбавленной соляной кислоты, в третью – такой же объем концентрированного раствора щелочи. Что наблюдается в каждом случае? Какие свойства – основные, кислотные или амфотерные – проявляет гидроксид двухвалентного марганца? Как изменился цвет осадка в первой пробирке? Отметьте неустойчивость гидроксида марганца (II) на воздухе.
Напишите уравнения реакций: а) получения гидроксида двухвалентного марганца, б) его взаимодействия с соляной кислотой, в) его взаимодействия с щелочью, г) окисления гидроксида марганца(II) до гидроксида четырехвалентного марганца кислородом воздуха с участием воды.
Опыт 2. Восстановительные свойства соединений двухвалентного марганца:
А) внесите в пробирку 3-5 капель раствора сульфата марганца (II) и такой же объем 2 н. раствора щелочи. К полученному осадку прилейте 3-4 капли раствора пероксида водорода. Что происходит? Если не наблюдается заметных изменений, содержимое пробирки осторожно нагрейте на пламени горелки. Какой цвет приобрел осадок? Составьте уравнения реакций получения осадка гидроксида марганца (II) и его окисления под действием пероксида водорода, учитывая, что образуется гидроксид четырехвалентного марганца;
Б) поместите в пробирку небольшое количество кристаллического оксида свинца (IV), затем прилейте 6-8 капель 2 н. раствора азотной или серной кислоты и 3-4 капли раствора нитрата или сульфата марганца (II). Содержимое пробирки прокипятите в течение нескольких минут. Дайте пробирке отстояться. После того как осядет непрореагировавший диоксид свинца, обратите внимание на цвет раствора. Для какого валентного состояния марганца характерен такой цвет соединений? Используя метод ионно-электронного баланса (метод полуреакций), составьте уравнение реакции, учитывая, что свинец восстанавливается до двухвалентного состояния.
Опыт 3. Получение нерастворимых соединений двухвалентного марганца. В три пробирки наберите по 2-3 капли раствора сульфата марганца (II). Затем в первую пробирку прилейте такой же объем раствора сульфида натрия; во вторую – карбоната натрия; в третью – фосфата натрия. Отметьте цвет образовавшихся осадков. Составьте уравнения протекающих реакций в молекулярной и ионной форме.
Опыт 4. Окислительные свойства оксида марганца (IV).
В пробирку внесите приблизительно половину микрошпателя кристаллического оксида марганца (IV) и прилейте 6-9 капель 2 н. раствора серной кислоты. К полученной смеси добавьте 1 микрошпатель сульфата железа (II) (соли Мора) и 6-9 капель дистиллированной воды. Встряхните пробирку до полного растворения оксида марганца (IV). К полученному раствору добавьте 1 каплю раствора гексацианоферрата(II) калия K4[Fe(CN)6]. Что наблюдаете? На присутствие какого иона указывает окраска раствора? Напишите уравнение реакции окисления оксидом марганца (IV) сульфата железа (II), используя электронно-ионный метод (метод полуреакций).
Опыт 5. Восстановительные свойства оксида четырехвалентного марганца. В фарфоровый тигель при помощи пинцета поместите кусочек твердого гидроксида калия или натрия, затем при помощи микрошпателя добавьте такое же количество кристаллического нитрата калия или натрия. Поставьте тигель на фарфоровый треугольник, помещенный на кольцо штатива, и осторожно нагрейте смесь до ее расплавления. Не прекращая нагревания, добавьте в расплав 1 микрошпатель оксида марганца (IV). Как изменился цвет расплава? Какое вещество сообщает зеленую окраску полученному расплаву? Напишите уравнение реакции окисления оксида марганца (IV) под действием нитрата калия или натрия в сильнощелочной среде, используя электронно-ионный метод (метод полуреакций).
Опыт 6. Термическое разложение перманганатов. Поместите в сухую пробирку несколько кристалликов перманганата калия и нагрейте в пламени горелки до полного разложения соли (до прекращения выделения газообразного кислорода). Полноту разложения установите с помощью тлеющей лучины. Когда разложение прекратится, а кристаллики перманганата калия превратятся в черный порошок, высыпьте их в пробирку с водой. Обратите внимание на цвет полученного раствора. Для какого валентного состояния марганца характерен такой цвет соединений? Оставьте пробирку на некоторое время. Как меняется цвет раствора после длительного стояния? Напишите уравнения следующих реакций: а) разложения перманганата калия при нагревании; б) диспропорционирования манганата калия в водном растворе.
Опыт 7. Восстановление перманганата калия сульфитом натрия в зависимости от среды раствора. В три пробирки наберите по 3-5 капель раствора перманганата калия. В первую пробирку добавьте 4-5 капель 2 н. раствора серной кислоты, во вторую – 4-5 капель дистиллированной воды и в третью – 4-5 капель концентрированного раствора щелочи. Затем во все пробирки внесите несколько кристалликов сульфита натрия. Как меняется окраска раствора в каждой пробирке? Напишите уравнения реакций для каждого случая, используя электронно-ионный метод (метод полуреакций).
Опыт 8. Восстановление перманганата калия иодидом калия в различной среде. В три пробирки наберите по 3-5 капель раствора перманганата калия. В первую пробирку добавьте 4-5 капель 2 н. раствора серной кислоты, во вторую – 4-5 капель дистиллированной воды и в третью – 4-5 капель концентрированного раствора щелочи. Затем во все пробирки прилейте по 4-5 капель раствора иодида калия. Содержимое второй пробирки слегка подогрейте. Как меняется окраска раствора в каждой пробирке? Какое вещество окрашивает раствор в желто-бурый цвет в первой пробирке? Какое вещество выпало в осадок во второй пробирке? Какое вещество окрасило раствор в зеленый цвет в третьей пробирке?
Напишите уравнения реакций для каждого случая, используя электронно-ионный метод (метод полуреакций), считая, что в щелочной среде иодид калия окисляется до иодата KIO3.
Опыт 9. Окисление перманганатом калия соединений двухвалентного марганца. Наберите в пробирку 3-5 капель раствора перманганата калия, затем добавьте столько же капель раствора сульфата марганца (II). Отметьте обесцвечивание раствора и образование бурого осадка. Опустите в пробирку лакмусовую бумажку. Как изменилась ее окраска? Какая среда в полученном растворе? Используя метод полуреакций (электронно-ионный баланс), составьте уравнение реакции, учитывая, что среди исходных веществ принимает участие вода.
Опыт 10. Восстановление перманганата калия под действием пероксида водорода. Наберите в пробирку 3-5 капель раствора перманганата калия и 4-5 капель 2 н. раствора серной кислоты. Затем прилейте 3-5 капель раствора пероксида водорода. Что наблюдается? По внешним признакам реакции установите, до какого валентного состояния марганца восстановился перманганат калия. Используя метод электронно-ионного баланса (метод полуреакций), составьте уравнение реакции.
🎬 Видео
Опыты по химии. Получение кислорода из перманганата калияСкачать

ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать

Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Опыты по химии. Получение кислорода из перманганата калия и собирание его способом вытеснения водыСкачать

ОВР с перманганатом калия.Скачать

Взаимодействие перманганата калия с сульфитом натрия в щелочной среде KMnO4 + KOH + Na2SO3Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Разложение перманганата калия. Химический опытСкачать

Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Взаимодействие этилена с раствором перманганата калияСкачать

Химический эксперимент марганцовка и глицеринСкачать




 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2















