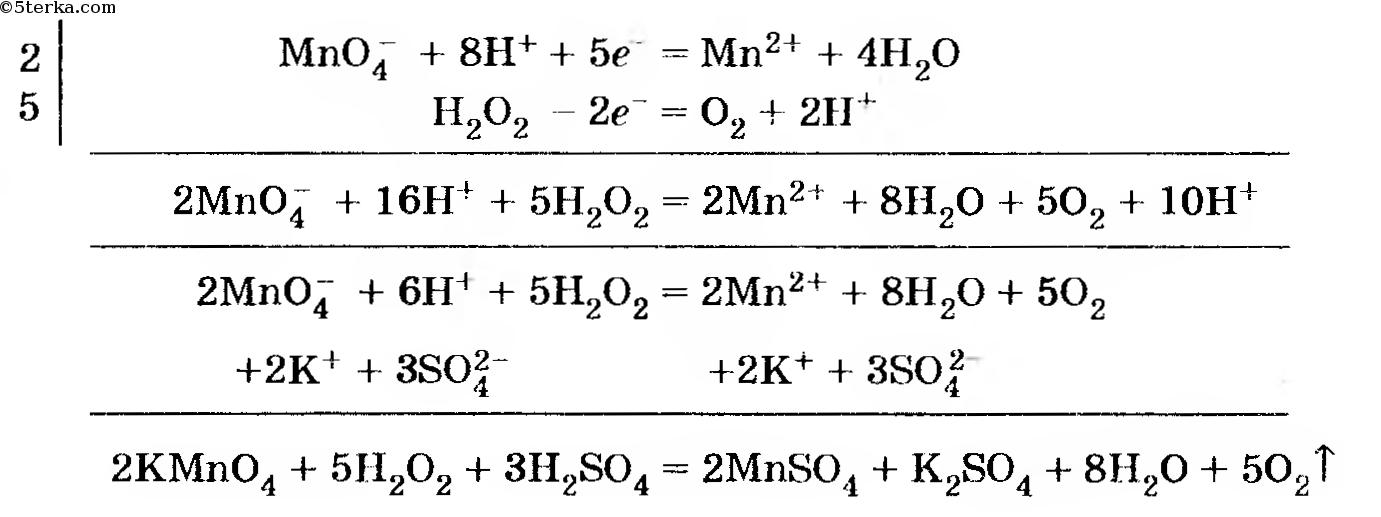- Реакция взаимодействия пероксида водорода и перманганата калия
- Реакция взаимодействия сероводорода и хлорноватой кислоты
- Реакция взаимодействия карбоната железа (II), воды и оксида углерода (IV)
- Реакция взаимодействия свинца и фтора
- Выбрать язык
- Популярные записи
- Предупреждение.
- Перманганат калия перекись водорода уравнение
- 3*. Составьте электронно-ионные уравнения для реакции пероксида водорода с перманганатом калия, приведенной в данном параграфе.
- 🔍 Видео
Видео:Реакция перманганата калия с перекисью водородаСкачать

Реакция взаимодействия пероксида водорода и перманганата калия
Уравнение реакции взаимодействия пероксида водорода и перманганата калия:
Реакция взаимодействия пероксида водорода и перманганата калия.
В результате реакции образуется кислород, оксид марганца(IV), гидроксид калия и вода.
Реакция протекает при нормальных условиях.
Формула для поиска по сайту: 3H2O2 + 2KMnO4 → 3O2 + 2MnO2 + 2KOH + 2H2O
Реакция взаимодействия сероводорода и хлорноватой кислоты
Реакция взаимодействия карбоната железа (II), воды и оксида углерода (IV)
Реакция взаимодействия свинца и фтора
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Химический гейзер (конц. перекись водорода и перманганат калия)Скачать

Перманганат калия перекись водорода уравнение
18.5. ОВР пероксида водорода
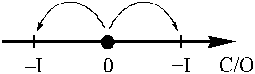
В молекулах пероксида водорода H2O2 атомы кислорода находятся в степени окисления –I. Это промежуточная и не самая устойчивая степень окисления атомов этого элемента, поэтому пероксид водорода проявляет и окислительные, и восстановительные свойства.
Окислительно-восстановительная активность этого вещества зависит от концентрации. В обычно используемых растворах с массовой долей 20 % пероксид водорода довольно сильный окислитель, в разбавленных растворах его окислительная активность снижается. Восстановительные свойства для пероксида водорода менее характерны, чем окислительные, и также зависят от концентрации.
Пероксид водорода – очень слабая кислота (см. приложение 13), поэтому в сильнощелочных растворах его молекулы превращаются гидропероксид-ионы.
В зависимости от реакции среды и от того, окислителем или восстановителем является пероксид водорода в данной реакции, продукты окислительно-восстановительного взаимодействия будут разными. Уравнения полуреакций для всех этих случаев приведены в таблице 1.
Уравнения окислительно-восстановительных полуреакций H2O2 в растворах
Реакция среды
H2O2 окислитель
H2O2 восстановитель
 + 2e – = 4H2O
+ 2e – = 4H2O


 + H2O + 2e – = 3OH
+ H2O + 2e – = 3OH 
 + OH
+ OH  – 2e – = O2 + H2O
– 2e – = O2 + H2OРассмотрим примеры ОВР с участием пероксида водорода.
Пример 1. Составьте уравнение реакции, протекающей при добавлении раствора йодида калия к раствору пероксида водорода, подкисленному серной кислотой.
| 1 | H2O2 + 2H3O  + 2e – = 4H2O + 2e – = 4H2O |
| 1 | 2I  – 2e – = I2 – 2e – = I2 |
H2O2 + 2H3O 

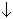
H2O2 + H2SO4 + 2KI = 2H2O + I2 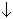
Пример 2. Составьте уравнение реакции между перманганатом калия и пероксидом водорода в водном растворе, подкисленном серной кислотой.
| 2 | MnO4  + 8H3O + 8H3O  + 5e – = Mn 2 + 5e – = Mn 2  + 12H2O + 12H2O |
| 5 | H2O2 + 2H2O – 2e – = O2 + 2H3O  |
2MnO4 


2KMnO4 + 3H2SO4 + 5H2O2 = 2MnSO4 + 8H2O + 5O2 
Пример 3. Составьте уравнение реакции пероксида водорода с йодидом натрия в растворе в присутствии гидроксида натрия.
| 3 | 6 | HO2  + H2O + 2e – = 3OH + H2O + 2e – = 3OH  |
| 1 | 2 | I  + 6OH + 6OH  – 6e – = IO3 – 6e – = IO3  + 3H2O + 3H2O |
3HO2 



3NaHO2 + NaI = 3NaOH + NaIO3
Без учета реакции нейтрализации между гидроксидом натрия и пероксидом водорода это уравнение часто записывают так:
Это же уравнение получится, если сразу (на стадии составления баланса) не принимать во внимание образование гидропероксид-ионов.
Пример 4. Составьте уравнение реакции, протекающей при добавлении диоксида свинца к раствору пероксида водорода в присутствии гидроксида калия.
Диоксид свинца PbO2 – очень сильный окислитель, особенно в кислотной среде. Восстанавливаясь в этих условиях, он образует ионы Pb 2 

| 1 | PbO2 + 2H2O + 2e – = [Pb(OH)3]  + OH + OH  |
| 1 | HO2  + OH + OH  – 2e – = O2 + H2O – 2e – = O2 + H2O |
PbO2 + H2O + HO2 

Без учета образования гидропероксид-ионов уравнение записывается так:
PbO2 + H2O2 + OH 


Если по условию задания добавляемый раствор пероксида водорода был щелочным, то молекулярное уравнение следует записывать так:
PbO2 + H2O + KHO2 = K[Pb(OH)3] + O2
Если же в реакционную смесь, содержащую щелочь, добавляется нейтральный раствор пероксида водорода, то молекулярное уравнение может быть записано и без учета образования гидропероксида калия:
PbO2 + KOH + H2O2 = K[Pb(OH)3] + O2
Среди окислительно-восстановительных реакций выделяют реакции дисмутации (диспропорционирования, самоокисления-самовосстановления).
| Реакции дисмутации – ОВР, в которых часть атомов одного и того же элемента в одной и той же степени окисления восстанавливается, а часть – окисляется. |
Примером известной вам реакции дисмутации является реакция хлора с водой:
Cl2 + H2O 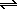
В этой реакции половина атомов хлора(0) окисляется до степени окисления +I, а вторая половина восстанавливается до степени окисления –I:
Составим методом электронно-ионного баланса уравнение аналогичной реакции, протекающей при пропускании хлора через холодный раствор щелочи, например KOH:
| 1 | Cl2 + 2e – = 2Cl  |
| 1 | Cl2 + 4OH  – 2e – = 2ClO – 2e – = 2ClO  + 2H2O + 2H2O |
2Cl2 + 4OH 


Все коэффициенты в этом уравнении имеют общий делитель, следовательно:
Cl2 + 2OH 


Cl2 + 2KOH = KCl + KClO + H2O
Дисмутация хлора в горячем растворе протекает несколько иначе:
10

2
 – 10e – = 2ClO3
– 10e – = 2ClO3  + 6H2O
+ 6H2O3Cl2 + 6OH 


3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Большое практическое значение имеет дисмутация диоксида азота при его реакции c водой (а) и с растворами щелочей (б):
1
 + 2H3O
+ 2H3O 
1
 – e – = NO3
– e – = NO3  + H2O
+ H2O1

1

2NO2 + 2H2O = NO3 

2NO2 + 2OH 


2NO2 + H2O = HNO3 + HNO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Реакции дисмутации протекают не только в растворах, но и при нагревании твердых веществ, например, хлората калия:
2
6
Еще один тип реакций, протекающих при нагревании твердых веществ – внутримолекулярные ОВР.
| Внутримолекулярные ОВР – ОВР, в которых атомы-окислители и атомы-восстановители входят в состав одного и того же вещества. |
Характерным и очень эффектным примером внутримолекулярной ОВР является реакция термического разложения дихромата аммония (NH4)2Cr2O7. В этом веществе атомы азота находятся в своей низшей степени окисления (–III), а атомы хрома – в высшей (+VI). При комнатной температуре это соединение вполне устойчиво, но при нагревании интенсивно разлагается. При этом хром(VI) переходит в хром(III) – наиболее устойчивое состояние хрома, а азот(–III) – в азот(0) – также наиболее устойчивое состояние. С учетом числа атомов в формульной единице уравнения электронного баланса:
1
1
а само уравнение реакции:
(NH4)2Cr2O7 = Cr2O3 + N2 

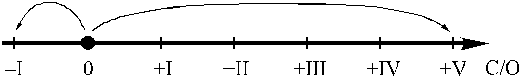
Другой важный пример внутримолекулярной ОВР – термическое разложение перхлората калия KClO4. В этой реакции хлор(VII), как и всегда, когда он выступает в роли окислителя, переходит в хлор(–I), окисляя кислород(–II) до простого вещества:
4
8
и, следовательно, уравнение реакции
KClO4 = KCl + 2O2
Аналогично разлагается при нагревании и хлорат калия KClO3, если разложение проводить в присутствии катализатора (MnO2): 2KClO3 = 2KCl + 3O2
В отсутствие катализатора протекает реакция дисмутации.
К группе внутримолекулярных ОВР относятся и реакции термического разложения нитратов.
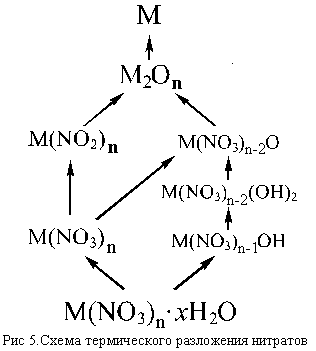
Обычно процессы, протекающие при нагревании нитратов довольно сложны, особенно в случае кристаллогидратов. Если в кристаллогидрате молекулы воды удерживаются слабо, то при слабом нагревании происходит обезвоживание нитрата [например, LiNO3 . 3H2O и Ca(NO3)2 4H2O обезвоживаются до LiNO3 и Ca(NO3)2], если же вода связана прочнее [как, например, в Mg(NO3)2 . 6H2O и Bi(NO3)3 . 5H2O], то происходят своего рода реакции » внутримолекулярного гидролиза» с образованием основных солей – гидроксид-нитратов [Mg(NO3)OH и Bi(NO3)2OH], которые при дальнейшем нагревании могут переходить в оксид-нитраты <[Be4(NO3)6O] и [Bi6O6](NO3)6>, последние при более высокой температуре разлагаются до оксидов.
Безводные нитраты при нагревании могут разлагаться до нитритов (если они существуют и при этой температуре еще устойчивы), а нитриты – до оксидов. Если нагревание проводится до достаточно высокой температуры, или соответствующий оксид малоустойчив (Ag2O, HgO), то продуктом термического разложения может быть и металл (Cu, Cd, Ag, Hg).
Несколько упрощенная схема термического разложения нитратов показана на рис. 5.
Примеры последовательных превращений, протекающих при нагревании некоторых нитратов (температуры приведены в градусах Цельсия):
KNO3 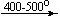
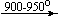
Ca(NO3)2 . 4H2O 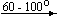
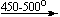
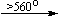
Mg(NO3)2 . 6H2O 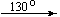
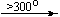
Cu(NO3)2 . 6H2O 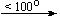

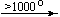
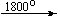
Bi(NO3)3 . 5H2O 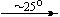
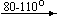
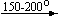
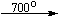
Несмотря на сложность происходящих процессов, при ответе на вопрос, что получится при » прокаливании» (то есть при температуре 400 – 500 o С) соответствующего безводного нитрата, обычно руководствуются следующими предельно упрощенными правилами:
1) нитраты наиболее активных металлов (в ряду напряжений – левее магния) разлагаются до нитритов;
2) нитраты менее активных металлов (в ряду напряжений – от магния до меди) разлагаются до оксидов;
3) нитраты наименее активных металлов (в ряду напряжений – правее меди) разлагаются до металла.
Используя эти правила, следует помнить, что в таких условиях
LiNO3 разлагается до оксида,
Be(NO3)2 разлагается до оксида при более высокой температуре,
из Ni(NO3)2 помимо NiO может получиться и Ni(NO2)2,
Mn(NO3)2 разлагается до Mn2O3,
Fe(NO3)2 разлагается до Fe2O3;
из Hg(NO3)2 кроме ртути может получиться и ее оксид.
Рассмотрим типичные примеры реакций, относящихся к этим трем типам:
KNO3 KNO2 + O2
| 2 | N +V +2e– = N +III |
| 1 | 2O– II – 4e– = O2 |
2KNO3 = 2KNO2 + O2
Zn(NO3)2 ZnO + NO2 
| 4Ѕ | N +V + e– = N +IV |
| 1Ѕ | 2O– II – 4e– = O2 |
2Zn(NO3)2 = 2ZnO + 4NO2 
AgNO3 Ag + NO2 
| 2 | Ag +1 + e– = Ag |
N +5 + e– = N +4
2AgNO3 = 2Ag + 2NO2 + O2
| ОВР конмутации – ОВР, в которых происходит выравнивание степени окисления атомов одного и того же элемента, находившихся до реакции в разных степенях окисления. |
Эти реакции могут быть как межмолекулярными, так и внутримолекулярными. Например, внутримолекулярные ОВР, протекающие при термическом разложении нитрата и нитрита аммония, относятся к реакциям конмутации, так как здесь происходит выравнивание степени окисления атомов азота:
NH4NO3 = N2O 

NH4NO2 = N2 

При более высокой температуре (250 – 300 o С) нитрат аммония разлагается до N2 и NO, а при еще более высокой (выше 300 o С) – до азота и кислорода, и в том и в другом случае образуется вода.
Примером межмолекулярной реакции конмутации является реакция, протекающая при сливании горячих растворов нитрита калия и хлорида аммония:
NH4 

Если проводить аналогичную реакцию, нагревая смесь кристаллических сульфата аммония и нитрата кальция, то, в зависимости от условий, реакция может протекать по-разному:
Первая и третья из этих реакций – реакции конмутации, вторая – более сложная реакция, включающая как конмутацию атомов азота, так и окисление атомов кислорода. Какая из реакций будет протекать при температуре выше 250 o С, зависит от соотношения реагентов.
Реакции конмутации, приводящие к образованию хлора, протекают при обработке соляной кислотой солей кислородсодержащих кислот хлора, например:
Также по реакции конмутации образуется сера из газообразных сероводорода и диоксида серы:
ОВР конмутации довольно многочисленны и разнообразны – к ним относятся даже некоторые кислотно-основные реакции, например:
Для составления уравнений ОВР конмутации используется как электронно-ионный, так и электронный баланс, в зависимости от того, в растворе протекает данная реакция или нет.
Изучая главу IX, вы познакомились с электролизом расплавов различных веществ. Так как подвижные ионы присутствуют и в растворах, электролизу могут быть подвергнуты также растворы различных электролитов.
Как при электролизе расплавов, так и при электролизе растворов, обычно используют электроды, изготовленные из материала, не вступающего в реакцию (графита, платины и т. п.), но иногда электролиз проводят и с » растворимым» анодом. » Растворимый» анод используют в тех случаях, когда необходимо получить электрохимическим способом соединение элемента, из которого изготовлен анод. При электролизе имеет большое значение разделены анодное и катодное пространство, или электролит в процессе реакции перемешивается – продукты реакции в этих случаях могут оказаться разными.
Рассмотрим важнейшие случаи электролиза.
1. Электролиз расплава NaCl. Электроды инертные (графитовые), анодное и катодное пространства разделены. Как вы уже знаете, в этом случае на катоде и на аноде протекают реакции:
K: Na 
A: 2Cl 
Записав таким образом уравнения реакций , протекающих на электродах, мы получаем полуреакции, с которыми можем поступать точно так же, как в случае использования метода электронно-ионного баланса:
K:
 + e – = Na
+ e – = NaA:
 – 2e – = Cl2
– 2e – = Cl2Сложив эти уравнения полуреакций, получаем ионное уравнение электролиза
2Na 

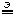
а затем и молекулярное
2NaCl 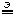
В этом случае катодное и анодное пространства должны быть разделены для того, чтобы продукты реакции не реагировали между собой. В промышленности эта реакция используется для получения металлического натрия.
2. Электролиз расплава K2CO3. Электроды инертные (платиновые). Катодное и анодное пространства разделены.
K:
 + e – = K
+ e – = KA:
 – 4e – = 2CO2
– 4e – = 2CO2  + O2
+ O2
4K+ + 2CO3 2 
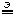


2K2CO3 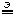

3. Электролиз воды (H2O). Электроды инертные.
K:
 + 2e – = H2 + 2H2O
+ 2e – = H2 + 2H2OA:
 – 4e – = O2 + 2H2O
– 4e – = O2 + 2H2O4H3O 

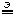


2H2O 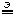

Вода – очень слабый электролит, в ней содержится очень мало ионов, поэтому электролиз чистой воды протекает крайне медленно.
4. Электролиз раствора CuCl2. Электроды графитовые. В системе присутствуют катионы Cu 2 





При электролизе растворов простые (одноатомные) анионы разряжаются (окисляются) раньше, чем сложные (многоатомные) ионы.
Следовательно в нашем случае на анода будут разряжаться хлоридные ионы.
K:
 + 2e – = Cu
+ 2e – = CuA:
 – 2e – = Cl2
– 2e – = Cl2Cu 2 

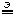
CuCl2 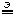
5. Электролиз раствора CuSO4. Электроды графитовые.
В водных растворах за счет автопротолиза воды (2H2O 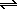







K:
 + 2e – = Cu
+ 2e – = CuK:
 + 2e – = Cu
+ 2e – = CuA:

A:

 + 6H2O
+ 6H2O 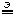 2Cu + O2
2Cu + O2  + 4H3O
+ 4H3O 
 + 2H2O
+ 2H2O 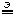 2Cu + O2
2Cu + O2  + 4H
+ 4H 
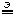 2Cu + O2
2Cu + O2  + H2SO4
+ H2SO4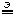 2Cu + O2
2Cu + O2  + H2SO4
+ H2SO4На катоде выделяется медь, на аноде – кислород, а в растворе накапливается серная кислота.
Ионы металлов, стоящих в ряду напряжений правее водорода, при электролизе растворов солей разряжаются.
В принципе ионы металлов, стоящих в ряду напряжений левее водорода, при электролизе водных растворов не должны разряжаться. В этих случаях должен был бы выделяться водород. Практически, из-за специфических особенностей разряда ионов водорода, при электролизе выделяются и более активные металлы.
Ионы металлов, стоящих в ряду напряжений между алюминием и водородом при электролизе растворов солей разряжаются вместе с водородом.
При этом, чем активнее металл, тем больше водорода выделяется, и тем большая часть электрической энергии расходуется бесполезно.
6. Электролиз раствора NiBr2. Электроды графитовые. Катодное и анодное пространства разделены.
K:
 + 2e – = Ni
+ 2e – = NiA:
 – 2e – = Br2
– 2e – = Br2Ni 2 

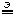
NiBr2 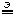
Одновременно с этим на катоде выделяется водород, в растворе накапливаются гидроксид-ионы, и, как следствие, протекает побочная реакция образования нерастворимого гидроксида никеля.
Ионы металлов, стоящие в ряду напряжений до алюминия при электролизе не разряжаются.
7. Электролиз раствора Na2SO4. Электроды платиновые. Раствор перемешивается.
В этом случае на катоде разряжаются не ионы натрия, а ионы оксония (2H3O 

K:

A:

10H2O 



Так как раствор перемешивается, происходит реакция нейтрализации. В итоге получаем
2H2O 

то есть, реакцию электролиза воды. При электролизе воды для повышения ее электропроводности в нее специально добавляют соли с неразряжающимися катионами и анионами, что значительно ускоряет процесс электролиза.
8. Электролиз раствора CuSO4. Анод медный.
K:
 + 2e – = Cu
+ 2e – = CuA:

В результате сложения уравнений полуреакций мы можем прийти к ошибочному выводу, что ничего не происходит. На самом деле эти полуреакции описывают реальный технологический процесс электролитического рафинирования (очистки) меди: с катода, содержащего примеси на анод переходят только ионы меди.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

3*. Составьте электронно-ионные уравнения для реакции пероксида водорода с перманганатом калия, приведенной в данном параграфе.
задача №3
к главе «Задачи к § 24.5».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
🔍 Видео
Вода, марганцовка, жидкое мыло, перекись водородаСкачать

Опыты по химии. Получение кислорода из перманганата калияСкачать

Реакция перманганата калия и перекиси водорода в кс | 2MnO4- + 6H+ + 5H2O2 → 2Mn2+ + 8H2O + 5O2Скачать

ОВР - Пероксид Водорода И Перманганат Калия В Кислой СредеСкачать

Галилео. Эксперимент. Разложение перекиси водородаСкачать

ОКСИД МАРГАНЦА - Пероксид Водорода И Перманганат КалияСкачать

ПЕРМАНГАНАТ КАЛИЯ | МАРГАНЦОВКА | Химические свойства марганцовки | Химические реакции | ХимияСкачать

Выделение кислорода при помощи химической реакции (добавим перекись водорода к перманганату калия)Скачать

Перекись водорода+перманганат калия.Что будет???Скачать

МНОГО КИСЛОРОДА - Реакция Перекиси Водорода И Перманганата КалияСкачать

Перекись водорода с перманганатомСкачать

ОБЕСЦВЕЧИВАНИЕ РАСТВОРА. Реакция Перманганата Калия, Серной Кислоты И Перекись Водорода.Скачать

Как получают перекись водородаСкачать

Получение кислорода из пероксида водородаСкачать

Перманганат калия с пероксидом водорода.Скачать

Эксперименты с ПЕРЕКИСЬЮСкачать

Реакция ПЕРЕКИСИ ВОДОРОДА и МАРГАНЦОВКИ. Химические опыты. Chemical experiment. Домашние опытыСкачать