- Получение бензола и его
- получения бензола
- Способы получения аренов
- Получение аренов
- 1. Реакция Вюрца-Фиттига
- 2. Дегидроциклизация алканов
- 3. Дегидрирование циклоалканов
- 4. Декарбоксилирование солей бензойной кислоты
- 5. Алкилирование бензола и его гомологов
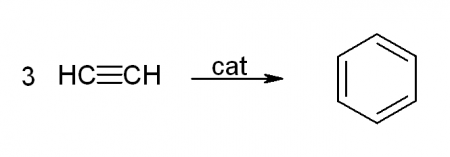
- 6. Тримеризация ацетилена
- 7. Получение стирола
- Бензол: рассказываем по полочкам
- Что такое бензол
- Физические свойства
- Получение бензола
- Химические свойства
- Реакции окисления
- Влияние бензола на организм человека
- Структура
- Бензол как наркотик
- Производство
- Экология
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

Получение бензола и его
Мы рассмотрим «классические» методы получения бензола — те, которые описаны в каждом учебнике по химии, и рассмотрим получение из разных классов органических соединений, т.к. цепочки реакций, которые предлагаются в ЕГЭ, подразумевают умение получать бензол «из всего» 🙂
«Классические» реакции
Видео:Получение бензола и его гомологов. 2 часть. 11 класс.Скачать

получения бензола
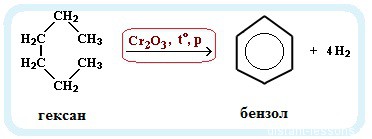
- Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод «ароматизация нефти», т.к. из нее получают гексан:
С6H14 → C6H6 + 4H2
Обратите внимание на условия реакции — давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
С6H12 → C6H6 + 3H2
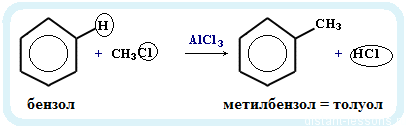
- Получение гомологов бензола: алкилирование бензола:
реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
C6H6 + CH3Cl → C6H5CH3 + HCl
Именная реакция — реакция Зелинского. Получение бензола из ацетилена:
3С2H2 → C6H6
1. Получение бензола из неорганических веществ:
- 1 вариант:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского : 3С2H2 → C6H6 Это самый короткий путь получения. - 2 вариант:
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH( Br )-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH( Br )-(CH2)4-CH2 Br
CH3-CH( Br )-(CH2)4-CH2 Br + Zn → C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Видео:Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

Способы получения аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Видео:Все качественные реакции на углеводороды за 45 минут | Химия ЕГЭ для 10 класса | УмскулСкачать

Получение аренов
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
Видео:Занятие 2. ЕГЭ по химии. Органическая химияСкачать

2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
Видео:Качественные реакции на органические вещества.Скачать

5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
Видео:Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
Видео:10 класс - Химия - Азотосодержащие органические соединения. Амины. АнилинСкачать

7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Видео:Органическая химия с нуля | Химия ЕГЭ 2023 | УмскулСкачать

Бензол: рассказываем по полочкам
Без существования органических веществ не стал бы возможен скоростной режим современной жизни. Бензин, пластмассы, красители, лекарства, синтетическая резина — это составные части нашей действительности. Многие из них содержат бензол — бесцветную летучую жидкость, которая обладает токсичным, канцерогенным действием.
Давайте подробно узнаем, что такое бензол, какие у него физические и химические свойства, где применяется, как действует на организм человека. А также о симптомах острого и хронического отравления этим веществом, оказанию первой помощи, проводимом лечении при интоксикации, возможных её последствиях и о мерах профилактики.
Видео:1.1. Алканы: Строение, номенклатура, изомерия. Подготовка к ЕГЭ по химииСкачать

Что такое бензол
Это органическое вещество, прозрачная жидкость со сладковатым запахом. По химической структуре относится к простейшим ароматическим углеводородам.
Основные естественные источники бензола в природе — каменный уголь и нефть. В лабораторных условиях возможна его полимеризация (образование) из ацетилена. Промышленные способы получения бензола — коксование из каменного угля, а также каталитический риформинг и пиролиз бензиновых фракций нефти.
Химическая формула бензола — C6H6. Это циклическая структура из шести атомов углерода была открыта в 1865 году немецким химиком Фридрихом Августом Кекуле. А впервые в чистом виде бензол был обнаружен ещё раньше — в 1825 г. английский физик Фарадей выделил его светильного газа.
Физические свойства бензола включают плохую растворимость в воде, смешиваемость с органическими растворителями, высокую степень воспламеняемости, горючесть, взрывоопасность. Его расплавление происходит при температуре 5,5–6,0 °C, испарение при 79,6–80,5 °C, кипение — 80,1 °C. Он легче воды, так как имеет низкую относительную плотность (0,88 г/см3). Является легкорастворимым в эфире и спирте веществом.
Химические свойства бензола обусловлены его принадлежностью к группе ненасыщенных углеводородов с циклической структурой. Поэтому ему типичны реакции окисления и замещения. Методика промышленной разработки была предложена немецким учёным Гофманом, выделившим вещество из каменноугольной смолы.
Бензол сильно ядовит. Токсическое действие происходит:
- ингаляционно — при вдыхании паров;
- трансдермально — при непосредственном контакте с кожей или слизистыми оболочками;
- перорально — при ошибочном употреблении жидкости внутрь.
Многие интересные факты о бензоле, связанные с изучением его структуры и свойств, сохранились и дошли до наших дней. Так, немецкий учёный Гофман, читая лекции студентам о физических свойствах углеводородов, всегда цитировал слова знакомой ему дамы, что запах бензола такой же, как у стираных перчаток. А идея кольцевой структуры бензола якобы пришла к химику Кекуле во сне — змея, состоящая из шести атомов углерода, свернулась в кольцо и укусила себя за хвост.
Что такое бензол — видеоурок
Видео:Повторяем темы 10 класса: углеводороды | ЕГЭ по химии 2022Скачать

Физические свойства
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфиром, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

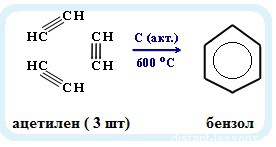
Получение бензола
К основным способам получения бензола относятся:
— дегидроциклизация гексана (катализаторы – Pt, Cr3O2)
CH3 –(CH2)4-CH3 → C6H6 + 4H2 (toC, p, kat = Cr2O3);
C6H12 → C6H6 + 3H2 (toC, kat = Pt, Ni);
— тримеризация ацетилена (реакция протекает при нагревании до 600oС, катализатор – активированный уголь)
3HC≡CH → C6H6 (t = 600oC, kat = Сactiv).
Видео:Качественные реакции в органической химии | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
- Взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол:
C6H6 + H2C = CH2 →AlCl3∗HCl C6H5CH2CH3C6H6 + CH2 = CH − CH3 →AlCl3 ∗ HCl C6H5CH(CH3)2
- Взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения):
C6H6 + Cl2 →FeCl3 C6H5Cl + HCl
- В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
C6H6 + 3Cl2 →T,hν C6H6Cl6
- При взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
C6H6 + 6Br2 →H2SO4 ∗ SO3 C6Br6 + 6HBr
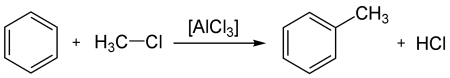
- Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов:
- Реакция ацилирования по Фриделю—Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
C6H6 + (CH3CO)2O →AlCl3 C6H5COCH3 + CH3COOH 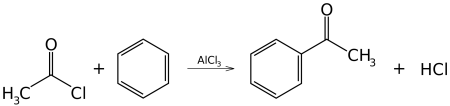
C6H6 + C6H5COCl →AlCl3 C6H5COC6H5 + HCl
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С. В третьей реакции образуется бензофенон (дифенилкетон).
- Реакция формилирования — взаимодействие бензола со смесью СО и НСl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
C6H6 + CO + HCl →AlCl3 C6H5COH + HCl
- Реакции сульфирования и нитрования (электрофильное замещение):
C6H6 + HNO3 →H2SO4 C6H5NO2 + H2OC6H6 + H2SO4 → C6H5SO3H + H2O
- Восстановление бензола водородом (каталитическое гидрирование):
C6H6 + 3H2 →Ni/Pd,Pt;t C6H12
Реакции окисления
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:
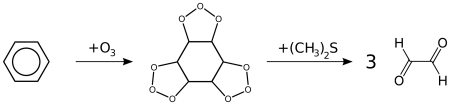
- Реакция озонолиза. Также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
- Реакция горения. Горение бензола является предельным случаем окисления. Бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем:
2C6H6 + 15O2 → 12CO2 + 6H2O
Видео:2 этап РТ, химия, 2023 год 1 вариантСкачать

Влияние бензола на организм человека
Ароматические углеводороды — это неестественные для живого организма соединения, нарушающие его биологические процессы. Как типичный представитель этой группы бензол является токсичным веществом.
Основные органы-мишени углеводорода — нервная система и костный мозг. Нейротоксическое действие ярко проявляется при острых отравлениях, а гемотоксическое — при хронических. Однако влияние бензола на организм человека этим не ограничивается. Опосредованно он может действовать на печень, почки, сердце.
Предельно допустимая концентрация (ПДК) содержания бензола в атмосферном воздухе населённых мест не должна превышать 0,1–0,3 мг/м3.
Видео:Ковалентная Неполярная Связь — Химическая связь // Химия 8 классСкачать

Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n−6), но в отличие от углеводородов ряда этилена, C2H4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
В специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. Бензольное кольцо входит в состав множества различных соединений.
Видео:Свойства азотсодержащих органических веществ | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Бензол как наркотик

Тем не менее при вдыхании паров бензола у человека может возникать острое токсическое опьянение, сопровождающееся зрительными и слуховыми галлюцинациями, эйфорией. В наркологии это состояние носит название токсикомании, обусловленной вдыханием испарений летучих органических жидкостей. Как и при других видах наркомании, в этом случае существует опасность передозировки с возможностью летального исхода, а также возникновение физической и психической зависимости.
Видео:080 Изучение физических свойств бензолаСкачать

Производство
На сегодняшний день существует несколько принципиально различных способов производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
Получение бензола методом Реппе
Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3C2H2 → C6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло, работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции.
Экология
Бензол экологически небезопасное вещество, токсикант антропогенного происхождения. Основными источниками бензола, поступающего в окружающую среду со сточными водами или выбросами в атмосферу, являются нефтехимические и коксохимические промышленные предприятия, производство топлива и транспорт. Из водоёмов бензол легко улетучивается, cпособен к трансформации из почв в растения, что несёт серьёзную угрозу экосистемам.
Бензол обладает свойством кумуляции, вследствие своей липофильности он способен депонироваться в клетках жировой ткани животных, тем самым отравляя их.