- Решение задач по химии на гидролиз солей
- Гидролиз хлорида свинца (II)
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора хлорида свинца (II)
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 📹 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Решение задач по химии на гидролиз солей
Задание 211.
Какие из солей RbCl, Сr2(SО4)3, Ni(NО3)2, Na2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН ( > 7
а) PbСl2 — соль слабого многокислотного основания Pb(OH)2 и сильной одноосновной кислоты. В этом случае катионы Pb 2+ связывают ионы ОН — воды, образуя катионы основной соли PbOH + . Образование Pb(OH)2 не происходит, потому что ионы PbOH + диссоциируют гораздо труднее, чем молекулы Pb(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
PbCl2 ⇔ Pb 2+ + 2C l- ;
Pb 2+ + H2O ⇔ PbOH + + H +
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору PbCl2 кислую среду, рН
в) Сr2(SO4)3 — соль слабого многокислотного основания Сr(OH) 3 и сильной многоосновной кислоты H2SO4. В этом случае катионы Cr 3+ связывают ионы ОН — воды, образуя катионы основной соли CrOH 2+ . Образование Cr(OH) 2+ и Cr(OH)3 не происходит, потому что ионы CrOH 2+ диссоциируют гораздо труднее, чем ионы Cr(OH) 2+ и молекулы Cr(OH)3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
Молекулярная форма процесса:
В растворе появляется избыток ионов водорода, которые придают раствору Cr2(SO4)3 кислую среду, рН
в) Ni(NO3)2 — соль слабого многокислотного основания Ni(OH)2 и сильной одноосновной кислоты HNO3. В этом случае катионы Ni 2+ связывают ионы ОН — воды, образуя катионы основной соли NiOH+. Образование Ni(OH)2 не происходит, потому что ионы NiOH + диссоциируют гораздо труднее, чем молекулы Ni(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору Ni(NO3)2 кислую среду, рН
г) Na2SO3 — соль сильного однокислотного основания NaOH и слабой многоосновной кислоты H2SO3. В этом случае анионы SO3 2- связывают ионы водорода Н + воды, образуя анионы кислой соли HSO3 — . Образование H2SO3 не происходит, так как ионы HSO3 — диссоциируют гораздо труднее, чем молекулы H2SO3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору Na2SO3 щелочную среду, рН > 7.
Задание 212.
К раствору Al2(SO4)3 добавили следующие вещества: а) Н2SО4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
Решение:
Гидролиз соли Al2(SO4)3
а) Соль Al2(SO4)3 гидролизуется по катиону, а H2SO4 диссоциирует в водном растворе:
Если растворы этих веществ находятся в одном сосуде, то идёт угнетение гидролиза соли Al2(SO4)3, ибо образуется избыток ионов водорода Н + и равновесие гидролиза сдвигается влево.
б) KOH диссоциирует в водном растворе:
Если растворы этих веществ находятся в одном сосуде, то идёт гидролиза соли Al2(SO4)3 и диссоциации КОН, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН — = Н2О). При этом гидролитическое равновесие соли Al2(SO4)3 и диссоциация КОН сдвигаются вправо и гидролиз соли и диссоциация основания идут до конца с образованием осадка Al(OH)3. По сути, при смешивании Al2(SO4)3 и КОН протекает реакция обмена. Ионно-молекулярное уравнение процесса:
Молекулярное уравнение процесса:
в) Соль Al2(SO4)3 гидролизуется по катиону, а соль Na2SO3 – по аниону:
Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н + + ОН — ⇔ Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Al(OH)3 и слабого электролита H2SO3:
г) Соль Al 2 (SO 4 ) 3 и соль ZnSO4 гидролизуется по катиону:
Al 3+ + H2O ⇔ AlOH 2+ + H + ;
Zn 2+ + H2O ⇔ ZnOH + + H +
Если растворы этих солей находятся в одном сосуде, то идёт взаимное угнетение гидролиза каждой из них, ибо избыточное количество ионов Н + вызывает смещение гидролитического равновесие влево, в сторону уменьшения концентрации ионов водорода Н + .
Задание 213.
Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2СО3 или Na2SO3; FеСl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Решение:
Гидролиз солей
а) Na2CO3 и Na2SO3 – соли сильного основания и слабой кислоты гидролизуются по аниону:
При равных условиях гидролизу в большей степени будет подвергаться соль, у которой константа диссоциации кислоты, образующая соль, будет меньшей, т. е. гидролизу в большей степени подвергается соль, образованная относительно менее сильной кислотой. Так как КD(H2CO3) . 10 -7 ; КD(H2SO3) = 1,4 . 10 -2 ], следовательно, гидролизу в большей степени будет подвергаться Na2CO3.
б) FеСl3 или FeCl2 — соли слабого основания и сильной кислоты гидролизуются по катиону:
Fe 3+ + H2O ⇔ FeOH 2+ + H + ;
Fe 2+ + H2O ⇔ FeOH + + H +
При равных условиях гидролизу в большей степени будет подвергаться соль, у которой константа диссоциации основания, образующая соль, будет меньшей, т. е. гидролизу в большей степени подвергается соль, образованная относительно менее сильным основанием.
Так как КD[(Fe(OH)3] . 10 -11 ; КD[(Fe(OH)2]=1,3 . 10 -4 ], следовательно, гидролизу в большей степени будет подвергаться FeCl3.
Задание 214.
При смешивании растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнение происходящего совместного гидролиза.
Решение:
Гидролиз соли Al2(SO4)3
Соль Al2(SO4)3 гидролизуется по катиону, а соль Na2SO3 – по аниону:
Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н + + ОН — ⇔ Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Al(OH)3, газа СО2 и слабого электролита H2О:
Задание 215.
Какие из солей NaBr, Na2S, K2CO3, CoCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 + и OH — . Ионы Na + , Br — , H + и OH — останутся в растворе. Таким образом, обратная гидролизу реакция нейтрализации протекает практически до конца. Так как в растворе соли присутствуют равные количества ионов H + и OH — , то раствор имеет нейтральную среду, рН = 0.
б) Na2S – соль сильного однокислотного основания NaOH и слабой многоосновной кислоты H2S. В этом случае анионы S 2- связывают ионы водорода Н + воды, образуя анионы кислой соли НS — . Образование H2S не происходит, так как ионы НS — диссоциируют гораздо труднее, чем молекулы H2S. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
Na2S ⇔ 2К + + S 2- ;
S 2- + H2O ⇔ НS — + ОH —
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору Na2S щелочную среду, рН > 7.
в) К2CO3 — соль сильного однокислотного основания КOH и слабой двухосновной кислоты Н2СО3. В этом случае анионы CO3 2- связывают ионы водорода Н + воды, образуя анионы кислой соли HCO3 — . Образование H2CO3 не происходит, так как ионы HCO3 — диссоциируют гораздо труднее, чем молекулы H2CO3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору К2CO3 щелочную среду, рН > 7.
г) СоСl2 — соль слабого многокислотного основания Со(OH)2 и сильной одноосновной кислоты. В этом случае катионы Со 2+ связывают ионы ОН — воды, образуя катионы основной соли СоOH + . Образование Со(OH)2 не происходит, потому что ионы СоOH + диссоциируют гораздо труднее, чем молекулы Со(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
СоCl2 ⇔ Со 2+ + 2Cl — ;
Со 2+ + H2O ⇔ СоOH + + H +
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору СоCl2 кислую среду, рН
Видео:Реакции ионного обмена. 9 класс.Скачать

Гидролиз хлорида свинца (II)
PbCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
PbCl2 + HOH ⇄ PbOHCl + HCl
Полное ионное уравнение
Pb 2+ + 2Cl — + HOH ⇄ PbOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Pb 2+ + HOH ⇄ PbOH + + H +
Видео:Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
PbOHCl + HOH ⇄ Pb(OH)2 + HCl
Полное ионное уравнение
PbOH + + Cl — + HOH ⇄ Pb(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
PbOH + + HOH ⇄ Pb(OH)2 + H +
Видео:Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Среда и pH раствора хлорида свинца (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Please wait.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

We are checking your browser. gomolog.ru
Видео:Гидролиз солей. 9 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Lead(II) Chloride Synthesis (PbCl2)Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df8c43d8a010b6b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
📹 Видео
Сокращённое ионное уравнениеСкачать

Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать

How to Balance Pb(NO3)2 + KCl = PbCl2 + KNO3Скачать

Is PbCl2 Soluble or Insoluble in Water?Скачать

Связь pH и pKa для буферных растворов (видео 6) | Буферные растворы | ХимияСкачать
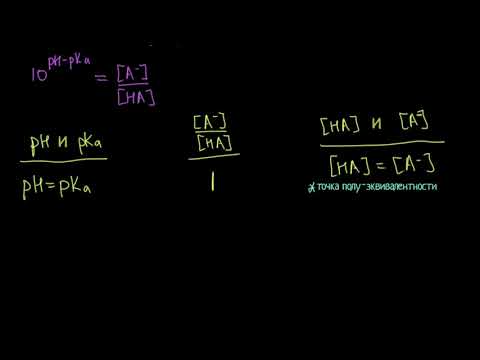
Химия👨🔬👨🔬👨🔬 S+KOH=K2SO3+K2S+H2O Окраска из-за образования полисульфидов: K2S + (n-1)S = K2SnСкачать

Химия глобального потепления. Рамиз АлиевСкачать

Наименование ионов и ионных соединений (видео 16) | Химия. ВведениеСкачать

Видеолекция Метод молекулярных орбиталей Основные положенияСкачать
Механизм Sn2 (бимолекулярное нуклеофильное замещение)Скачать

Пи-связи и sp2-гибридизованные орбитали (видео 14) | Химические связи и структура молекул | ХимияСкачать
