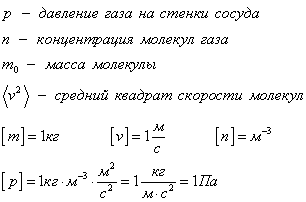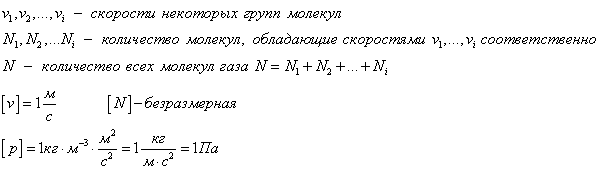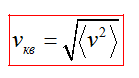- Тестирование онлайн
- Идеальный газ
- Параметры состояния газа
- Основное уравнение молекулярно-кинетической теории
- Температура
- Вопрос 2. Параметры состояния и уравнения состояния.
- Уравнение состояния идеального газа
- Уравнение состояния идеального газа
- Термодинамические параметры газа
- Объединенный газовый закон. Приведение объема газа к нормальным условиям
- Молярная газовая постоянная. Определение числового значения постоянной Больцмана
- Уравнение Клапейрона — Менделеева. Плотность газа
- Зависимость средней квадратичной скорости молекул газа от температуры
- Изохорический процесс
- Изобарический- процесс
- Изотермический процесс
- Внутренняя энергия идеального газа
- Работа газа при изменении его объема
- 🎬 Видео
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Тестирование онлайн
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Идеальный газ
Это несуществующая физическая модель газа, который состоит из большого числа молекул, размеры которых ничтожно малы по сравнению со средними расстояниями между ними. Молекулы такого газа можно считать материальными точками, это означает, что их вращательное и колебательное движения не принимаются во внимание. Движение молекул происходит без столкновений с другими молекулами, подчиняется законам Ньютона. Соударения молекул со стенками сосуда являются абсолютно упругими.
Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Параметры состояния газа
Давление, температура и объем — параметры состояния газа. Или их называют макропараметрами. Температура — внешняя характеристика скоростей частиц газа. Давление — внешняя характеристика соударений со стенками, например, сосуда. Объем — место, куда заключены частицы газа. Газ занимает весь предоставленный ему объем. Существуют еще внешние параметры, например тела или поля, действующие на газ из вне.
Микропараметры (маленькие, внутренние характеристики) газа — это параметры, которые мы не можем оценить без специальных экспериментов, например, скорость и направление движения каждой молекулы газа.
Состояние термодинамической системы, когда все ее параметры при неизменных внешних условиях не изменяются со временем, называют равновесным.
Видео:Урок 90. Уравнение состояния термодинамической системы. Уравнение состояния газа.Скачать
Основное уравнение молекулярно-кинетической теории
Уравнение связывает микропараметры и макропараметры (давление, объем и температуру) идеального газа.
Рассмотрим идеальный газ, который находится в кубическом сосуде. Каждая молекула упруго сталкивается со стенкой сосуда, при этом изменятся ее импульс. Столкновение всех молекул со стенкой на макроуровне ощущается как давление газа на сосуд. В формулах будут присутствовать средние значения, потому что какая-то молекула движется быстрее, какая-то помедленнее, для того, чтобы оценить примерную скорость, будем брать средние значения.
Основное уравнение мкт имеет вид

Средний квадрат скорости молекул

Средняя квадратичная скорость vкв молекул это квадратный корень из среднего квадрата скорости
Средняя кинетическая энергия молекул

Можно вывести формулы

Видео:Уравнение состояния идеального газаСкачать

Температура
Это макропараметр, который характеризует способность тел к теплопередаче. Если два тела разной температуры контактируют, то произойдет переход энергии или передача теплоты от более горячего к холодному. Установится тепловое равновесие, все части будут одинаковой температуры.
Температура характеризует интенсивность движения частиц, поэтому связана со средней кинетической энергией частиц. Из опыта известно, что средняя кинетическая энергия молекул не зависит от вида газа и определяется температурой.


Связь между температурами по шкале Цельсия и по шкале Кельвина
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Вопрос 2. Параметры состояния и уравнения состояния.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Вопрос 3. Термодинамическая работа, координаты P-V.
Термодинамическая работа: 


Удельная работа: 


— Если 

— Если 

— При малом изменении объёма давление практически не изменяется.


1. В случае если 

2. В случае если дано уравнение процесса — 




Вопрос 4. Потенциальная работа, координаты P-V, распределение работы.
Потенциальная работа – работа, вызываемая изменением давления.

— Если 

— Если 

— При малом изменении давления объём почти не меняется.


1. В случае если 

2. В случае если дано уравнение процесса — 



переданная внешним системам.

________________________________________________________
Вопрос 16. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах P-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
Если 







Так как 

Для идеального газа:
Первое начало термодинамики: 
Для идеального газа: 







Вопрос 63. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
Дросселирование – процесс движения вещества через внезапное сужение. Причинами возникновения местных сопротивлений при движении потока рабочего тела по каналам могут быть запорные, регулирующие и измерительные устройства; повороты, сужение, загрязнение каналов и т.д.
Эффект Джоуля-Томсона — изменение температуры вещества при адиабатном дросселировании.
Рис. 1.7. Процесс дросселирования в h-s диаграмме
Различают дифференциальный и интегральный дроссель – эффекты. Величина дифференциального дроссель – эффекта определяется из соотношения


Интегральный дроссель-эффект: 
Коэффициент Джоуля – Томсона выводится из математических выражений первого начала термодинамики и второго начала термостатики
1. Если дроссель–эффект положительный (Dh > 0), то снижается температура рабочего тела (dT 0);
3. Если дроссель–эффект равен нулю (Dh = 0), то температура рабочего тела не изменяется. Состояние газа или жидкости, которому соответствует условие Dh = 0, называется точкой инверсий.
___________________________________________________________________
Двухтактный дизель
Рабочий процесс в двухтактном дизеле в основном протекает так же как и в двухтактном карбюраторном двигателе, и отличается только тем что продувка цилиндра производится чистым воздухом. По окончании ее оставшийся в цилиндре воздух сжимается. В конце сжатия через форсунку впрыскивается топливо в камеру сгорания и воспламеняется.Схема двухтактного дизеля с кривошипно-камерной продувкой показана на рисунке 14, а, а индикаторная диаграмма — на рисунке 14, 6.
Рабочий процесс в двухтактном дизеле протекает следующим образом.
Первый такт. При движении поршня вверх от н. м. т. к в. м. т. вначале происходит окончание продувки, а затем окончание выпуска. На индикаторной диаграмме продувка изображена линией b»— a» а выпуск — а» — а.
После закрытия выпускного окна поршнем в цилиндре происходит сжатие воздуха. Линия сжатия на индикаторной диаграмме изображена кривой а—с. В это время под поршнем в кривошипной камере создается разрежение, под действием которого автоматический клапан открывается, и в кривошипную камеру засасывается чистый воздух. В начале движения поршня вниз, вследствие уменьшения объема под поршнем, давление воздуха в кривошипной камере повышается, и клапан закрывается.
Второй такт. Поршень движется от в. м. т. к н. м. т. Впрыск и горение топлива начинаются перед концом сжатия и заканчиваются после того, как поршень пройдет в. м. т. По окончании горения происходит расширение. Протекание процесса расширения на индикаторной диаграмме изображено кривой r-b.
Остальные процессы, выпуск и продувка протекают так же, как и в карбюраторном двухтактном двигателе.
Вопрос 2. Параметры состояния и уравнения состояния.
Параметры состояния — физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные (не зависят от массы системы) и экстенсивные (пропорциональны массе).
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы. Простейшие параметры:
1. 
2. 
3. 
4. 
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Изменение состояния системы называется процессом.
Равновесный процесс — это непрерывная последовательность равновесных состояний системы.
Обратимый процесс — равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса.
Термодинамическим процессомпринято считать обратимый равновесный процесс.
Равновесные процессы могутбыть изображены графически на диаграммах состояния p-v, р-Т и т. д. Линия, изображающая изменение параметров в процессе, называется кривой процесса. Каждая точка кривой процесса характеризует равновесное состояние системы.
Уравнение термодинамического процесса – уравнение вида 
Уравнение состояния для простого тела — 
Идеальный газ – совокупность материальных точек (молекул или атомов), находящихся в хаотическом движении. Эти точки рассматриваются как абсолютно упругие тела, не имеющие объёма и не взаимодействующие друг с другом. Уравнением состояния идеального газа является уравнение Менделеева-Клапейрона:
PV=nRT, где P – давление, [Па]; V – объём системы [м 3 ]; n – количество вещества, [моль]; T – термодинамическая температура, [К]; R – универсальная газовая постоянная.
Реальный газ – газ, молекулы которого взаимодействуют друг с другом и занимают определённый объём. Уравнением состояния реального газа является обобщённое уравнение Менделеева-Клапейрона:

_____________________________________________________________
Видео:Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Уравнение состояния идеального газа
Содержание:
Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона». Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Видео:Связь между давлением, объёмом и температурой газаСкачать

Уравнение состояния идеального газа
Уравнение состояния идеального газа — это p = nkT называется уравнением Менделеева Клапейрона и оно даёт взаимосвязь трёх важнейших макроскопических параметров, описывающих состояние идеального газа давления, объёма и температуры. Поэтому уравнение Менделеева Клапейрона называется ещё уравнением состояния идеального газа.
Термодинамические параметры газа
В предыдущих главах было показано, что при описании свойств газа можно пользоваться величинами, характеризующими молекулярный мир (микромир), например энергией молекулы, скоростью ее движения, массой и т. п. Числовые значения таких величин мы можем определять только с помощью расчета. Все такие величины принято называть микроскопическими (от греческого «микрос» — малый).
Однако для описания свойств газов можно пользоваться и такими величинами, числовые значения которых находят простым измерением с помощью приборов, например давлением, температурой и объемом газа. Значения таких величин определяются совместным действием огромного числа молекул, поэтому они называются макроскопическими (от греческого «макрос» — большой).
Соотношение (4.1): 
Если взять определенную массу газа т, то при постоянных р, V и Т газ будет находиться в равновесном состоянии. Когда происходят изменения этих параметров, то в газе протекает тот или иной процесс. Если этот процесс состоит из ряда непрерывно следующих друг за другом равновесных состояний газа, то он называется равновесным процессом. Равновесный процесс должен протекать достаточно медленно, так как при быстром изменении параметров давление и температура не могут иметь соответственно одинаковые значения во всем объеме газа. В этой главе рассматриваются только равновесные процессы в газах, при которых масса газа остается постоянной.
Когда процесс в газе заканчивается, то газ переходит в новое состояние, а его параметры приобретают новые постоянные числовые значения, вообще говоря, отличные от их значений в начале процесса. Если же при постоянной массе газа значения всех его параметров в начале и в конце процесса окажутся одинаковыми, то процесс называется круговым или замкнутым.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом. Газовый закон, выражающий связь между всеми тремя параметрами газа, называется объединенным газовым законом.
Отметим еще, что такого процесса в газе, при котором изменялся бы только один параметр газа, не существует, так как значения этих параметров взаимосвязаны. Примером сказанного является закон Шарля, выражающий связь между р и Т.
Объединенный газовый закон. Приведение объема газа к нормальным условиям
Связь между давлением, объемом и температурой определенной массы газа устанавливается с помощью соотношения (4.9):
Поскольку 

Так как при постоянной массе газа N остается неизменным, 
Поскольку значения р, V и Т в (5.2) относятся к одному и тому же состоянию газа, можно следующим образом сформулировать объединенный газовый закон: при постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Следовательно, если числовые значения параметров в начале процесса, происходящего с какой-либо определенной массой газа, обозначить через р1 , V1 и Т1, а их значения в конце процесса соответственно через р2 , V2 и Т2, то
Формулы (5.2) и (5.3) представляют собой математическое выражение объединенного газового закона.
На практике иногда нужно установить, какой объем V0 займет имеющаяся масса газа при нормальных условиях, т. е. при Т0=273 К и при р0=1,013 . 10 5 Па. Если значения параметров для этой массы газа в каком-либо произвольном состоянии, отличном от нормального, обозначить через р, V и Т, то на основании (5.3) получаем 
Формула (5.4) позволяет приводить объем заданной массы газа к нормальным условиям.
Молярная газовая постоянная. Определение числового значения постоянной Больцмана
Формула (5.1) справедлива для любой массы газа, в которой содержится N молекул. Если применить эту формулу к одному молю какого-либо газа, то N нужно заменить постоянной Авогадро NA, а V — объемом одного моля Vмоль
Так как в одном моле любого газа содержится одно и то же число молекул NA, то произведение 

Числовое значение R можно найти, если применить (5.5) к состоянию одного моля газа при нормальных условиях, так как при этом 
Это числовое значение R в СИ необходимо запомнить, так как им часто пользуются при расчетах и при решении задач.
Теперь легко найти числовое значение постоянной Больнмана 



Уравнение Клапейрона — Менделеева. Плотность газа
Выясним, как будет выглядеть соотношение (5.1), если в него ввести молярную газовую постоянную R. Так как N — полное число молекул в массе газа т, а 
где 
Поскольку 


Соотношение (5.7) называется уравнением Клапейрона — Менделеева или уравнением состояния для произвольной массы идеального газа. Для одного моля идеального газа уравнение Клапейрона — Менделеева принимает вид
С помощью формулы (5.7) легко выяснить, какими величинами определяется плотность газа. Так как 
Зависимость средней квадратичной скорости молекул газа от температуры
Выясним теперь, как можно с помощью вычислений находить среднюю квадратичную скорость движения молекул газа 



Отметим, что под т в формуле (5.10) подразумевается масса одной молекулы в кг. Так как 



Наконец, из (5.9) следует, что 
Среднюю квадратичную скорость можно находить по любой из формул (5.10)—(5.12). Из функции Максвелла можно получить формулы для средней арифметической скорости и наивероятнейшей скорости. Средняя арифметическая скорость
Наконец, наивероятнейшую скорость вычисляют так:
(Используя график функции Максвелла (рис. 3.3), поясните, почему 


Изохорический процесс
Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого «изос» — равный, одинаковый). Поскольку имеется три параметра газа, существует три различных изопроцесса. Первый из них (изохорический) рассмотрен выше (§ 4.3). Процесс в газе, который происходит при постоянной массе и неизменном объеме, называется изохорическим (от греческого «хора» — пространство). Графики для этого процесса называются изохорами (рис. 4.3).
Отметим, что к любому изопроцессу применим объединенный газовый закон и формулы (5.3), (5.7) и (5.8) с учетом того, что один из параметров остается постоянным. При изохорическом процессе постоянным остается объем V, поэтому формула (5.3) после сокращения на V принимает вид
Итак, изохорический процесс подчиняется закону Шарля: при постоянной-массе газа и неизменном объеме давление газа прямо пропорционально его абсолютной температуре. Это видно и из уравнения Клапейрона — Менделеева (5.7):
Так как V, т, 
Изобарический- процесс
Процесс в газе, который происходит при постоянной массе и неизменном давлении, называется изобарическим (от греческого «барос» — тяжесть). Этот процесс был изучен французским физиком Л. Гей-Люссаком в 1802 г.
Поскольку при изобарическом процессе р постоянно, то после сокращения на р формула (5.3) принимает вид
Формула (5.16) является математическим выражением закона Гей-Люссака: при постоянной массе газа и неизменном давлении объем газа прямо пропорционален его абсолютной температуре. (Это видно и из уравнения Клапейрона — Менделеева (5.7): так как р, т, 
На рис. 5.1 схематически изображен опыт Гей-Люссака. Колба с газом помещается в сосуд с водой и льдом.
В пробку вставлена трубка, изогнутая таким образом, что свободный конец ее горизонтален. Газ в колбе отделен от окружающего воздуха небольшим столбиком ртути в трубке. Температуру газа определяют по термометру, а объем — по положению столбика ртути. Для этого на трубке нанесены деления, соответствующие определенному внутреннему объему трубки (при градуировке трубки можно учесть и расширение сосуда при нагревании, но оно сравнительно мало’).
Сначала по положению столбика ртути 1 определяют 
Оказывается, что изобара представляет собой прямую линию (рис. 5.2, а), которая пересекается с осью абсцисс в точке А.
Из подобия треугольников на рис. 5.2, а следует
Обозначив 

Здесь 
Если повторять этот опыт для разных газов или для разных масс газа, то все графики будут пересекаться в точке А, соответствующей t=—273°С (рис. 5.2, б), т. е. коэффициент 
Отметим, что для газов коэффициенты 


Изотермический процесс
Процесс в газе, который происходит при постоянной температуре, называется изотермическим.
Изотермический процесс в газе был изучен английским ученым Р. Бойлем и французским ученым Э. Мариоттом. Установленная ими опытным путем связь получается непосредственно из формулы (5.3) после сокращения на Т:
Формула (5.18) является математическим выражением закона Бойля — Мариотта: при постоянной массе газа и неизменной температуре давление газа обратно пропорционально его объему. Иначе говоря, в этих условиях произведение объема газа на соответствующее давление есть величина постоянная: 
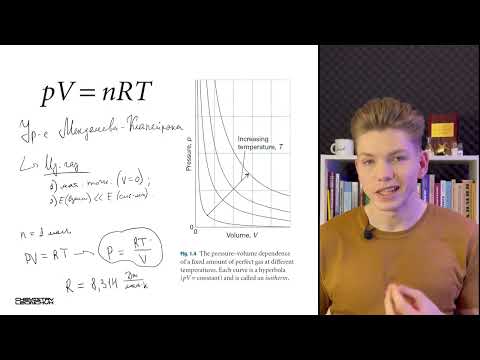
Соотношение (5.19) можно получить и из (5.7) или (5.8), так как при постоянном Г справа в формулах (5.7) и (5.8) стоит постоянная величина. График зависимости р от V при изотермическом процессе в газе представляет собой гиперболу и называется изотермой. На рис. 5.3 изображены три изотермы для одной и той же массы газа, но при разных температурах Т.
Отметим еще, что из формулы (5.9) непосредственно вытекает, что при изотермическом процессе плотность газа изменяется прямо пропорционально давлению:
(Подумайте, как проверить закон Бойля — Мариотта на опыте.)
Внутренняя энергия идеального газа
Как отмечалось, силы взаимодействия молекул в идеальном газе отсутствуют. Это означает, что молекулярно-потенциальной энергии у идеального газа нет. Кроме того, атомы идеального газа представляют собой материальные точки, т. е. не имеют внутренней структуры, а значит, не имеют и энергии, связанной с движением и взаимодействием частиц внутри атома. Таким образом, внутренняя энергия идеального газа представляет собой только сумму знамений кинетической энергии хаотического движения всех его молекул:
Поскольку у материальной точки вращательного движения быть не может, то у одноатомных газов (молекула состоит из одного атома) молекулы обладают только поступательным движением. Так как среднее значение энергии поступательного движения молекул определяется соотношением(4.8): 



Для произвольной массы одноатомного идеального газа имеем
Если молекула газа состоит из двух жестко связанных атомов (двухатомный газ), то молекулы при хаотическом движении приобретают еще и вращательное движение, которое происходит вокруг двух взаимно перпендикулярных осей. Поэтому при одинаковой температуре внутренняя энергия двухатомного газа больше, чем одноатомного, и выражается формулой
Наконец, внутренняя энергия многоатомного газа (молекула содержит три или больше атомов) в два раза больше, чем у одно-атомного при той же температуре:
поскольку вращение молекулы вокруг трех взаимно перпендикулярных осей вносит в энергию теплового движения такой же вклад, как поступательное движение молекулы по трем взаимно перпендикулярным направлениям.
Отметим, что формулы (5.23) и (5.24) теряют силу для реальных газов при высоких температурах, так как при этом в молекулах возникают еще колебания атомов, что ведет к увеличению внутренней энергии газа. (Почему это не относится к формуле (5.22)?)
Работа газа при изменении его объема
Физический смысл молярной газовой постоянной. Опыт показывает, что сжатый газ в процессе своего расширения может выполнять работу. Приборы и агрегаты, действия которых основаны на этом свойстве газа, называют пневматическими. На этом принципе действуют пневматические молотки, механизмы для закрывания и открывания дверей на транспорте и т. д.
Представим себе цилиндр с подвижным поршнем, заполненный газом (рис. 5.4).
Пока давление газа внутри цилиндра и окружающего наружного воздуха одинаковы, поршень неподвижен. Пусть при этом температура газа и окружающей среды равна 
Будем теперь медленно нагревать газ в цилиндре до температуры 






Нетрудно сообразить, что при изохорическом процессе работа газа равна нулю, так как никакого изменения объема, занятого газом, в этом случае не происходит. Вообще следует помнить, что газ выполняет работу только в процессе изменения своего объема, т. е. при 


Выясним, как можно определить работу газа по графику зависимости р от V в том или ином газовом процессе. При изобарическом процессе график зависимости р от V представляет собой прямую линию, параллельную оси абсцисс, так как р постоянно. Из рис. 5.5 видно, что работа газа в этом случае численно равна заштрихованной площади.
Выясним, как найти работу газа при изотермическом процессе. На рис. 5.6 изображена изотерма идеального газа. При таком процессе газ выполняет работу, так как 




Разбивая интервал 





Можно строго доказать, что работа газа при любом процессе выражается площадью, ограниченной двумя ординатами, отрезком оси абсцисс и графиком того процесса в координатах V и р.
Выясним теперь физический смысл молярной газовой постоянной R. Применяя формулу (5.25) к одному молю идеального газа, получим
Но из уравнения Клапейрона — Менделеева (5.8) для одного моля можно записать для двух состояний газа:
Подставляя это выражение в (5.26), будем иметь 
Из (5.27) следует, что молярная газовая постоянная численно равна работе, совершаемой одним молем идеального газа при его изобарическом нагревании на один кельвин.
Из соотношения 
Услуги по физике:
Лекции по физике:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
🎬 Видео
Уравнение состояния идеального газаСкачать

Физика. 10 класс. Уравнение состояния идеального газа /23.11.2020/Скачать

идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Газовые законыСкачать

Термодинамические системы, параметры. Равновесное, неравновесное состояния терм. систем. 10 класс.Скачать

ЕГЭ по физике. Теория #25. Идеальный газ. Уравнение состояния идеального газаСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Физика 10 класс. Уравнение состояния идеального газа, уравнение МенделееваСкачать

Исследование уравнения состояния идеального газаСкачать